一种光交联HA-Tyr壳-核结构水凝胶微针及其制备方法与应用
本发明属于生物医药,具体涉及一种光交联ha-tyr壳-核结构水凝胶微针及其制备方法与应用。
背景技术:
1、透明质酸(ha)是一种在天然细胞外基质中发现的非硫酸化糖胺聚糖。它是一种生物可降解、无毒、生物相容性好、低免疫原性和无炎性的线性多糖,还可以与细胞表面的cd44受体相互作用,直接影响组织稳态,促进细胞的增殖和迁移。ha水凝胶已广泛应用于骨关节炎治疗、手术伤口愈合、胚胎植入、药物输送、组织工程等。但天然的ha机械强度较差,在体内易被透明质酸酶降解,可以引入物理交联或化学交联改善ha的机械强度,克服体内应用的局限性。将酪胺(tyr)引入ha骨架形成透明质酸-酪胺(ha-tyr)可以诱导酶促或光交联反应,形成具有三维交联结构的水凝胶,可以有效改善机械强度、控制药物释放速率,在生物医学领域已经得到了广泛的应用。
2、光交联法具有固化热能小、交联程度可控、时空精准可控、操作简便易行等优势,根据使用光源不同可以分为紫外光交联和可见光交联。紫外光的生物相容性差,不易透射入组织中,治疗深度远不如可见光交联法。可见光交联常用的交联剂有ru(ii)聚吡啶配合物、核黄素(rf)、樟脑醌等。ru(ii)聚吡啶配合物和过硫酸铵(aps)介导的共价交联主要是通过产生酪氨酸自由基,并且在两个芳环之间形成di-tyr桥,形成ha-tyr光交联水凝胶。通过改变ru和aps的浓度、比例以及光照时间,来控制ha-tyr的交联速率和机械性能,得到不同机械强度、释药速率的ha-tyr水凝胶,满足不同递药形式的要求。ru(ii)聚吡啶配合物和过硫酸铵(aps)具有一定的生物毒性,但是在交联浓度下较为安全,并且aps可以随着交联反应消耗而减轻毒性。
3、微针作为一种新型的透皮给药形式,不仅可以有效避免穿透口服药物的肝脏首过效应和胃肠道消化等问题,而且相比于注射给药等形式,微针给药的患者依从性更好,可以保持皮肤的完整性。传统的透皮给药形式面临的最大的难题就是皮肤角质层的保护作用,皮肤是人体的天然屏障,大多数药物的透皮速率、透过量以及滞留量都很难达到治疗所需的疗效。微针可以有效打破角质层的物理及脂性皮肤屏障,以微创方式将药物控制并精确地输送到特定皮肤层和其他组织。并且通过微针与纳米颗粒相结合,可以更好地促进药物经皮吸收,进一步提高药物的透皮效果。
4、目前,未见光交联ha-tyr水凝胶在微针方面的应用。
技术实现思路
1、发明目的:本发明目的在于针对现有技术的不足,提供一种光交联ha-tyr壳-核结构水凝胶微针,基于光交联ha-tyr水凝胶机械强度、交联速度可控的特点,合成包载光敏剂纳米颗粒的光交联ha-tyr壳-核结构水凝胶微针,提高药物透皮速率,进一步控制光敏剂的释放,提高药物的抗肿瘤效果,为水凝胶微针在生物医学领域的应用提供更多的理论支持。
2、技术方案:本发明的目的通过下述技术方案实现:
3、本发明提供了一种光交联ha-tyr壳-核结构水凝胶微针,将ha-tyr溶液加入到微针模板形成水凝胶外壳,再将光敏剂纳米颗粒加入到水凝胶外壳中,制备得到所述光交联ha-tyr壳-核结构水凝胶微针;所述水凝胶包括透明质酸-酪胺、光交联剂和氧化剂。
4、优选地,所述光交联剂为ru(ii)聚吡啶配合物,所述氧化剂为过硫酸铵aps。
5、优选地,所述光交联剂与氧化剂摩尔比为1:1~30。
6、进一步优选地,所述光交联剂与氧化剂摩尔比为1:10。
7、本发明还提供了上述光交联ha-tyr壳-核结构水凝胶微针的制备方法,包括以下步骤:
8、(1)调节ha-tyr溶液ph为碱性,加入光交联剂溶液和氧化剂溶液,得到混合溶液a;
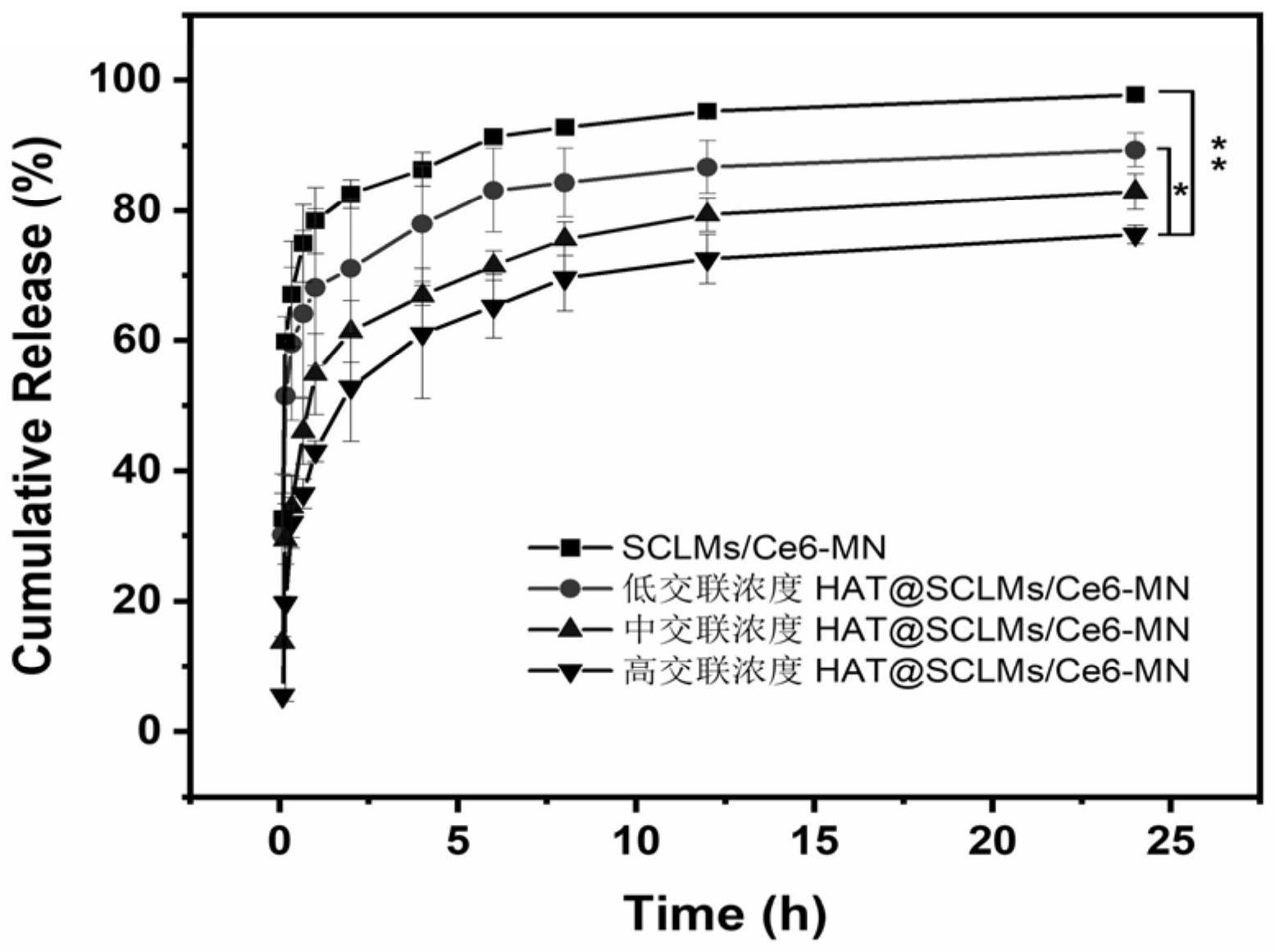
9、(2)将混合溶液a加入到微针模板表面,光照反应得到光交联ha-tyr水凝胶,干燥得到微针a;
10、(3)将ha水溶液和光敏剂纳米颗粒等比例混合,得到混合溶液b;
11、(4)将混合溶液b加入到微针a的表面,加入微针底座,干燥得到光交联ha-tyr壳-核结构水凝胶微针。
12、本发明主要采用模板法制备水凝胶微针,将纳米载体(即光敏剂纳米颗粒)与微针相结合,实现药物释放的精准可控,提高药物递送效率。
13、优选地,步骤(1)中,所述ha-tyr溶液浓度为0.5~2%;所述光交联剂溶液浓度为50~600μm,所述氧化剂溶液浓度为0.5~6mm。
14、进一步地,所述ha-tyr溶液浓度为2%,所述光交联剂溶液浓度为50~300μm,所述氧化剂溶液浓度为0.5~3mm。
15、更进一步地,所述光交联剂溶液浓度为300μm,所述氧化剂溶液浓度为3mm。
16、本发明通过改变氧化剂浓度和光交联剂浓度实现对于水凝胶机械强度的控制,从而形成机械性能和交联速率可调控的水凝胶微针外壳,继而实现药物释放的精准可控。
17、优选地,步骤(2)中,所述微针模板为聚二甲基硅氧烷pdms模具;所述光照的时间为0~20min;进一步优选1~5min;更进一步地优选3min。
18、进一步地,所述pdms模具具有棱锥形孔状阵列,所述模具为10×10阵列,微针高度1000μm,微针基底直径300μm,微针间距750μm。
19、优选地,步骤(3)中,所述ha水溶液浓度为1.25~5%,所述光敏剂纳米颗粒为ce6纳米颗粒,所述ce6纳米颗粒浓度为5~15mg/ml。
20、进一步地,所述ha水溶液浓度为5%;所述ce6纳米颗粒浓度为15mg/ml。
21、进一步地,所述ce6纳米颗粒为sclms/ce6。ce6药物溶解性差,sclms/ce6可以明显改善其溶解性,并且纳米颗粒改善透皮效率,增强抗肿瘤效果。
22、优选地,步骤(4)中,所述微针底座为pmma底座,pmma底座可以有效防止药物在底座的扩散,可以使其富集在针尖部位。
23、本发明制备方法一个优选地具体实施方式是:
24、(1)将ha-tyr溶解在pbs缓冲液中,加入0.1m naoh调节ph为6~8,得到ha-tyr溶液;将ru(ii)聚吡啶配合物溶解于pbs缓冲液中得到ru(ii)聚吡啶配合物溶液;将aps溶解于pbs缓冲液得到aps溶液;将ru(ii)聚吡啶配合物溶液和aps溶液加入到ha-tyr溶液中,得到混合溶液a;
25、(2)将混合溶液a加入到pdms微针模板表面,4000r/min离心并去除上层溶液,置于蓝光下光照3min,反应得到光交联ha-tyr水凝胶,室温干燥过夜,得到微针a;
26、(3)将ha溶于水中,得到ha水溶液;将ha溶液和ce6纳米颗粒溶液等比例混合,得到混合溶液b;
27、(4)将混合溶液b加入到微针a的表面,4000r/min离心并去除表面溶液,加入pmma底座,室温干燥,得到光交联ha-tyr壳-核结构水凝胶微针。
28、本发明还提供了上述光交联ha-tyr壳-核结构水凝胶微针在光动力治疗肿瘤中的应用。本发明的光交联水凝胶外壳具有良好的生物相容性,以此类水凝胶为外壳制备的微针,在皮下可实现可控的溶胀度和药物释放,对增强微针透皮给药体系的缓控释具有重要意义。
29、有益效果:
30、(1)本发明制备的光交联ha-tyr壳-核结构水凝胶微针可以有效改善ha微针中机械强度不可控的缺点,利用光交联水凝胶作为壳-核结构微针的外壳,可以有效提高机械强度,并且实现机械强度和释药速率的精准可控,增强药物的透皮效果,延长药物体内滞留时间,大大增强ce6纳米颗粒的透皮率,实现药物缓释。
31、(2)本发明采用的光交联水凝胶,改变氧化剂浓度和光交联剂浓度,可以有效控制水凝胶的交联强度,有效改变水凝胶的机械强度,控制释药速度。同时,ru(ii)聚吡啶配合物和aps在交联浓度下,具有良好的生物相容性,在生物医疗领域有着良好的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!