一种逆转肿瘤细胞耐药性的药物组合及其制作方法和应用
本发明涉及生物医药,具体为一种逆转肿瘤细胞耐药性的药物组合及其制作方法和应用。
背景技术:
1、顺铂(cisplatin,ddp)是一类广谱抗癌药,通过形成链内或者链间交联影响dna的复制、合成,从而引起细胞的凋亡[1](详情请参阅参考文献内容),据统计,在中国以顺铂为主或有顺铂参与配合的化疗方案占所有化疗方案的70%~80%,然而,顺铂的临床应用很大程度受限于肿瘤细胞的多药耐药性[2](详情请参阅参考文献内容),肿瘤多药耐药性是指肿瘤细胞对某种抗癌药物产生耐药的同时,对其他多种结构各异、作用机制不同的抗癌药物产生交叉耐药性的现象;
2、体内外实验研究表明谷胱甘肽s转移酶(glutathione s-transferase,gsts)和外转运蛋白家族过表达,或酶活性过度升高,可以保护细胞不受化疗药物的攻击,与肿瘤多药耐药性的发生密切相关[2-5](详情请参阅参考文献内容),gsts属人类ⅱ相抗氧化酶家族,主要存在于细胞质内,其主要家族成员有gstpi1和gstm1等,gsts的体内解毒机制是通过催化谷胱甘肽中的巯基基团对不同亲电分子进行亲核攻击,使外源性化合物与内源的还原型谷胱甘肽(gsh)发生结合反应[4-6](详情请参阅参考文献内容),即催化各种化学物质及其代谢产物与谷胱甘肽疏基的共价结合,使亲电化合物转变为亲水物质,易于从胆汁或尿液中排泄,达到将体内各种潜在或具备毒性的物质降解并排出体外的目的,gsts可以将顺铂转变为亲水性的gs-铂加合物,gs-铂加合物可以被外转运蛋白家族(又叫atp结合性盒型外转运蛋白超家族,atp-binding cassette transporters super family)成员肿瘤多药耐药性蛋白2(multidrug resistance 2,mrp2)识别并外排转运,从而降低癌细胞内的顺铂含量,使其疗效降低[7,8](详情请参阅参考文献内容),外转运蛋白主要包含p-糖蛋白(p-glycoprotein,p-gp)、多药耐药相关蛋白(multidrug resistance-associated proteins,mrps,主要包含mrp1,mrp2和mrp3)和乳腺癌耐药蛋白(breast cancer resistanceprotein,bcrp),具有atp酶活性,外转运蛋白(atp-binding cassette transporter,efflux transporter)的过度表达和激活,是药物产生多药耐药性的重要原因之一,肿瘤多药耐药性已成为制约顺铂化疗成功的重要因素之一,此外,gs-铂加合物可被γ-谷氨酰转肽酶和半胱氨酸结合的β-裂解酶代谢为肾毒物,肾毒性是肿瘤患者停止顺铂化疗的主要原因之一[7](详情请参阅参考文献内容),因此,gsts和外转运蛋白是逆转顺铂肿瘤多药耐药性的关键靶点,抑制gst和外转运蛋白的活性是克服顺铂多药耐药性和减少顺铂不良反应的潜在途径[9](详情请参阅参考文献内容);
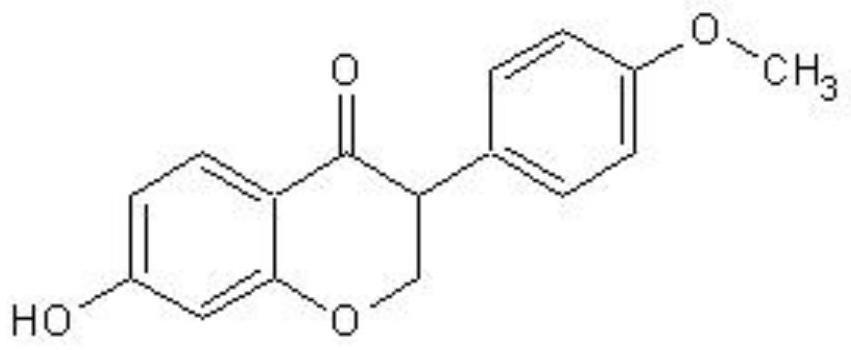
3、随着中医药对肿瘤化疗增效减毒及逆转肿瘤多药耐药性研究的深入,中药抗肿瘤多药耐药性逆转剂的研发已成为目前中医药研究领域的重要课题[10](详情请参阅参考文献内容),芒柄花素又称刺芒柄花素,为异黄酮类化合物,广泛存在于黄芪、甘草、葛根等豆科植物中(详情请参阅参考文献内容),现代药理研究表明,芒柄花素具有抗肿瘤[11](详情请参阅参考文献内容)、抗炎[12](详情请参阅参考文献内容)、降血脂、抗心律不齐、抗菌等作用,还具有清除氧自由基[13](详情请参阅参考文献内容)、抑制血管平滑肌细胞增殖等作用[14](详情请参阅参考文献内容);
4、目前,临床上抗肿瘤所用的大部分化疗药物都会引起癌细胞的多药耐药性,例如顺铂可以被外转运蛋白外排出癌细胞,并诱发敏感型癌细胞中的外转运蛋白过表达和过度激活,继而转化为耐药型癌细胞,最终导致顺铂药效的降低和化疗失败,近几十年来,国内外学者就逆转肿瘤细胞多药耐药性进行了多方位探讨,体外被证实具有逆转肿瘤多药耐药性的化合物很多,但由于体内达到体外逆转试验的有效浓度所需剂量过大,不良反应明显,而且现有逆转剂大多为老药新用,临床使用禁忌多,临床效果差,目前还没有一种药物被临床广泛接受,例如,第一代逆转剂大多具有较强的毒性,如维拉帕米具有较强的心血管毒性;第二代逆转剂虽然比第一代逆转剂的逆转作用强、不产生明显的毒性,但是却改变抗癌药物血浆动力学,从而导致到达靶点的药物浓度明显降低,此外,尽管体外开发研究的逆转肿瘤多药耐药性的药物很多,真正进入临床的却只有三苯氧胺等极少数的逆转剂;
5、因此,亟需设计一种逆转肿瘤细胞耐药性的药物组合及其制作方法和应用以解决上述缺陷,显得尤为重要。
技术实现思路
1、技术方案
2、为实现上述目的,本发明提供如下技术方案:
3、一种逆转肿瘤细胞耐药性药物组合的制作方法,包括以下步骤:
4、在芒柄花素或其药学上可接受的盐存在下,体外培养肿瘤细胞,从而抑制所述细胞的生长。
5、一种逆转肿瘤细胞耐药性药物组合的应用,所述药物组合用于制备以下用途:
6、(a)逆转肿瘤细胞对抗肿瘤药物的耐药性的药物组合物;
7、(b)治疗肿瘤的药物组合;
8、(c)抑制肿瘤细胞增殖的抑制剂;
9、(d)提高化疗药物生物利用度的肿瘤多药耐药性逆转剂。
10、作为本发明优选的方案,所述(a)、(b)、(c)和(d)中,肿瘤细胞包括a549、a549-ddp、mcf-7、hct-116和qgy-7703。
11、作为本发明优选的方案,所述(a)中逆转肿瘤细胞对抗肿瘤药物的耐药性包括:
12、1)提高肿瘤细胞对抗肿瘤药物的敏感性;
13、2)降低肿瘤细胞对抗肿瘤药物的耐药性;
14、3)增加肿瘤细胞中抗肿瘤药物的摄入量;
15、4)减少肿瘤细胞中抗肿瘤药物的外排量;
16、5)延长肿瘤细胞中抗肿瘤药物的滞留时间。
17、作为本发明优选的方案,所述药物组合还用于:
18、(e)是三磷酸腺苷结合盒膜转运蛋白的底物;
19、(f)与抗肿瘤药物竞争atp结合性盒型外转运蛋白超家族,atp-bindingcassettetransporterssuperfamily,外转运蛋白上的唯一结合位点。
20、作为本发明优选的方案,所述药物组合还用于:
21、抑制gsts的酶活性,以降低顺铂被gsts酶解为gs-铂加合物的可能性。
22、作为本发明优选的方案,所述药物组合还用于:
23、抑制nf-b信号通路中关键信号分子p65的表达,促进细胞凋亡促进基因bax的基因表达,下调抑制细胞凋亡基因bcl-2的基因表达。
24、作为本发明优选的方案,所述药物组合还用于:
25、协同增强抗癌药物顺铂和5-氟脲嘧啶对mcf-7、hct-116和qgy-7703细胞增殖的抑制作用。
26、作为本发明优选的方案,所述(a)、(b)、(c)和(d)中,肿瘤包括但不限于肺癌、乳腺癌、结肠癌、肝癌。
27、有益效果
28、与现有技术相比,本发明的有益效果是:
29、(1)提供了一种芒柄花素或其药学上可接受的盐的药物组合物,药物组合物能显著降低谷胱甘肽s转移酶的表达和酶活性,降低gs-铂加合物的生成,从而降低抗肿瘤药物(如顺铂)被外转运蛋白识别和外排;
30、(2)药物是外转运蛋白的底物,与抗肿瘤药物(如顺铂)竞争外转运蛋白的结合位点,可竞争性抑制抗肿瘤药物的外排转运;
31、(3)药物下调p65表达,提高bax/bcl-2基因表达比值,具有促细胞凋亡的作用;
32、(4)药物协同增强顺铂和5-氟脲嘧啶对mcf-7、hct-116和qgy-7703细胞增殖的抑制作用;
33、(5)本发明提供了芒柄花素或其药学上可接受的盐在提高肿瘤细胞对传统抗肿瘤药物的敏感性,从而用于治疗肿瘤方面的应用。
- 还没有人留言评论。精彩留言会获得点赞!