冻干保护组合物及其应用和基于该组合物的核酸脂质纳米颗粒冻存方法与流程
1.本发明属于生物医药技术领域,具体涉及冻干保护组合物及其应用和基于该组合物的核酸脂质纳米颗粒冻存方法。
背景技术:
2.相比于传统的疫苗或治疗药物,核酸疗法的出现为包括传染病以及肿瘤在内的多种疾病提供了更为广阔的治疗前景。由moderna和pfizer biontech开发的脂质纳米颗粒(lipid nanoparticle,lnp)包载的信使rna(messenger rna,mrna)疫苗凭借良好的生物安全性和极高的疗效(》90%),在抗击sars-cov-2方面做出了重要贡献。lnp不仅实现了mrna疫苗和治疗药物的有效递送,还可以保护核酸不被rna内切或外切酶降解,并促进细胞摄取及表达。pfizer和moderna的新冠肺炎mrna疫苗利用了lnp的多种独特的理化性质,通过可电离的氨基来增强疫苗的mrna负载率,并促进疫苗的溶酶体逃逸;通过调控其阳离子脂质比例,实现了基于表面电荷及尺寸大小的组织以及器官的靶向递送,而且这些特性还协同提高了疫苗的免疫原性,可以更为有效的激活免疫反应。
3.作为新一代的核酸递送平台,lnp技术已经在新冠疫苗和基因编辑等领域发挥巨大效用。但在包载核酸的脂质纳米颗粒(以下简称核酸脂质纳米颗粒或lnp-核酸)的储存过程中,某些化学基团的相互作用,如氧化、水解或酯交换均可导致例如mrna等核酸的脱落以及降解,因此也给mrna等核酸药物的长期储存以及运输带来了巨大的挑战。目前,lnp-mrna疫苗平台发展的最关键的限速步骤之一是其需要一个特殊的冷链系统进行长期储存。大多数常规疫苗能够储存在2~8℃环境中至少6个月,而lnp-mrna疫苗则需要冷冻储存(-80℃),这对lnp-mrna疫苗的分发和普及构成了巨大障碍。
4.冷冻干燥(冻干)技术是通用于制药工业的一种成熟的技术,其通过去除药物制剂中的水分来提高各种产品的稳定性和保质期。以冻干制剂的形式,lnp-mrna疫苗可以方便地运输到世界各地,无需冷藏或冷冻。然而,lnp-mrna疫苗的冻干并不简单,lnp具有定义明确的组装工艺,并由特定类型的脂质按一定比例制成,其物理化学参数,如粒度、多分散性和适当的有效载荷等对其生物性能至关重要,必须在冻干过程以及随后的储存过程中予以最大限度的保留。因此,详细选择冻干缓冲液成分、循环工艺参数和温度对确保其正常功能至关重要。
5.即使在冷藏条件下,lnp-mrna疫苗生产或者储存运输过程中产生的杂质或者其他衍生成分也会影响疫苗的稳定性以及表达效率。研究表明,在合成lnp时引入微量衍生物的疫苗在冷藏3个月后,其完整性降低了50%。其主要原因可归结为可电离阳离子脂质组分中叔胺基团的氧化以及随后的水解,使得可电离阳离子脂质对mrna的结合降低,lnp递送系统遭到破坏,mrna脱落或者泄露,进而影响了lnp-mrna的表达。因此严格控制lnp递送系统的氧化成分对于核酸脂质纳米颗粒冻干技术以及长期储存就显得尤为重要。
技术实现要素:
6.发明要解决的问题针对上述核酸脂质纳米颗粒在储存过程中不稳定的问题,以及对最大限度保证核酸脂质纳米颗粒在冷冻干燥过程中及后续储存过程中的完整生物性能的需求,本发明旨在提供一种冻干保护组合物及其应用,通过添加适量还原性物质,中和核酸脂质纳米颗粒在储存过程中出现的氧化性物质或衍生物,保护其包载的核酸药物的整体完整性和长效性。基于此,本发明还提供了核酸脂质纳米颗粒的冻存方法,用以方便地储存核酸脂质纳米颗粒并维持储存过程中的稳定性。
7.用于解决问题的方案本发明的第一方面提供一种冻干保护组合物,其包含糖类和还原剂,所述糖类和还原剂的质量比为(10~40):(0.1~3)。
8.进一步地,所述糖类为单糖和二糖的组合,在所述冻干保护组合物中,所述单糖和二糖的质量比为(1~4):(1~4);其中,所述单糖为由葡萄糖、半乳糖、甘露糖、果糖、阿洛酮糖、阿洛糖和山梨糖组成的组中的任意一种或多种;所述二糖为由麦芽糖、乳糖、蔗糖、异麦芽糖、黑曲霉糖和曲二糖组成的组中的任意一种或多种。
9.优选地,所述单糖为葡萄糖,所述二糖为麦芽糖。
10.进一步地,所述还原剂为由枸橼酸、枸橼酸钾、枸橼酸钠、抗坏血酸、抗坏血酸钾和抗坏血酸钠组成的组中的任意一种或多种。
11.优选地,所述还原剂为抗坏血酸钠。
12.本发明的第二方面提供一种冻干保护剂,其为包含本发明第一方面所述的冻干保护组合物的缓冲溶液。
13.进一步地,以质量百分比计,所述冻干保护剂为包含5%~20%单糖、5%~20%二糖和0.1%~3.0%还原剂的pbs溶液。
14.优选地,以质量百分比计,所述冻干保护剂为包含5%~20%葡萄糖、5%~20%麦芽糖和0.1%~3.0%抗坏血酸钠的pbs溶液。
15.更优选地,以质量百分比计,所述冻干保护剂为包含10%葡萄糖、10%麦芽糖和0.5%抗坏血酸钠的pbs溶液。
16.本发明第三方面提供本发明第一方面所述的冻干保护组合物和/或本发明第二方面所述的冻干保护剂在冻干储存核酸脂质纳米颗粒中的用途。
17.本发明第四方面提供一种核酸脂质纳米颗粒的冻存方法,其包括如下步骤:将本发明第二方面所述的冻干保护剂和含有核酸脂质纳米颗粒的溶液混合后进行冷冻干燥;其中,所述冻干保护剂与所述含有核酸脂质纳米颗粒的溶液的体积比为(1~5):1。
18.进一步地,所述方法包括如下步骤:i)以质量百分比计,制备含有5%~20%单糖、5%~20%二糖和0.1%~3.0%还原剂的pbs溶液,于15~40℃条件下搅拌10~30min,得到所述冻干保护剂;ii)将所述冻干保护剂加入至所述含有核酸脂质纳米颗粒的溶液中后进行冷冻干燥;其中,所述冻干保护剂与所述含有核酸脂质纳米颗粒的溶液的体积比为(1~5):1。
19.优选地,所述方法包括如下步骤:i)以质量百分比计,制备含有10%葡萄糖、10%麦芽糖和0.5%抗坏血酸钠的pbs溶液,于25℃条件下搅拌15min,得到所述冻干保护剂;ii)将所述冻干保护剂加入至所述含有核酸脂质纳米颗粒的溶液中后进行冷冻干燥;其中,所述
冻干保护剂与所述含有核酸脂质纳米颗粒的溶液的体积比为1:1。
20.本发明第五方面提供一种核酸脂质纳米颗粒的冻存方法,其包括如下步骤:i)制备含有核酸脂质纳米颗粒和还原剂的缓冲溶液,得到溶液i;ii)制备含有糖类的缓冲溶液,得到溶液ii;将所述溶液i和所述溶液ii混合后进行冷冻干燥;其中,所述溶液i中的还原剂和所述溶液ii中的糖类的质量比为(0.1~3):(10~40);所述溶液i和溶液ii的体积比为1:1。
21.进一步地,所述方法包括如下步骤:i)将含有核酸脂质纳米颗粒的溶液置于含有质量百分比为0.1%~3.0%还原剂的pbs溶液中透析4~24h,得到溶液i;ii)制备含有质量百分比为5%~20%的单糖和5%~20%的二糖的pbs溶液,于15~40℃条件下搅拌10~30min,得到溶液ii;将所述溶液ii加入至所述溶液i中后进行冷冻干燥;所述溶液i和溶液ii的体积比为1:1;其中,所述单糖为由葡萄糖、半乳糖、甘露糖、果糖、阿洛酮糖、阿洛糖和山梨糖组成的组中的任意一种或多种;所述二糖为由麦芽糖、乳糖、蔗糖、异麦芽糖、黑曲霉糖和曲二糖组成的组中的任意一种或多种;所述还原剂为由枸橼酸、枸橼酸钾、枸橼酸钠、抗坏血酸、抗坏血酸钾和抗坏血酸钠组成的组中的任意一种。
22.优选地,所述方法包括如下步骤:i)将含有核酸脂质纳米颗粒的溶液置于含有质量百分比为0.5%抗坏血酸钠的pbs溶液中透析24h,得到溶液i;ii)制备含有质量百分比为10%的葡萄糖和10%的麦芽糖的pbs溶液,于25℃条件下搅拌15min,得到溶液ii;将所述溶液ii加入至所述溶液i中后进行冷冻干燥;所述溶液i和溶液ii的体积比为1:1。
23.发明的效果通过以上技术方案的实施,本发明取得了以下有益效果:本发明提供了一种冻干保护组合物以及基于其的冻干保护剂,其中添加了适当比例的糖类和还原剂,其可以用于冻干储存核酸脂质纳米颗粒,糖类物质可以稳定脂质纳米颗粒中脂类,还原剂可以中和脂质纳米颗粒在冻干和储存过程中出现的氧化性物质或衍生物,保护其包载的核酸药物的整体完整性和长效性。同时,实验数据显示,其还有利于维持核酸脂质纳米颗粒结构的完整以及复溶后的高效表达,在核酸脂质纳米颗粒的长期储存以及普及领域具有广阔的应用前景。
24.本发明还提供了基于上述冻干保护组合物和/或冻干保护剂的核酸脂质纳米颗粒的冻存方法,方法操作灵活,步骤简单,对于冻干保护组合物和/或冻干保护剂的应用过程没有过多限制,均可保证核酸脂质纳米颗粒在冻干及储存过程中的稳定。
25.通过利用本发明提供的冻干保护组合物、冻干保护剂和/或核酸脂质纳米颗粒的冻存方法,可以将核酸脂质纳米颗粒储存或运输环境的温度需求从一般的-80℃升至4℃甚至20℃左右,有效降低了核酸脂质纳米颗粒的储存和运输成本,为脂质纳米颗粒包载的核酸疫苗的分发和普及带来了极大的便利性。
附图说明
26.图1a:实施例1中的lnp-egfp mrna疫苗冻干后在-80℃环境下储存不同时间复溶后的粒径变化情况。
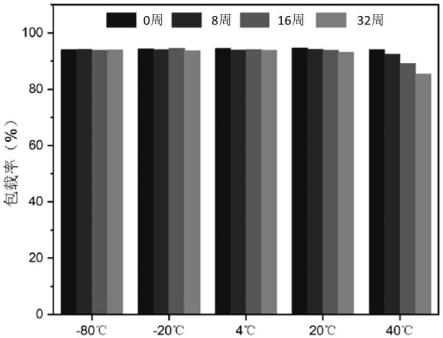
27.图1b:实施例1中的lnp-egfp mrna疫苗冻干后在-20℃环境下储存不同时间复溶后的粒径变化情况。
28.图1c:实施例1中的lnp-egfp mrna疫苗冻干后在4℃环境下储存不同时间复溶后
的粒径变化情况。
29.图1d:实施例1中的lnp-egfp mrna疫苗冻干后在20℃环境下储存不同时间复溶后的粒径变化情况。
30.图1e:实施例1中的lnp-egfp mrna疫苗冻干后在40℃环境下储存不同时间复溶后的粒径变化情况。
31.图2a:实施例1中的lnp-egfp mrna疫苗冻干后分别在置于不同温度环境下储存不同时间后的疫苗的mrna包载率变化情况。
32.图2b:实施例1中的lnp-egfp mrna疫苗冻干后分别在置于不同温度环境下储存不同时间后的疫苗的mrna完整性变化情况。
33.图2c:实施例1中的lnp-egfp mrna疫苗冻干后分别在置于不同温度环境下储存不同时间后的疫苗的细胞转染效率变化情况。
34.图3a:实施例2中的lnp-luciferase mrna疫苗冻干后在-80℃环境下储存不同时间复溶后的粒径变化情况。
35.图3b:实施例2中的lnp-luciferase mrna疫苗冻干后在-20℃环境下储存不同时间复溶后的粒径变化情况。
36.图3c:实施例2中的lnp-luciferase mrna疫苗冻干后在4℃环境下储存不同时间复溶后的粒径变化情况。
37.图3d:实施例2中的lnp-luciferase mrna疫苗冻干后在20℃环境下储存不同时间复溶后的粒径变化情况。
38.图3e:实施例2中的lnp-luciferase mrna疫苗冻干后在40℃环境下储存不同时间复溶后的粒径变化情况。
39.图4a:实施例2中的lnp-luciferase mrna疫苗冻干后分别在置于不同温度环境下储存不同时间后的疫苗的mrna包载率变化情况。
40.图4b:实施例2中的lnp-luciferase mrna疫苗冻干后分别在置于不同温度环境下储存不同时间后的疫苗的mrna完整性变化情况。
41.图5a:实施例2中的lnp-luciferase mrna疫苗冻干后分别在-80℃环境下储存不同时间后,活体内肌注复溶疫苗不同时间后的荧光表达情况。
42.图5b:实施例2中的lnp-luciferase mrna疫苗冻干后分别在-20℃环境下储存不同时间后,活体内肌注复溶疫苗不同时间后的荧光表达情况。
43.图5c:实施例2中的lnp-luciferase mrna疫苗冻干后分别在4℃环境下储存不同时间后,活体内肌注复溶疫苗不同时间后的荧光表达情况。
44.图5d:实施例2中的lnp-luciferase mrna疫苗冻干后分别在20℃环境下储存不同时间后,活体内肌注复溶疫苗不同时间后的荧光表达情况。
45.图5e:实施例2中的lnp-luciferase mrna疫苗冻干后分别在40℃环境下储存不同时间后,活体内肌注复溶疫苗不同时间后的荧光表达情况。
46.图6:实施例3中对照组和实验组的lnp-egfp mrna疫苗冻干后在4℃储存不同时间后,复溶后疫苗的细胞转染效率情况。
47.图7:实施例4中对照组和实验组的lnp-egfp mrna疫苗冻干后在4℃储存不同时间后,复溶后疫苗的细胞转染效率情况。
48.图8a:实施例5中对照组的lnp-luciferase mrna疫苗冻干后在4℃储存30d后,活体内肌注复溶疫苗不同时间后的体内荧光表达情况。
49.图8b:实施例5中实验组的lnp-luciferase mrna疫苗冻干后在4℃储存30d后,活体内肌注复溶疫苗不同时间后的体内荧光表达情况。
50.图9:阳离子脂质体化合物长期保存过程中氧化降解机理。
51.图10:阳离子脂质体化合物在pbs溶液中保存10天后的高效液相色谱图。
52.图11:阳离子脂质体化合物在含有0.5%抗坏血酸钠的pbs溶液中保存10天后的高效液相色谱图。
具体实施方式
53.在进一步描述本发明之前,应当理解,本发明不限于本文中所述的特定实施方案;还应该理解,本文中所使用的术语仅用于描述而非限定特定实施方案。
54.《定义》在本发明中,术语“一(a)”或“一(an)
”ꢀ
或“一(the)”可以指“一个”,也可以指“一个或多个”、“至少一个”以及“一个或多于一个”。
55.在本发明中,术语“包含”、“具有”、“包括”或“含有”可以指包括在内的或开放式的,并不排除额外的、未引述的元件或方法步骤。与此同时,“包含”、“具有”、“包括”或“含有”也可以表示封闭式的,排除额外的、未引述的元件或方法步骤。
56.在本发明中,使用“可以”表示的含义包括了进行某种处理以及不进行某种处理两方面的含义。
57.在本发明中,“任选的”或“任选地”是指接下来描述的事件或情况可发生或可不发生,并且该描述包括该事件发生的情况和该事件不发生的情况。
58.在本发明中,如无特殊说明,“%”是指质量百分比。
59.在本发明中,使用“数值a~数值b”或“数值a-数值b”表示的数值范围是指包含端点数值a、b的范围。
60.在本发明中,“约”可以表示:一个值包括测定该值所使用的装置或方法的误差的标准偏差。用以界定本发明的数值范围与参数皆是约略的数值,此处已尽可能精确地呈现具体实施例中的相关数值。然而,任何数值本质上不可避免地含有因前述测试装置或方法所致的标准偏差。因此,除非另有明确的说明,应当理解本发明所用的所有范围、数量、数值与百分比均经过“约”的修饰。在此处,“约”通常是指实际数值与理论模型或理论数据的标准偏差在3%、优选为2%、更优选为1%范围以内。
61.在本发明中,“核酸脂质纳米颗粒”和“lnp-核酸”是指包载了核酸类物质的脂质纳米颗粒。例如,lnp可以包载dna或mrna等核酸类物质,对应的可以将其命名为lnp-dna、lnp-mrna等。相应的,“核酸脂质纳米颗粒疫苗”、“lnp-核酸疫苗(例如lnp-mrna疫苗)”是指能够诱导宿主产生免疫应答并达到预防和治疗疾病目的的lnp-核酸或包含lnp-核酸的组合物。在一些实施方案中,所述lnp-核酸疫苗包含lnp-核酸和任选的药学上可接受的辅料和/或载体。在一些实施方案中,所述lnp-核酸疫苗包含lnp-核酸和水。
62.在本发明中,“糖类”(carbohydrate)是多羟基醛、多羟基酮以及能水解而生成多羟基醛或多羟基酮的有机化合物,可分为单糖、二糖和多糖等。
63.在本发明中,“还原剂”是在氧化还原反应里,失去电子的物质,其可以和具有氧化性的物质发生反应,从而中和氧化性物质。
64.在本发明中,“缓冲溶液”是指由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的ph值相对稳定。在一些实施方案中,所述缓冲溶液为磷酸盐缓冲溶液(phosphate buffer saline,pbs溶液)。
65.在本发明中,“阳离子脂质体化合物”是指阳离子脂质,一般由带正电的头基通过连接键(如酰胺键、酯键和醚键)与疏水尾基(胆固醇或脂肪链)相连组成,是脂质纳米颗粒的重要组成部分之一,其可以与带负电的核酸类物质结合,高效包载核酸药物,同时提供正电荷。
66.如无特殊说明,本说明书中所使用的单位均为国际标准单位,并且本发明中出现的数值和数值范围,均应当理解为包含了不可避免的系统性误差。
67.除非另有定义,否则本文中使用的其他技术和科学术语均具有与本领域一般技术人员通常所理解的含义相同的含义。
68.本发明主要是基于申请人的以下研究发现:lnp由特定类型的脂质按一定比例制成,其中包括阳离子脂质体化合物,其在储存过程中可能会发生氧化水解(具体原理可参见图9),产生氧化降解产物(申请人通过高效液相色谱测定了阳离子脂质体化合物在pbs溶液中保存10天后的降解情况,具体参见图10,图谱显示有较多降解产物产生),从而导致lnp结构遭到破坏,致使其中所包载的核酸类物质(例如mrna药物等)脱落或者泄露,进而影响了后续lnp-核酸的效力发挥。此外,申请人意外发现阳离子脂质体化合物在含有0.5%抗坏血酸钠的pbs溶液中保存10天后,基本不会产生降解产物,具体高效液相色谱图参见图11。因此,申请人创造性的提出利用特定的冻干保护组合物对lnp-核酸进行冻干储存,用以维持lnp的结构和稳定。
69.《冻干保护组合物》本发明提供了一种冻干保护组合物,其包含糖类和还原剂。
70.在所述冻干保护组合物中添加的糖类物质,其结构中的羟基可以在干燥脱水过程中取代脂质分子与水分子间的氢键来稳定lnp结构,并起到赋形剂的作用;添加的还原剂可以中和脂质纳米颗粒在储存过程中出现的氧化性物质或衍生物,保护其包载的核酸药物的整体完整性和长效性。
71.在一些优选的实施方案中,所述冻干保护组合物由糖类和还原剂组成。
72.在一些具体的实施方案中,所述糖类为单糖和二糖的组合;优选地,所述单糖为由葡萄糖、半乳糖、甘露糖、果糖、阿洛酮糖、阿洛糖和山梨糖组成的组中的任意一种或多种;所述二糖为由麦芽糖、乳糖、蔗糖、异麦芽糖、黑曲霉糖和曲二糖组成的组中的任意一种或多种。
73.出于冻干保护组合物使用安全性角度的考虑,在一些更具体的实施方案中,所述单糖为葡萄糖,所述二糖为麦芽糖;相应的,所述糖类为葡萄糖和麦芽糖的组合。葡萄糖和麦芽糖均为人体必需物质,进入人体后,不会对人体健康产生负面影响。
74.在一些具体的实施方案中,在所述冻干保护组合物中,所述单糖和二糖的质量比为(1~4):(1~4);例如可以为约1:1、1:2、1:3、1:4、2:1、2:3、3:1、3:2、3:4、4:1、4:3等;优选
地,所述单糖和二糖的质量比为(1~3):(1~3);更优选地,所述单糖和二糖的质量比为(1~2):(1~2);甚至更优选地,所述单糖和二糖的质量比为1:1。
75.在一些更具体的实施方案中,在所述冻干保护组合物中,所述葡萄糖和麦芽糖的质量比为1:1。
76.在一些具体的实施方案中,所述还原剂为由枸橼酸、枸橼酸钾、枸橼酸钠、抗坏血酸、抗坏血酸钾和抗坏血酸钠组成的组中的任意一种或多种;优选地,所述还原剂为由枸橼酸、枸橼酸钾、枸橼酸钠和抗坏血酸钠组成的组中的任意一种;更优选地,所述还原剂为抗坏血酸钠。
77.在一些具体的实施方案中,在所述冻干保护组合物中,所述糖类和还原剂的质量比为(10~40):(0.1~3);优选地,所述糖类和还原剂的质量比为(10~30):(0.1~2);更优选地,所述糖类和还原剂的质量比为(10~20):(0.1~1);甚至更优选地,所述糖类和还原剂的质量比为20:0.3。
78.糖类物质对生物制品冷冻干燥过程中的保护与其添加的浓度直接相关,控制糖类含量,可以有效提高其稳定作用。适当比例的还原剂可以有效的防止脂质纳米粒冻干过程中或者冻干后储存过程中氧化性物质或者衍生物的产生,为包载的核酸疫苗的储存和普及应用提供便利。
79.《冻干保护剂》进一步地,本发明提供了一种冻干保护剂,其为包含上述冻干保护组合物的缓冲溶液。
80.在一些具体的实施方案中,所述冻干保护剂为包含上述冻干保护组合物的pbs溶液。
81.进一步地,基于所述冻干保护组合物:在一些实施方案中,以质量百分比计,所述冻干保护剂中包含5%~20%的单糖,例如可以为约5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%等。
82.在一些具体的实施方案中,以质量百分比计,所述冻干保护剂中包含5%~20%的葡萄糖。
83.在一些实施方案中,以质量百分比计,所述冻干保护剂中包含5%~20%的二糖,例如可以为约5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%等。
84.在一些具体的实施方案中,以质量百分比计,所述冻干保护剂中包含5%~20%的麦芽糖。
85.在一些实施方案中,以质量百分比计,所述冻干保护剂中包含0.1%~3.0%的还原剂,例如可以为约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.5%、2.0%、2.5%、3.0%等。
86.在一些优选的实施方案中,以质量百分比计,所述冻干保护剂中所包含的葡萄糖含量为5%-20%,麦芽糖含量为5%-20%,还原剂含量为0.1-3.0%。
87.在一些优选的实施方案中,以质量百分比计,所述冻干保护剂中所包含的葡萄糖含量为5%-15%,麦芽糖含量为5%-20%,还原剂含量为0.1-3.0%。
88.在一些优选的实施方案中,以质量百分比计,所述冻干保护剂中所包含的葡萄糖含量为5%-10%,麦芽糖含量为5%-20%,还原剂含量为0.1-3.0%。
89.在一些优选的实施方案中,以质量百分比计,所述冻干保护剂中所包含的葡萄糖含量为10%,麦芽糖含量为5%-20%,还原剂含量为0.1-3.0%。
90.在一些优选的实施方案中,以质量百分比计,所述冻干保护剂中所包含的葡萄糖含量为10%,麦芽糖含量为5%-15%,还原剂含量为0.1-3.0%。
91.在一些优选的实施方案中,以质量百分比计,所述冻干保护剂中所包含的葡萄糖含量为10%,麦芽糖含量为5%-10%,还原剂含量为0.1-3.0%。
92.在一些优选的实施方案中,以质量百分比计,所述冻干保护剂中所包含的葡萄糖含量为10%,麦芽糖含量为10%,还原剂含量为0.1-3.0%。
93.在一些优选的实施方案中,以质量百分比计,所述冻干保护剂中所包含的葡萄糖含量为10%,麦芽糖含量为10%,还原剂含量为0.1-2.0%。
94.在一些优选的实施方案中,以质量百分比计,所述冻干保护剂中所包含的葡萄糖含量为10%,麦芽糖含量为10%,还原剂含量为0.1-1.0%。
95.在一些优选的实施方案中,以质量百分比计,所述冻干保护剂中所包含的葡萄糖含量为10%,麦芽糖含量为10%,还原剂含量为0.5%。
96.在一些更优选的实施方案中,以质量百分比计,所述冻干保护剂中所包含的葡萄糖含量为10%,麦芽糖含量为10%,还原剂含量为0.5%,所述还原剂为抗坏血酸钠。
97.《冻干保护组合物和/或冻干保护剂的应用》本发明提供了上述冻干保护组合物和/或冻干保护剂在冷冻储存核酸脂质纳米颗粒中的用途。
98.利用本发明提供的冻干保护组合物和/或冻干保护剂,可以在核酸脂质纳米颗粒的冷冻干燥和后续储存过程中,有效维持核酸脂质纳米颗粒的粒径,并且可以降低脂质纳米颗粒的氧化降解概率,维持其对核酸类物质的包载效率,稳定核酸类物质的生物活性,从而确保其在后续使用过程中可发挥稳定功效。
99.《核酸脂质纳米粒的冻存方法》基于上述冻干保护组合物和冻干保护剂,本发明提供了核酸脂质纳米颗粒的冻存方法,对于冻干保护组合物和冻干保护剂在该方法中的具体使用过程,本发明不做特别的限制,仅需保证核酸脂质纳米颗粒在冷冻干燥时已与冻干保护组合物和/或冻干保护剂混合即可。
100.在一些实施方案中,所述方法包括如下步骤:将所述冻干保护剂和含有核酸脂质纳米颗粒的溶液混合后进行冷冻干燥。优选地,所述核酸脂质纳米颗粒储存在液体介质中,例如水、pbs溶液等;进一步的,在一些实施方案中,所述冻干保护剂与所述含有核酸脂质纳米颗粒的溶液的体积比为(1~5):1,例如可以为约1:1、2:1、3:1、4:1、5:1等。
101.在一些具体的实施方案中,所述方法包括如下步骤:i)以质量百分比计,制备含有5%~20%单糖、5%~20%二糖和0.1%~3.0%还原剂的pbs溶液,于15~40℃条件下搅拌10~30min,得到所述冻干保护剂;ii)将所述冻干保护剂加入至所述含有核酸脂质纳米颗粒的溶液中后进行冷冻干燥;所述冻干保护剂与所述含有核酸脂质纳米颗粒的溶液的体积比为(1~5):1。其中,所述单糖为由葡萄糖、半乳糖、甘露糖、果糖、阿洛酮糖、阿洛糖和山梨糖组成的组中的任意一种或多种;所述二糖为由麦芽糖、乳糖、蔗糖、异麦芽糖、黑曲霉糖和曲二糖组成的组中的任意一种或多种;所述还原剂为由枸橼酸、枸橼酸钾、枸橼酸钠、抗坏血酸、抗坏血
酸钾和抗坏血酸钠组成的组中的任意一种;所述搅拌温度可以为约15℃、20℃、25℃、30℃、35℃、40℃等,所述搅拌时间可以为约10min、15min、20min、25min、30min等。
102.在一些优选的实施方案中,所述方法包括如下步骤:i)以质量百分比计,制备含有10%葡萄糖、10%麦芽糖和0.5%抗坏血酸钠的pbs溶液,于15~40℃条件下搅拌10~30min,得到所述冻干保护剂;ii)将所述冻干保护剂加入至所述含有核酸脂质纳米颗粒的溶液中后进行冷冻干燥;所述冻干保护剂与所述含有核酸脂质纳米颗粒的溶液的体积比为(1~5):1。
103.在一些优选的实施方案中,所述方法包括如下步骤:i)以质量百分比计,制备含有10%葡萄糖、10%麦芽糖和0.5%抗坏血酸钠的pbs溶液,于20~30℃条件下搅拌10~30min,得到所述冻干保护剂;ii)将所述冻干保护剂加入至所述含有核酸脂质纳米颗粒的溶液中后进行冷冻干燥;所述冻干保护剂与所述含有核酸脂质纳米颗粒的溶液的体积比为(1~5):1。
104.在一些优选的实施方案中,所述方法包括如下步骤:i)以质量百分比计,制备含有10%葡萄糖、10%麦芽糖和0.5%抗坏血酸钠的pbs溶液,于25℃条件下搅拌10~30min,得到所述冻干保护剂;ii)将所述冻干保护剂加入至所述含有核酸脂质纳米颗粒的溶液中后进行冷冻干燥;所述冻干保护剂与所述含有核酸脂质纳米颗粒的溶液的体积比为(1~5):1。
105.在一些优选的实施方案中,所述方法包括如下步骤:i)以质量百分比计,制备含有10%葡萄糖、10%麦芽糖和0.5%抗坏血酸钠的pbs溶液,于25℃条件下搅拌10~20min,得到所述冻干保护剂;ii)将所述冻干保护剂加入至所述含有核酸脂质纳米颗粒的溶液中后进行冷冻干燥;所述冻干保护剂与所述含有核酸脂质纳米颗粒的溶液的体积比为(1~5):1。
106.在一些优选的实施方案中,所述方法包括如下步骤:i)以质量百分比计,制备含有10%葡萄糖、10%麦芽糖和0.5%抗坏血酸钠的pbs溶液,于25℃条件下搅拌15min,得到所述冻干保护剂;ii)将所述冻干保护剂加入至所述含有核酸脂质纳米颗粒的溶液中后进行冷冻干燥;所述冻干保护剂与所述含有核酸脂质纳米颗粒的溶液的体积比为(1~5):1。
107.在一些优选的实施方案中,所述方法包括如下步骤:i)以质量百分比计,制备含有10%葡萄糖、10%麦芽糖和0.5%抗坏血酸钠的pbs溶液,于25℃条件下搅拌15min,得到所述冻干保护剂;ii)将所述冻干保护剂加入至所述含有核酸脂质纳米颗粒的溶液中后进行冷冻干燥;所述冻干保护剂与所述含有核酸脂质纳米颗粒的溶液的体积比为1:1。
108.在另一些实施方案中,所述方法包括如下步骤:i)制备含有核酸脂质纳米颗粒和还原剂的pbs溶液,得到溶液i;ii)制备含有糖类的pbs溶液,得到溶液ii;将所述溶液i和所述溶液ii混合后进行冷冻干燥;其中,所述溶液i中的还原剂和所述溶液ii中的糖类的质量比为(0.1~3):(10~40);所述溶液i和溶液ii的体积比为1:1。
109.在另一些具体的实施方案中,所述方法包括如下步骤:i)将含有核酸脂质纳米颗粒的溶液置于含有质量百分比为0.1%~3.0%还原剂的pbs溶液中透析4~24h,得到溶液i;ii)制备含有质量百分比为5%~20%的单糖和5%~20%的二糖的pbs溶液,于15~40℃条件下搅拌10~30min,得到溶液ii;将所述溶液ii加入至所述溶液i中后进行冷冻干燥;所述溶液i和溶液ii的体积比为1:1。其中,所述单糖为由葡萄糖、半乳糖、甘露糖、果糖、阿洛酮糖、阿洛糖和山梨糖组成的组中的任意一种或多种;所述二糖为由麦芽糖、乳糖、蔗糖、异麦芽糖、黑曲霉糖和曲二糖组成的组中的任意一种或多种;所述还原剂为由枸橼酸、枸橼酸钾、枸橼酸钠、抗坏血酸、抗坏血酸钾和抗坏血酸钠组成的组中的任意一种;所述透析时间可以为约4h、6h、8h、10h、12h、14h、16h、18h、20h、22h、24h等;所述搅拌温度可以为约15℃、20℃、25℃、30
℃、35℃、40℃等,所述搅拌时间可以为约10min、15min、20min、25min、30min等。
110.在另一些优选的实施方案中,所述方法包括如下步骤:i)将含有核酸脂质纳米颗粒的溶液置于含有质量百分比为0.1%~3.0%抗坏血酸钠的pbs溶液中透析4~24h,得到溶液i;ii)制备含有质量百分比为10%的葡萄糖和10%的麦芽糖的pbs溶液,于25℃条件下搅拌15min,得到溶液ii;将所述溶液ii加入至所述溶液i中后进行冷冻干燥;所述溶液i和溶液ii的体积比为1:1。
111.在另一些优选的实施方案中,所述方法包括如下步骤:i)将含有核酸脂质纳米颗粒的溶液置于含有质量百分比为0.1%~2.0%抗坏血酸钠的pbs溶液中透析4~24h,得到溶液i;ii)制备含有质量百分比为10%的葡萄糖和10%的麦芽糖的pbs溶液,于25℃条件下搅拌15min,得到溶液ii;将所述溶液ii加入至所述溶液i中后进行冷冻干燥;所述溶液i和溶液ii的体积比为1:1。
112.在另一些优选的实施方案中,所述方法包括如下步骤:i)将含有核酸脂质纳米颗粒的溶液置于含有质量百分比为0.1%~1.0%抗坏血酸钠的pbs溶液中透析4~24h,得到溶液i;ii)制备含有质量百分比为10%的葡萄糖和10%的麦芽糖的pbs溶液,于25℃条件下搅拌15min,得到溶液ii;将所述溶液ii加入至所述溶液i中后进行冷冻干燥;所述溶液i和溶液ii的体积比为1:1。
113.在另一些优选的实施方案中,所述方法包括如下步骤:i)将含有核酸脂质纳米颗粒的溶液置于含有质量百分比为0.5%抗坏血酸钠的pbs溶液中透析4~24h,得到溶液i;ii)制备含有质量百分比为10%的葡萄糖和10%的麦芽糖的pbs溶液,于25℃条件下搅拌15min,得到溶液ii;将所述溶液ii加入至所述溶液i中后进行冷冻干燥;所述溶液i和溶液ii的体积比为1:1。
114.在另一些优选的实施方案中,所述方法包括如下步骤:i)将含有核酸脂质纳米颗粒的溶液置于含有质量百分比为0.5%抗坏血酸钠的pbs溶液中透析8~24h,得到溶液i;ii)制备含有质量百分比为10%的葡萄糖和10%的麦芽糖的pbs溶液,于25℃条件下搅拌15min,得到溶液ii;将所述溶液ii加入至所述溶液i中后进行冷冻干燥;所述溶液i和溶液ii的体积比为1:1。
115.在另一些优选的实施方案中,所述方法包括如下步骤:i)将含有核酸脂质纳米颗粒的溶液置于含有质量百分比为0.5%抗坏血酸钠的pbs溶液中透析24h,得到溶液i;ii)制备含有质量百分比为10%的葡萄糖和10%的麦芽糖的pbs溶液,于25℃条件下搅拌15min,得到溶液ii;将所述溶液ii加入至所述溶液i中后进行冷冻干燥;所述溶液i和溶液ii的体积比为1:1。
实施例
116.为使本发明的目的、技术方案和优点更加清楚,下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
117.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊
说明,均可从商业途径得到。
118.实施例1按照公开的商用的lnp-mrna疫苗制备方法制备lnp-egfp mrna疫苗。配置含有质量分数为10%葡萄糖、10%麦芽糖以及0.5%抗坏血酸钠的pbs溶液(pbs溶液来自fisher,bp243820),并在25℃下搅拌15分钟得到冻干保护剂。将配好的冻干保护剂加入到lnp-mrna疫苗制剂之中,使冻干保护剂与lnp-mrna疫苗制剂的体积比为1:1。随后将疫苗冻干并分别置于-80℃、-20℃、4℃、20℃、40℃环境下储存0、8、16、32周(week,w)。通过马尔文粒径测试仪测定冻干后不同时间点lnp-egfp mrna疫苗复溶后的粒径变化。通过mrna检测试剂盒(qubit
™ꢀ
rna hs assay kit,thermo)测定冻干前后不同时间节点的mrna包载效率,通过凝胶色谱法评估mrna完整性,通过lnp-egfp mrna疫苗所表达的egfp荧光蛋白评估疫苗冻干前后不同时间节点时(0、8、16、32 w)的表达效率以及转染效率。
119.实验结果如图1a~图1e和图2a~图2c所示。
120.图1a~图1e显示,使用上述冻干保护剂,在-80℃、-20℃、4℃以及20℃条件下储存疫苗冻干剂32周后,疫苗复溶后的粒径几乎没有变化。
121.图2a~图2c显示,egfp mrna的包载率、mrna完整性以及细胞转染效率等rna关键活性指标在4℃及以下温度环境下保存时均表现出与冻干前相当的疫苗完整性和高效性。
122.相对于现有的lnp-mrna疫苗只能在-80℃下储存及运输,本发明提供的冻干保护剂具有明显的优势。
123.实施例2按照公开的商用的lnp-mrna疫苗制备方法制备lnp-luciferase mrna疫苗(lnp-luciferase nps)。配置含有质量分数为10%葡萄糖、10%麦芽糖以及0.5%抗坏血酸钠的pbs溶液,并在25℃下搅拌15分钟得到冻干保护剂。将配好的冻干保护剂加入到lnp-mrna疫苗制剂之中,使冻干保护剂与lnp-mrna疫苗制剂的体积比为1:1。随后将疫苗冻干并分别置于-80℃、-20℃、4℃、20℃、40℃环境下储存0、8、16、32周(week,w)。通过马尔文粒径测试仪测定冻干前后不同时间点lnp-mrna疫苗复溶后的粒径变化。通过mrna检测试剂盒(qubit
™ꢀ
rna hs assay kit,thermo)测定冻干前后不同时间节点的mrna包载效率,通过凝胶色谱法评估mrna完整性。随后将复溶的疫苗在小鼠体内进行肌肉注射,并分别于注射后2 h、6 h、12 h、24 h、48 h通过小动物活体成像仪采集注射局部的luciferase荧光信号,以进一步评估复溶后体内疫苗活性及表达效率。
124.实验结果如图3a~图3e、图4a~图4b和图5a~图5e所示。
125.图3a~图3e显示本发明所述的lnp-luciferase mrna疫苗冻干剂在-80℃、-20℃、4℃以及20℃条件下储存32周后,疫苗复溶后的粒径几乎没有变化。
126.图4a~图4b显示在4℃及以下温度环境下保存时,luciferase mrna的包载率和mrna完整性等rna关键活性指标均表现出与冻干前相当的表达活性,表明本发明的冻干保护剂可以保护lnp-mrna疫苗在4℃及以下环境下长期储存。
127.图5a~图5e显示,在4℃及以下温度环境下保存的疫苗冻干剂在注射小鼠后48 h时内,疫苗活性及表达效率均可维持在较高水平,进一步证明,本发明的冻干保护剂可以有效维持lnp-mrna疫苗冻干剂在储存过程中的稳定性。
128.实施例3
按照公开的商用的lnp-mrna疫苗制备方法制备lnp
‑ꢀ
egfp mrna疫苗。实验分两组进行,实验组将制得的lnp-mrna疫苗制剂置于适量含0.5%抗坏血酸钠的pbs溶液中透析24 h,对照组将lnp-mrna疫苗置于pbs溶液中透析24 h。配置含有质量分数为10%葡萄糖以及10%麦芽糖的pbs溶液(记作溶液a),并在25℃下搅拌15分钟。随后将配好的溶液a加入到上述两组透析完的lnp-mrna疫苗制剂之中,使溶液a与lnp-mrna疫苗制剂的体积比为1:1。将疫苗冻干并在4℃环境下储存0、1、2、4、7 d,于不同时间点对复溶的疫苗制剂的egfp mrna的体外细胞转染效率进行评估。
129.实验结果如图6所示,对照组的lnp-egfp mrna疫苗在不含抗坏血酸钠的pbs溶液中透析后冻干,其egfp mrna表达效率随储存时间的延长出现明显降低。而lnp-egfp mrna疫苗在含有0.5%抗坏血酸钠的pbs溶液中透析的实验组,在冻干后的每个评估时间点(1、2、4、7 d)均表现出优异的lnp-egfp mrna疫苗转染效率。
130.实施例4按照公开的商用的lnp-mrna疫苗制备方法制备lnp-egfp mrna疫苗。实验分为两组进行,对照组lnp-egfp mrna疫苗制剂置于适量pbs溶液中透析24 h。实验组疫苗置于含0.5%抗坏血酸钠的pbs溶液中透析24 h。然后配置含有质量分数为10%葡萄糖以及10%麦芽糖的pbs溶液(记作溶液a),并在25℃下搅拌15分钟。将配好的溶液a加入到完成上述透析操作的两组lnp-mrna疫苗制剂之中,使溶液a与lnp-mrna疫苗制剂的体积比为1:1。随后将疫苗冻干并置于4℃环境下储存0、1、7、15、30、90、180 d后复溶冻干疫苗并评估体外egfp mrna转染效率。
131.实验结果如图7所示,在整个储存期间,实验组疫苗使用的在含0.5%抗坏血酸钠的pbs溶液中透析后冻干的方法,相比对照组,复溶后的疫苗转染效率明显更高,具有明显的长期稳定储存lnp-egfp mrna疫苗的优势。
132.实施例5按照公开的商用的lnp-mrna疫苗制备方法制备lnp-luciferase mrna疫苗。实验分为两组进行,对照组lnp-luciferase mrna疫苗置于适量pbs溶液中透析24 h。实验组疫苗置于含0.5%抗坏血酸钠的pbs溶液中透析24 h。然后配置含有质量分数为10%葡萄糖以及10%麦芽糖的pbs溶液(记作溶液a),并在25℃下搅拌15分钟。将配好的溶液a加入到完成上述透析操作的两组lnp-mrna疫苗制剂之中,使溶液a与lnp-mrna疫苗制剂的体积比为1:1。随后将疫苗冻干并置于4℃环境下储存,并于第0天和第30天时复溶冻干疫苗,通过体内肌肉注射的方式验证疫苗活体内的luciferase表达效果。
133.实验结果如图8a~图8b所示,在疫苗冻干30天后,复溶后的实验组疫苗的体内表达效率明显高于对照组。证明本发明提供的lnp-核酸的冻存方法与现有的冻干方法相比,在维持疫苗长期活性、完整性以及表达效率方面具有巨大的优势。
134.产业上的可利用性本发明提供的冻干保护组合物及其应用和基于该组合物的核酸脂质纳米颗粒的冻存方法可以在实际生产中进行规模化应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1