吡非尼酮在治疗胰腺疾病的药物中的应用
1.本发明涉及医药技术领域,具体涉及一种吡非尼酮在治疗胰腺疾病的药物中的应用。
背景技术:
2.慢性胰腺炎(chronicpancreatitis,cp)是由各种因素引起的一种胰腺组织慢性炎症-纤维化性疾病,其病理特征为腺泡萎缩、腺泡导管化生、炎细胞浸润、间质纤维化、胰管扩张/扭曲/狭窄和组织钙化。cp患者的主要临床表现为腹痛可伴腰背痛、脂肪泻、血糖升高和营养不良。小部分cp患者甚至可进展成胰腺癌,缩短了预期寿命。临床上治疗cp的主要手段为胰酶替代、体外震波碎石、内镜和外科手术。但是,尚无有效的药物可以逆转胰腺组织的慢性炎症及纤维化进程。因此,迫切需要研究cp的发病机制并寻找有效的治疗药物。
3.胰腺纤维化是cp的重要病理特征之一。胰腺星状细胞(pancreaticstellate cells,pscs)在组织纤维化过程中发挥了关键作用。胰腺组织损伤所致的炎症反应激活了pscs,pscs活化后分泌大量的细胞外基质(extracellularmatrix,ecm),ecm沉积在组织间质内引起纤维化,最终导致了胰腺内外分泌功能的减退。此外,慢性炎症反应保证了pscs的持续激活,加速了组织纤维化。
4.吡非尼酮(pirfenidone,pfd),一种新型口服小分子化合物,化学名称是5-甲基1-苯基-2-(1氢)-吡啶酮(图1a),具有抗炎、抗氧化和抗纤维化作用,已被fda批准用于治疗特发性肺纤维化患者。根据目前的文献报道,我们发现吡非尼酮具有减缓肺纤维化、肝纤维化和肾纤维化的作用。但是吡非尼酮是否能用于治疗慢性胰腺炎、胰腺纤维化等胰腺疾病并未见相关文献报道。
技术实现要素:
5.本发明是为了解决上述问题而进行的,目的在于提供一种吡非尼酮在治疗胰腺疾病的药物中的应用。
6.本发明提供了一种吡非尼酮在治疗胰腺疾病的药物中的应用。
7.在本发明提供的吡非尼酮在治疗胰腺疾病的药物中的应用中,还可以具有这样的特征:其中,胰腺疾病包括慢性胰腺炎、胰腺纤维化。
8.在本发明提供的吡非尼酮在治疗胰腺疾病的药物中的应用中,还可以具有这样的特征:其中,胰腺疾病的组织病理特征包括正常胰腺组织结构破坏、腺泡萎缩、腺泡导管化生、炎细胞浸润和纤维组织替代。
9.在本发明提供的吡非尼酮在治疗胰腺疾病的药物中的应用中,还可以具有这样的特征:其中,该应用包括利用吡非尼酮制备治疗胰腺疾病的药物。
10.在本发明提供的吡非尼酮在治疗胰腺疾病的药物中的应用中,还可以具有这样的特征:其中,该应用为将吡非尼酮作为活性成分与一种或多种药学上可接受的固体或液体赋形剂和/或辅剂结合,制备成人或动物适用的任何剂型的治疗胰腺疾病的药物。
11.在本发明提供的吡非尼酮在治疗胰腺疾病的药物中的应用中,还可以具有这样的特征:其中,吡非尼酮具有下调胰腺组织内纤维化、炎症相关基因的表达的作用。
12.在本发明提供的吡非尼酮在治疗胰腺疾病的药物中的应用中,还可以具有这样的特征:其中,吡非尼酮具有抑制胰腺星状细胞的活化及细胞外基质的合成的作用。
13.在本发明提供的吡非尼酮在治疗胰腺疾病的药物中的应用中,还可以具有这样的特征:其中,吡非尼酮通过tgf-β/smad、wnt/β-catenin和jak/stat信号通路抑制胰腺星状细胞的活化及细胞外基质的合成。
14.在本发明提供的吡非尼酮在治疗胰腺疾病的药物中的应用中,还可以具有这样的特征:其中,吡非尼酮具有抑制胰腺星状细胞的迁移并促进细胞凋亡的作用。
15.发明的作用与效果
16.根据本发明所涉及的吡非尼酮在治疗胰腺疾病的药物中的应用,本发明通过体内实验发现吡非尼酮显著减轻了胰腺组织腺泡萎缩、炎细胞浸润和组织纤维化;通过体外实验证明吡非尼酮抑制了胰腺星状细胞的活化、迁移和细胞外基质的合成,促进了胰腺星状细胞的凋亡。本发明优点在于:本发明首次发现吡非尼酮对胰腺纤维化具有保护作用。本发明为处方药吡非尼酮提供了新的医药用途,为慢性胰腺炎提供了新的临床治疗手段。
附图说明
17.图1是本发明的实施例2中小鼠体重变化结果图,其中,(a)pfd的化学结构(b)小鼠cp造模及pfd给药方案示意图(c)3组小鼠在实验期间的体重变化。与control组相比较,
#
p《0.05,
##
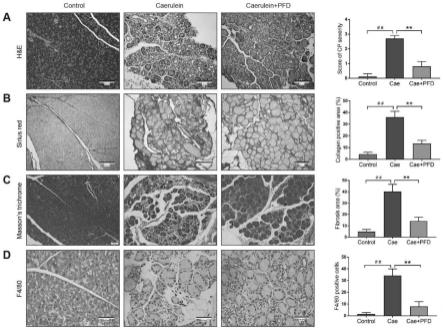
p《0.01;与caerulein组相比较,*p《0.05。图2是本发明的实施例2中吡非尼酮改善cp小鼠的胰腺组织萎缩、纤维化及炎症的结果图,其中,(a)小鼠胰腺组织切片的苏木素-伊红(h&e)染色及cp胰腺组织病理学评分,标尺为100μm(b)小鼠胰腺组织切片的天狼星红(sirius red)染色及胶原阳性区域的百分比(c)小鼠胰腺组织切片的masson’strichrome染色及纤维化区域的百分比(d)小鼠胰腺组织切片的免疫组织化学(ihc)染色及f4/80阳性细胞的数目(高倍镜
×
400)。与control组相比较,
##
p《0.01;与caerulein组相比较,
**
p《0.01。
18.图3是本发明的实施例2中吡非尼酮下调cp小鼠胰腺组织内纤维化、炎症相关基因的表达结果图,其中,(a)小鼠胰腺组织内纤维化相关基因tgfβ、αsma、col1α1和fn的转录表达(b)小鼠胰腺组织内巨噬细胞marker相关基因f4/80和cd68的转录表达(c)小鼠胰腺组织内炎症相关基因tnfα、il-6和ccl2的转录表达。mgapdh作为内参基因。与control组相比较,
##
p《0.01;与caerulein组相比较,*p《0.05,**p《0.01。
19.图4是本发明的实施例3中cck-8实验结果图,其中,(a)显微镜下pscs的形态,放大200倍。(b)cck8实验分析不同浓度pfd处理pscs48h对细胞活性的影响。
20.图5是本发明的实施例3中qpcr实验分析pscs活化及ecm的合成结果图,其中,(a)pfd处理pscs24h,pfd剂量依赖性减少基因αsma、fn、col1α1、ctgf和serpinh1的转录表达。与control组相比较,*p《0.05,**p《0.01(b)tgfβ(2ng/ml)在pfd加药前预处理1h,pfd再处理pscs24h。pfd剂量依赖性抑制了tgfβ刺激所致的基因αsma、fn、col1α1、ctgf和serpinh1转录表达的增加。hgapdh作为内参基因。与control组相比较,
##
p《0.01;与tgfβ组相比较,*p《0.05,**p《0.01。
21.图6是本发明的实施例3中wb实验分析pscs活化及ecm的合成结果图,其中,(a)有或无tgfβ(2ng/ml)在pfd加药前预处理1h,pfd再处理pscs48h,wb方法检测细胞内αsma、fibronectin、collageni和ctgf的蛋白表达。β-actin作为内参蛋白。(b)将上述的蛋白水平表达进行相对定量并比较各组间蛋白表达量的差异。在图a中,与control组相比较,**p《0.01;在图b中,与control组相比较,
##
p《0.01;与tgfβ组相比较,*p《0.05,**p《0.01。
22.图7是本发明的实施例3中pfd(4.0mm)处理pscs48h,细胞免疫荧光染色(if)检测fibronectin、collageni和ctgf的蛋白表达结果图。dapi(蓝色)用于共染细胞核。标尺为100μm。
23.图8是本发明的实施例3中pscs的划痕实验结果图,其中,(a)细胞划痕实验分析pfd(4.0mm)处理pscs6h、18h和24h后的细胞迁移速率。标尺为100μm(b)通过定量划痕处无细胞的面积来相对比较不同处理时间的细胞迁移速率。ns:无显著差异,**p《0.01。
24.图9是本发明的实施例3中pscs的transwell迁移实验结果图,其中,(a)transwell迁移实验分析pfd(4.0mm)处理pscs24h后的细胞迁移速率,有或无tgfβ(2ng/ml)在pfd加药前预处理1h。标尺为50μm。(b)在镜下多个视野计数迁移细胞并比较组间细胞数目的差异。**p《0.01。
25.图10是本发明的实施例3中流式细胞术分析pscs凋亡结果图,其中,(a)流式细胞术(annexinv和pi双染)分析不同剂量pfd(2.0、4.0mm)处理pscs48h后的细胞凋亡情况。流式细胞图分为4个象限,分布在左下象限的为存活细胞,分布在左上象限的为坏死细胞,分布在右上象限的为晚期凋亡细胞,分布在右下象限的为早期凋亡细胞。凋亡细胞计数包括右上象限和右下象限的细胞。(b)统计凋亡细胞的比例并进行组间比较。与control组相比较,**p《0.01。
26.图11是本发明的实施例3中pscs的转录组测序分析结果图,其中,(a)聚类热图分析差异表达基因,红色表示高表达基因,蓝色表示低表达基因。(b)火山图分析差异表达基因的整体分布情况,红色表示上调基因,绿色表示下调基因。(c)go富集分析将基因归为3类:生物学过程(biologicalprocess)、细胞成分(cellularcomponent)和分子功能(molecularfunction)(d)kegg富集分析top20信号通路气泡图。
27.图12是本发明的实施例3中吡非尼酮抑制tgf-β/smad信号通路结果图,其中,(a)tgfβ(2ng/ml)在pfd加药前预处理1h,pfd再处理pscs4h。wb方法检测细胞内p-smad2、p-smad3、smad2/3的蛋白表达。β-actin作为内参蛋白。(b)将上述的蛋白表达进行相对定量并比较各组间蛋白表达量的差异。与control组相比较,
##
p《0.01;与tgfβ组相比较,**p《0.01。
28.图13是本发明的实施例3中吡非尼酮抑制wnt/β-catenin信号通路结果图,其中,(a)有或无tgfβ(2ng/ml)在pfd加药前预处理1h,pfd再处理pscs48h,wb方法检测细胞内p-lrp6、lrp6、p-gsk3β、gsk3β、activeβ-catenin、β-catenin、ccnd1、c-myc和lef1的蛋白表达。β-actin作为内参蛋白。(b)将上述的蛋白表达进行相对定量并比较各组间蛋白表达量的差异。在上图中,与control组相比较,**p《0.01;在下图中,与control组相比较,
##
p《0.01;与tgfβ组相比较,*p《0.05,**p《0.01(c)pfd处理pscs24h,qpcr方法检测基因β-catenin、ccnd1、c-myc和lef1的转录表达。与control组相比较,*p《0.05,**p《0.01(d)tgfβ(2ng/ml)在pfd加药前预处理1h,pfd再处理pscs24h。qpcr方法检测基因β-catenin、ccnd1、c-myc和lef1的转录表达。hgapdh作为内参基因。与control组相比较,
##
p《0.01;与tgfβ组相
比较,**p《0.01(e)pfd(4.0mm)处理pscs48h,细胞免疫荧光染色(if)检测ccnd1的蛋白表达。dapi(蓝色)用于共染细胞核。
29.图14是本发明的实施例3中吡非尼酮抑制jak/stat信号通路结果图,其中,(a)有或无tgfβ(2ng/ml)预处理1h,pfd再处理pscs4h,wb方法检测细胞内p-stat3、stat3、p-stat1和stat1的蛋白表达。β-actin作为内参蛋白。(b)将上述的蛋白表达进行相对定量并比较各组间蛋白表达量的差异。在左图中,与control组相比较,**p《0.01;在右图中,与control组相比较,
##
p《0.01;与tgfβ组相比较,**p《0.01(c)pfd处理pscs4h,qpcr方法检测基因il-6、il-6r、lif、lifr、il-11、il-11r、gp130、cish和socs1的转录表达。与control组相比较,*p《0.05,**p《0.01(d)pfd(4.0mm)处理pscs4h,细胞免疫荧光染色(if)检测p-stat3的蛋白表达。dapi(蓝色)用于共染细胞核。
30.图15是本发明的实施例3中吡非尼酮的分子作用机制示意图。吡非尼酮通过tgf-β/smad、wnt/β-catenin和jak/stat信号通路抑制pscs的活化与ecm的合成。
具体实施方式
31.为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,以下实施例结合附图对本发明吡非尼酮在治疗胰腺疾病的药物中的应用作具体阐述。
32.《实施例1》
33.本实施例提供了一种吡非尼酮在治疗胰腺疾病的药物中的应用,具体地,该应用为利用吡非尼酮制备治疗胰腺疾病的药物。
34.在制备治疗胰腺疾病的药物时,可以将吡非尼酮作为活性成分与一种或多种药学上可接受的固体或液体赋形剂和/或辅剂结合,制备成人或动物适用的任何剂型的治疗胰腺疾病的药物。
35.其中,胰腺疾病包括慢性胰腺炎和胰腺纤维化。胰腺疾病的组织病理特征包括正常胰腺组织结构破坏、腺泡萎缩、腺泡导管化生、炎细胞浸润和纤维组织替代。
36.《实施例2》
37.实施例2为吡非尼酮对雨蛙素诱导的慢性胰腺炎胰腺纤维化小鼠模型的治疗作用(体内实验)。
38.1.1研究方法
39.(1)实验小鼠分组方案:从上海灵畅生物科技有限公司购买18只健康清洁级雄性c57bl/6小鼠(6周龄)。将18只小鼠随机分成3组:对照组(control)、雨蛙素造模组(caerulein)和pfd治疗组(caerulein+pfd),每组各6只。
40.(2)小鼠慢性胰腺炎模型的构建:雨蛙素(caerulein/cae)是一种组成结构和功能上类似于胆囊收缩素的调节分子,能够刺激胃、胆管和胰腺的外分泌,已经成功应用于小鼠cp模型的建立。雨蛙素给药剂量为50μg/kg/只小鼠,给药途径为腹腔注射,给药时长共6周,每周3天(每周一、三、五),每天6次(每次给药间隔1h)。对照组小鼠给予相应的生理盐水。
41.(3)药物治疗方案:将pfd溶解在0.5%羧甲基纤维素钠(cmc-na)中,给药方式为灌胃,给药时间为从小鼠cp造模的第4周开始,每日灌胃1次,剂量200mg/kg,持续约4周(图1b)。对照组小鼠和雨蛙素造模组小鼠灌胃相应剂量的药物溶剂cmc-na。
42.(4)小鼠胰腺组织样本处理和组织石蜡切片制作:小鼠麻醉后使用手术器械打开
腹腔,留取部分胰腺组织放入rnalater试剂中以备提取组织内的总rna。留取部分胰腺组织放入4%多聚甲醛溶液中固定,次日用于组织石蜡切片制作。
43.(5)胰腺组织石蜡切片行h&e染色、siriusred染色、masson’strichrome染色和ihc染色,以评估腺泡萎缩、腺泡导管化生、炎细胞浸润和胰腺组织纤维化的严重程度。
44.(6)统计方法:本研究的数据使用spss22.0软件进行统计分析,实验结果以平均数
±
标准差(mean
±
sd)表示。当比较两组数据时,如果满足正态分布和方差齐性的条件,则采用student-t检验;如果不满足,则采用秩和检验。当比较多组数据时,如果满足正态分布和方差齐性的条件,则采用方差分析;如果不满足,则采用kruskal-wallish检验。设定p值《0.05为差异具有统计学意义。
45.1.2研究结果
46.(1)吡非尼酮改善cp小鼠的体重变化。
47.如图1所示,caerulein组小鼠的体重比control组明显下降。而caerulein+pfd组小鼠的体重比caerulein组有所增加,说明pfd可以改善cp小鼠的体重变化,改善营养状况。
48.(2)吡非尼酮减轻cp小鼠的胰腺组织萎缩、纤维化及炎症。
49.如图2所示,与control组相比较,caerulein组病理切片结果显示胰腺腺泡萎缩、炎细胞浸润、腺泡导管化生和纤维化形成。与caerulein组相比较,caerulein+pfd组病理切片结果显示胰腺组织损害程度明显减轻,可见pfd能够减缓6周雨蛙素所致的胰腺损伤。为进一步评估胰腺组织纤维化情况,本研究将石蜡切片进行天狼星红(siriusred)染色和masson’strichrome染色。与control组相比较,caerulein组siriusred染色结果显示胰腺组织内胶原明显增多,而caerulein+pfd组的胶原沉积比caerulein组明显减少。与control组相比较,caerulein组切片masson’strichrome染色结果显示胰腺间质纤维化,而caerulein+pfd组的纤维化区域比caerulein组显著缩小。胰腺组织内巨噬细胞的浸润是慢性炎症的一个特征,本研究将石蜡切片进行免疫组织化学(ihc)染色以评估巨噬细胞的浸润情况。f4/80是小鼠巨噬细胞的marker。与control组相比较,caerulein组切片染色结果显示f4/80阳性细胞数目明显增多,而caerulein+pfd组的f4/80阳性细胞数量减少。
50.(3)吡非尼酮下调胰腺组织内纤维化、炎症相关基因的表达。
51.如图3所示,与control组相比较,caerulein组纤维化相关基因tgfβ、αsma、col1α1和fn的表达明显增加。与caerulein组相比较,caerulein+pfd组纤维化相关基因的表达显著减少。胰腺组织内巨噬细胞marker相关基因f4/80和cd68的表达在caerulein组明显增加,而在caerulein+pfd组显著减少。胰腺组织内炎症相关细胞因子tnfα、il-6和趋化因子ccl2的基因表达在caerulein组明显升高,而在caerulein+pfd组显著降低。
52.《实施例3》
53.实施例3为吡非尼酮对人胰腺星状细胞活性与功能的影响及其分子作用机制(体外实验)。
54.2.1研究方法
55.(1)细胞培养:体外实验所用的人源胰腺星状细胞系(hpscs)购于上海和序生物科技有限公司。细胞培养基的配制方案为10%fbs+1%双抗(100u/ml青霉素和100u/ml链霉素)+dmem。恒温细胞培养箱设置为37℃,含有5%co2。(2)高敏cck-8检测:高敏cck-8法细胞增殖检测试剂盒是用于测定细胞增殖或毒性试验中活细胞数目的一种高灵敏度,无放射性
的比色检测法。具体检测步骤详见试剂盒说明书。
56.(3)划痕试验:划痕试验是测定细胞迁移运动能力的实验方法。用直尺、记号笔在无菌六孔板底面平行地画3条线,等分圆孔。向孔板内加入胰腺星状细胞,放入恒温培养箱培养。待细胞长满孔板时,用200μl枪头垂直于孔板底部并垂直于记号笔的划线,刮掉细胞。药物组的孔板内加入pfd(4.0mm),对照组的孔板内加入等量的dmso(药物溶剂)。在划痕后的6h、18h、24h三个时间点,分别在显微镜下观察划痕的宽度及位置并拍照记录。
57.(4)transwell迁移试验:样本分组:1)对照组(control):非tgf-β刺激,添加等体积dmso(药物溶剂)。2)单纯药物组:非tgf-β刺激,加入pfd(4.0mm)。3)单纯tgf-β(2ng/ml)刺激组:添加等体积dmso(药物溶剂)。4)药物组+tgf-β刺激:pfd(4.0mm)+tgf-β(2ng/ml)。向24孔板中加入10%fbs培养基,500μl/孔。向孔板中放入transwell小室,避免滤膜与培养液之间留有气泡。将15000个细胞加入每个transwell小室内,放入恒温培养箱培养24h。取出小室,弃去小室内的培养基,加入pbs清洗,弃pbs,然后用棉签轻轻擦去滤膜上面的细胞(未穿膜的pscs)。4%多聚甲醛固定,结晶紫染液染细胞。显微镜下观察穿过滤膜的细胞数目,拍照记录,比较不同分组间pscs的穿膜迁移能力。
58.(5)流式细胞术:流式细胞术检测细胞凋亡。使用六孔板培养pscs,待细胞生长密度为孔板面积的30%时添加药物pfd(2.0,4.0mm)。实验分组:1)对照组(control):添加等体积dmso(药物溶剂)2)药物处理组:pfd作用48h。annexinv-fitc+pi染色凋亡细胞。流式细胞仪上机检测,计算细胞凋亡比例。(6)转录组测序分析:将pscs分为对照组(con-1、con-2、con-3)和pfd药物处理组(pfd-1、pfd-2、pfd-3),在正常培养的pscs中加入pfd(4.0mm)处理4h后提取细胞样品的总rna,随后进行转录组测序(使用illuminahiseqtm2500测序仪进行测序)及测序数据分析(对差异表达基因进行go富集分析,利用kegg数据库对差异表达基因进行pathway分析)。
59.2.2研究结果
60.(1)低浓度吡非尼酮对胰腺星状细胞活性影响小。
61.如图4所示,浓度为0-8mm的pfd用于cck-8实验,药物处理时长为48h。显微镜下可见pscs的形态呈梭形或多边形,pfd对细胞形态无显著影响(图4a)。大浓度(6-8mm)pfd对pscs的活性产生明显抑制作用,表明大浓度pfd可能对pscs产生毒性作用(图4b)。因此,本研究将选取低浓度药物(1.0、2.0、4.0mm)进行后续实验。
62.(2)吡非尼酮抑制胰腺星状细胞的活化及细胞外基质的合成。
63.为探索pfd对pscs生物学功能的影响,本研究选取浓度梯度(1.0、2.0、4.0mm)药物处理细胞,检测pscs活化marker(αsma)及细胞外基质蛋白fibronectin和collageni的表达,并检测纤维化相关细胞因子ctgf(结缔组织生长因子)和胶原合成分子“伴侣”热休克蛋白hsp47的表达。基因serpinh1编码蛋白hsp47。pfd处理pscs24h,qpcr方法检测基因的转录表达水平。进行不同组间比较可见pfd能够减少基因αsma、fn、col1α1、ctgf和serpinh1的转录表达,并能够抑制tgfβ刺激所致的基因转录表达的增加(图5)。pfd处理pscs48h,免疫印迹实验(wb)检测细胞内的蛋白表达。进行不同组间比较可见pfd能够剂量依赖性减少蛋白αsma、fibronectin、collageni和ctgf的表达并能够抑制tgfβ刺激所致的蛋白表达的增加(图6)。此外,细胞免疫荧光染色(if)也可以进一步证明pfd能够抑制pscs活化及ecm的合成(图7)。
catenin信号通路(图13a,b)。qpcr实验结果显示pfd能够抑制靶基因ccnd1、c-myc和lef1的转录表达而不影响β-catenin的转录表达。tgf-β可以上调靶基因ccnd1、c-myc和lef1的转录表达而不影响β-catenin的转录表达(图13c,d)。此外,if实验也证明pfd可以降低ccnd1的蛋白表达(图13e)。
73.(7)吡非尼酮抑制jak/stat信号通路
74.由转录组测序分析可知pfd处理pscs影响了细胞内jak/stat信号通路。已有研究表明jak/stat信号通路可以调控pscs的活化和小鼠cp的进展。为进一步探索此信号转导途径,本研究使用wb方法检测信号通路中的关键转录因子stat3和stat1的磷酸化水平。wb实验结果显示pfd能够减少p-stat3的表达而不影响p-stat1(图14a,b)。if实验结果也显示pfd能够下调stat3的磷酸化水平(图14d)。此外,qpcr实验结果显示pfd能够降低基因il-6和lif的转录表达而升高基因socs的转录表达,对基因il-6r、lifr、gp130和cish无影响(图14c)。
75.上述实施例的实验结果表明,吡非尼酮显著减轻了小鼠慢性胰腺炎、胰腺纤维化。吡非尼酮能够抑制人胰腺星状细胞的迁移,促进细胞凋亡,并通过tgf-β/smad、wnt/β-catenin和jak/stat信号通路抑制pscs的活化与细胞外基质的合成(图15)。因此,吡非尼酮具有治疗慢性胰腺炎、胰腺纤维化的新用途。
76.以上已对本发明的较佳实施例进行了具体说明,但本发明创造并不限于实施例。熟悉本领域的研究人员在不违背本发明创造精神的前提下还可做出等同的变型或替换,这些等价形式均包含在本技术权利要求所限定的范围内。
77.上述实施方式为本发明的优选案例,并不用来限制本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1