人脂肪间充质干细胞在制备治疗硬皮病药物中的应用的制作方法
1.本发明涉及细胞治疗技术领域,特别涉及人脂肪间充质干细胞在制备治疗硬皮病药物中的应用。
背景技术:
2.硬皮病(scleroderma)通常指系统性硬化症(systemic sclerosis,ssc),其是一种病因不明的自身免疫性结缔组织病(autoimmune connective tissue disease,ai-ctd),累及皮肤、血管及内脏器官。系统性硬化症这个病名旨在表达此病有系统累及的特征,临床上分为两个主要亚型局限皮肤型ssc(cutaneous limited ssc,lcssc)与弥漫皮肤型ssc(cutaneous diffuse ssc,dcssc)。局限皮肤型ssc皮肤纤维化局限于手指、手和面部。弥漫皮肤型ssc皮肤弥漫性硬化,通常始于手指和手,渐延及前臂、上肢、面部、躯干及下肢。ssc是一种以皮肤和肺纤维化为主要特征的自身免疫性疾病,其临床表现包括血管损伤、免疫失调及皮肤和内部器官胞外基质(ecm)积聚。尽管ssc发病和致死率很高,但目前尚未建立有效的治疗方法。
3.某些研究者,也把硬斑病( morphea)和硬化性苔藓(lichen sclerosus)归为硬皮病。硬斑病和硬化性苔藓临床表现都是独特的炎性疾病。硬斑病主要累及皮肤和皮下脂肪,最后形成瘢痕样硬化。尽管硬斑病和系统性硬皮病都有小血管改变、炎症浸润并最终发生的结构变化相同,但两种疾病有各自的特点,很容易从临床上加以区分。硬斑病皮损为非对称性,斑片状或带状分布;而系统性硬皮病则表现为起于手指和手、进行性进展至前臂的对称性硬化(lcssc),或表现为对称性进展的皮肤硬化,累及躯干和四肢近端(dcssc)。硬化性苔藓与硬斑病最终发展为截然不同的皮肤硬化模式,硬化性苔藓常多见于外生殖器黏膜,也见于生殖器以外的部分,可累及表皮和真皮。尽管硬斑病可引起关节挛缩和皮下肌肉萎缩,但一般来说,硬斑病是没有内脏器官累及的。
4.干细胞是一组可以自我更新并具有多种分化能力的细胞。间充质干细胞(mscs)在体外和体内均表现出免疫调节、免疫抑制、促血管生成、抗炎等特性,所以mscs可靶向治疗免疫疾病和炎症疾病的关键病理特征。
5.已知间充质干细胞作为治疗炎症及免疫系统疾病药物,尤其是治疗硬皮病、硬斑病方面,已有多篇文章和专利报道,然而利用特定趋化的人脂肪间充质干细胞,针对性治疗目前还没有报道。
6.如何发挥间充质干细胞更优的免疫特性,尤其在体外更安全稳定的扩增适合临床需要的具有靶向功能的干细胞是本发明要研究解决的问题。
技术实现要素:
7.为了解决上述背景技术中存在的问题,本发明的主要目的在于提供人脂肪间充质干细胞在制备治疗硬皮病药物中的应用。
8.为实现上述目的,本发明选用人脂肪间充质干细胞。
9.首先,人脂肪间充质干细胞伦理和法规要求相对宽泛;人脂肪间充质干细胞免疫原性低。从移植的部位、成本、干细胞数目等等因素考虑,相对于其他成体干细胞,脂肪间充质干细胞有如下优点:量大,皮下分布,采集容易,采集部位副作用小。
10.由于,本发明第一目的是解决硬皮病皮肤硬化等问题,人脂肪间充质干细胞来源于皮下脂肪,人脂肪间充质干细胞本身存活和生长需要特定的环境,用人脂肪间充质干细胞治疗皮肤等相关疾病,其分化为细胞外基质所需相关因子最直接、环境改变最小。由于特定微环境的作用,人脂肪间充质干细胞能发挥其最大调节和治疗潜能。
11.基于此,本发明具体解决技术方案如下:首先,本发明提供了人脂肪间充质干细胞在制备治疗硬皮病药物中的应用,所述人脂肪间充质干细胞分泌以下干细胞因子hgf、vegf,各干细胞因子的分泌量大于975pg/1
×
106cells;所述人脂肪间充质干细胞对th1、treg、il-17有免疫调节能力,同时对tnf-α抑制率大于95%。
12.优选地,所述人脂肪间充质干细胞的工作细胞为p5代细胞,p2代到p5代细胞所述hgf分泌量>2504pg/1
×
106cells,vegf分泌量>975pg/1
×
106cells。更优选地,p5代细胞hgf分泌率大于12160.4
±
3568.5pg/1
×
106cells,vegf分泌率大于4229.4
±
165.3pg/1
×
106cells。
13.优选地,所述人脂肪间充质干细胞细胞表面标志物cd73、cd90、cd105阳性表达,阳性率不低于95%;cd11b、cd19、cd34、cd45、hla-dr阴性表达,阳性率应不高于2%;细胞具有成脂细胞、成骨细胞、成软骨细胞分化的能力。
14.优选地,所述人脂肪间充质干细胞为异体脂肪间充质干细胞。
15.优选地,所述硬皮病包括系统性硬化症、硬斑病、硬化性苔藓。
16.优选地,有效治疗剂量人脂肪间充质干细胞同时还通过有效促进cd31分化量,抑制tgf-β1表达量,降低i型胶原表达水平与iii型胶原表达水平或降低i型胶原与iii型胶原表达的相对比例,降低α-sma的表达量,和/ 或抑制il-17促炎细胞因子的表达,达到对硬皮病的有效治疗。
17.优选地,所用人脂肪间充质干细胞有效剂量为每只小鼠单点注射,注射剂量为5
×
104~5
×
106cells/个位点。
18.优选地,有效治疗剂量人脂肪间充质干细胞干细胞能够抑制或减慢硬皮病患者面部皮肤的一处或多处硬化、手指皮肤的硬化、雷诺综合症、钙化、皮肤厚度、毛细管扩张或食道运动障碍症状中的一种或多种;或降低血液中一种或多种抗着丝粒抗体或抗拓扑异构酶抗体的量或浓度;或改善肺脏或脾脏损伤程度。
19.最优选地,有效治疗剂量人脂肪间充质干细胞干细胞能够抑制或减慢硬皮病患者手指皮肤的硬化、雷诺综合症、钙化、皮肤厚度、毛细管扩张症状中的一种或多种。
20.进一步地,本发明第二目的提供了制备人脂肪间充质干细胞的制备方法,所述人脂肪间充质干细胞制备采用消化法和贴壁法获得,采用的培养基为无血清完全培养基,所述人脂肪间充质干细胞由p0传代培养至p5代为工作细胞,p2代到p5代干细胞经过干细胞因子hgf、vegf的筛选,各代干细胞因子的分泌量大于975pg/1
×
106cells。
21.优选地,p2代到p5代干细胞还经过免疫调节因子th1、treg、il-17和/或tnf-α,所述p2代到p5代干细胞还经过免疫调节因子th1、treg、il-17和tnf-α筛选,对th1抑制率大于
60%,treg促进率大于50%,对tnf-α抑制率大于90%。
22.优选地,对tnf-α抑制率大于95%。
23.优选地,所述无血清完全培养基为基础培养基是α-mem,还添加3.8%(v/v)血小板裂解物、30ng/ml重组人表皮生长因子、10ng/ml重组人碱性成纤维细胞生长因子、10ng/ml重组人源血管内皮生长因子、20ng/ml胰岛素样生长因子和5
µ
g/ml纤连蛋白。
24.优选地,所述无血清完全培养基为市售为无血清完全培养基,在一优选实施例中为友康培养基和友康添加剂按照500:1配置。
25.优选地,所述消化法采用的消化液为0.1%~0.5%ⅱ型胶原酶,37℃,100~150rpm,震荡消化30~40min。
26.优选地,传代培养过程中,细胞接种密度为8
×
103~1.2
×
104/cm2。
27.优选地,所述人脂肪间充质干细胞的注射方式为皮下注射、皮内注射、肌肉注射、静脉注射。更优选皮下注射。
28.优选地,所述人脂肪间充质干细胞通过皮下注射能够预防或治疗皮肤病灶部位,对脏器也有不同程度预防或治疗作用。
29.基于上述技术方案,本发明具有以下有益效果:本发明制备的人脂肪间充质干细胞能够安全稳定的扩增适合大规模临床生产需要,同时对免疫系统因素、炎症因素、创伤或退行性因素引起的纤维化或血管异常或免疫系统疾病,尤其是硬皮病表现出优异的治疗效果。
附图说明
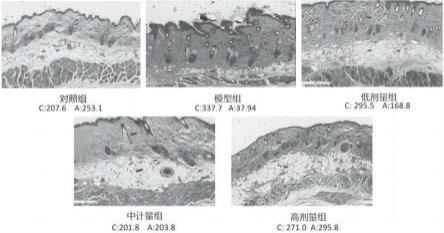
30.图1 实施例2中细胞表面标志物的检测结果;图2实施例3中剂量探索组1单次注射adscs 28d后各组皮肤masson染色图,c表示胶原纤维厚度(单位μm),a表示真皮层脂肪组织厚度(单位μm);图3实施例3中剂量探索组1两次注射adscs 28d后各组皮肤masson染色图,c表示真皮层纤维化厚度(单位μm),a表示真皮层脂肪组织厚度(单位μm);图4实施例3剂量探索组2注射adscs 28d后各组皮肤masson染色图;c表示胶原纤维厚度(单位μm),a表示真皮层脂肪组织厚度(单位μm);图5实施例3剂量探索组2注射adscs 28d后各组胶原纤维厚度和脂肪层厚度变化,**p《0.01 vs con;##p《0.01 vs m;图6实施例4注射adscs 28天后各组cd31的表达情况;图7实施例4注射adscs 28天后各组tgf-β1的表达情况;图8实施例4注射adscs 28天后各组i型胶原的表达情况;图9实施例4注射adscs 28天后各组iii型胶原的表达情况;图10实施例4各给药组i型胶原与iii型胶原的比值对比;图11实施例4注射adscs 28天后各组α-sma的表达情况;图12实施例4单次注射adscs 28天后各组tnf-α的表达情况;图13实施例4单次注射adscs 28天后各组il-17的表达情况;图14小鼠注射荧光标记adscs后体内相对荧光强度变化。
具体实施方式
31.以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。下述实施例中所有的材料、试剂等,如无特殊说明,均可从商业途径获得。当描述本发明的实施方式时,使用、“优选地”、“更优选地”等指,在某些情况下可提供某些有益效果的本发明实施方案。然而,在相同的情况下或其他情况下,其他实施方案也可能是优选的。除此之外,对一个或多个优选实施方案的表述并不暗示其他实施方案不可用,也并非旨在将其他实施方案排除在本发明的范围之外。
32.在本发明中,脂肪组织来源于健康人捐献的脂肪组织样本提取扩增而成。人脂肪间充质干细胞既可以是源自被检体的自体细胞,也可以是源自同种的其它健康对象的异体细胞。优选为异体细胞。
33.细胞表面标志物是指脂肪间充质干细胞表达标记物基因、或表达标记物蛋白、或表达其两者。即,是指脂肪间充质干细胞表达选自cd73、cd90、cd105组中的细胞表面标记物的基因和/或蛋白;不表达选自cd11b、cd19、cd34、cd45、hla-dr组中的细胞表面标记物的基因和/或蛋白。此处,对于人脂肪间充质干细胞是否表达了各标记物的判断,就基因表达而言例如可以通过基因芯片阵列、聚合酶链反应(逆转录酶pcr、实时pcr、现有的pcr)等现有公知的方法来进行。另外,就蛋白表达而言,例如可以通过使用与各标记物蛋白特异性结合的抗体的facs解析(流式细胞技术)、酶联免疫吸附检测法(elisa)等现有公知的方法来进行。在任意情况下均将未表达各标记物基因或蛋白的细胞作为阴性对照,从而判断表达的有无、表达的高低。
34.本发明的脂肪间充质干细胞表达cd73、cd90、cd105,阳性率不低于95%;更优选阳性率不低于98%;最优选阳性率不低于99%。本发明的脂肪间充质干细胞不表达cd11b、cd19、cd34、cd45、hla-dr,阳性率应不高于2%;更优选阳性率不高于1%。表达了上述标记物的间充质干细胞显示出优异的抗纤维化作用、抗炎作用等。
35.本发明的人脂肪间充质干细胞除了表达上述特定标记物这样的特征之外,例如还可以通过以下方法来表征:生长特征(例如,传代代数、倍增时间)、核型分析(例如,正常核型、母体系统或新生儿系统)、利用流式细胞术(例如,facs分析)的除上述以外的表面标记物表达、免疫组织化学和/或免疫细胞化学(例如,表位检测)、基因表达谱(例如,基因芯片阵列;反转录pcr、实时pcr、以往类型pcr等聚合酶链反应)、mirna表达谱、蛋白质阵列、细胞因子等蛋白质分泌(例如,血浆凝固分析、elisa、细胞因子阵列)、代谢产物(代谢物组学分析)、本领域中已知的其它方法等。
36.人脂肪间充质干细胞可以通过细胞与细胞间的直接接触,以及分泌效应分泌生物活性因子,如生长因子、细胞因子和趋化因子等行使其相应作用。如本发明的人脂肪间充质干细胞还可以通过有无以下特定的细胞因子分泌或蛋白来进一步表征。本发明的人脂肪间充质干细胞分泌hgf、vegf一种或两种细胞因子。
37.hgf(hepatocyte growth factor,hgf),肝细胞生长因子,该基因编码一种与肝细胞生长因子受体结合的蛋白质,以调节许多细胞和组织类型的细胞生长,细胞运动和形态发生。选择性剪接导致多个转录本变体,其中至少一个编码前蛋白,该前蛋白经过蛋白水解处理以产生α和β链,形成成熟的异源二聚体。这种蛋白质由间充质细胞分泌,在主要上皮来
源的细胞上充当多功能细胞因子。这种蛋白质也在血管生成,肿瘤发生和组织再生中发挥作用。adscs分泌的hgf可有效抑制纤维化,加入hgf抗体,使蛋白表达和分泌恢复到基础水平。adscs分泌因子hgf在促进血管生成和抗纤维化中的有显著作用。
38.vegf(vascular endothelial growth factor,vegf),血管内皮生长因子,一种高度特异性的促血管内皮细胞生长因子,具有促进血管通透性增加、细胞外基质变性、血管内皮细胞迁移、增殖和血管形成等作用。
39.本发明细胞因子分泌量可以通过本领域技术人员利用公知的方法来测定。例如可列举出elisa法等。优选地,本发明p5代细胞hgf分泌率>12160.4
±
3568.5pg/1
×
106cells,vegf分泌率>4229.4
±
165.3pg/1
×
106cells。
40.如,本发明的人脂肪间充质干细胞通过流式细胞分析技术或免疫组织化学染色方法检测相关分泌因子的免疫调节功能。th1细胞是cd4+辅助细胞的一种亚型。th1细胞是参与细胞介导的炎症和延迟型超敏反应的典型细胞类型,其介导的免疫反应是促炎反应。treg细胞可以在各种免疫细胞亚群中通过细胞间接触和分泌抑制性细胞因子,对机体的免疫反应起到负性调节作用,抑制机体免疫反应和对自身抗原的主动耐受,从而避免自身免疫疾病的发生。tnf-α即肿瘤坏死因子α,是一种多效性的系统性炎症反应介质。tnf-α属于促炎细胞因子,参与免疫炎症反应,主要由巨噬细胞产生,单核细胞、嗜酸性细胞、成纤维细胞以及上皮细胞等也能分泌tnf-α。il-17是一种促炎细胞因子,是由炎症条件下活化的cd4+ t细胞亚群产生的。本发明制备的人脂肪间充质干细胞对th1、tnf-α、il-17都表现出高的免疫抑制率,尤其对tnf-α免疫抑制率达到95%以上;对treg的免疫增殖率达到50%以上。本发明的人脂肪间充质干细胞对免疫性疾病具有显著治疗作用。
41.本发明的人脂肪间充质干细胞具有向着骨、脂肪、软骨分化的分化能力。关于各自的分化能力,可以通过本领域技术人员利用公知的分化诱导条件培养上述间充质干细胞群体来进行判断。 脂肪细胞、骨细胞及软骨细胞难以由其细胞形状来判定,但可以通过对细胞内脂质进行染色(例如可以通过油红o染色法染成红色。)来确认脂肪细胞的存在。另外,通过将细胞用茜素红(alizarin red)进行染色,能够确认骨细胞的存在。另外,通过进行番红o染色能够确认软骨细胞的存在。利用本发明中培养基和培养方法获得的干细胞具有向着脂肪细胞、骨细胞、软骨细胞分化的分化能力。
42.细胞的代数是影响干细胞活性及临床有效性、安全性的一个重要因素。理论上讲,细胞代数越靠前,干细胞的干性也越强。但是干细胞在体外培养的过程中,干细胞有从组织微环境到体外培养环境的一个调整和适应过程,一部分不适应的细胞会被淘汰,所以在前两三代,干细胞基因组有着不稳定的因素,可能不宜临床应用。本发明选用p5代人脂肪间充质干细胞作为工作细胞在治疗效果中表现良好。尤其对促血管、抗纤维化作用以及免疫特性表现优异。
43.本发明的人脂肪间充质干细胞对人皮肤成纤维细胞发挥作用,显示出抑制作为纤维化相关基因的tgf-β和col3的表达的效果。因此,本发明的人脂肪间充质干细胞可以说对人皮肤成纤维细胞的纤维化相关疾病如硬化症、动脉硬化等疾病是有效的。
44.本发明的人脂肪间充质干细胞还显示出抑制作为纤维化相关基因的 col1的表达的效果。因此,本发明的人脂肪间充质干细胞可以说该基因导致的炎症、纤维化相关疾病是有效的。
45.能够用本发明制备的人脂肪间充质干细胞制备的疾病包括免疫系统因素、炎症因素、创伤或退行性因素引起的纤维化或血管异常疾病或免疫性疾病,尤其对自身免疫性结缔组织病硬皮病效果显著。
46.具体优选实施例如下实验例1 脂肪间充质干细胞的体外分离、培养1、人脂肪组织的采集人脂肪组织采集环境:手术室洁净环境中进行的无菌操作。人脂肪组织采集操作:待患者麻醉、消毒、铺巾后,于吸脂区域做一5 mm左右切口后注射预先配置好的肿胀液(1000 ml生理盐水+2%利多卡因30 ml+1:1000肾上腺素1 ml+5%碳酸氢钠10 ml),肿胀液的注射量根据吸脂范围而定,腹部和单侧大腿吸脂需注射1000 ml。肿胀液注射后,首先按揉10 min;然后采用注射器法或吸引器法进行吸脂;吸脂完成后,将注射器直立放置10 min,待脂肪与肿胀液分层后,排出下层肿胀液,仅收集上层脂肪,置于样本采集瓶中。
47.2、组织处理和原代细胞的制备2.1.人脂肪组织样本分离用移液管吸取组织样本转移至离心管中,然后向其加入氯化钠注射液反复吹打清洗,室温 600g,1min,离心。离心后吸弃组织上层淡黄色脂肪液体及组织下层液体,然后向其加入氯化钠注射液再次清洗,重复上述步骤6-9次,直至清洗人脂肪组织无血色为止。
48.2.2脂肪组织样本消化清洗完,用移液管将样本转移至新的离心管中,记录。加入与样本等体积的0.1%-0.5%(体积浓度)胶原酶消化液工作液至离心管中,并吹打混匀。将该离心管横放于恒温振荡器中固定好,37℃、100~150rpm、30~40min消化,直至无肉眼可见的大颗粒组织,消化完成的脂肪成糊状,室温 600g,5min,离心。
49.2.3 svfs细胞清洗、过滤及收集用移液管吸弃上层的脂肪和上清,加入30ml细胞清洗液重悬细胞沉淀并吹打混匀后,细胞悬液用100μm筛网过滤至离心管,室温600g,5min,离心。用移液管吸弃上清,加入无血清完全培养基重悬细胞沉淀并吹打混匀后,细胞悬液用100μm筛网过滤至1个50ml离心管中,计数。
50.2.4 svfs细胞接种及培养每个t75培养瓶按30000~60000个活细胞/cm2的细胞接种密度接种,补充无血清完全培养基至每个t75培养瓶最终体积为15ml,摇匀细胞悬液均匀平铺至培养瓶底部。水平放入二氧化碳培养箱5%co2、37℃培养,3-4天。
51.2.5原代细胞(p0代)换液及培养待原代细胞(p0代)观察完成后,首先使用移液管吸弃细胞培养上清,添加细胞清洗液。用25ml移液管缓慢添加无血清完全培养基至培养瓶中,缓慢摇匀使其分布均匀至培养瓶底面。水平放入二氧化碳培养箱5%co2、37℃再培养3-4天。所述无血清完全培养基为基础培养基是α-mem,还添加3.8%(v/v)血小板裂解物、30ng/ml重组人表皮生长因子、10ng/ml重组人碱性成纤维细胞生长因子、10ng/ml重组人源血管内皮生长因子、20ng/ml胰岛素样生长因子和5
µ
g/ml纤连蛋白。
52.3干细胞的传代培养和冻存
3.1细胞观察及消化若镜下观察细胞均异常,且细胞融合度达到80%以上,则进行原代细胞(p0代)消化及接种。使用加入氯化钠注射液,用移液管吸弃氯化钠注射液,重复上述操作,清洗两次。使用移液管加入消化酶,轻摇瓶身,使消化酶(tryple)均匀铺满细胞表面。
53.3.2细胞的消化终止及收集镜下观察,若细胞质回缩,细胞间隙增大,漂浮且不再连接成片,则消化完成。随后使用移液管加入细胞清洗液,轻摇瓶身,收集至离心管中。并室温600g,5min,离心。
54.3.3 细胞接种离心完毕后,使用移液管吸弃离心上清液,轻弹离心管底部,使用移液管吸取完全培养基重悬细胞沉淀并吹打混匀。根据计数结果,按8000-12000/cm2接种密度接种。换瓶补充完全培养放入二氧化碳培养箱5%co2、37℃培养3天。并传代至p2,p2代细胞检测后进行细胞冻存。定向检测趋化因子中,hgf、vegf分泌量大于975pg/1
×
106cells,对th1抑制率大于60%,treg促进率大于50%,对tnf-α抑制率大于90%。
55.4工作细胞的制备4.1细胞复苏复苏细胞,核对标识,确定无误后迅速放入37℃水浴锅中。当冻存管内容物融解到黄豆粒大小时,从水浴锅中取出冻存管,并移至生物安全柜打开。
56.4.2 p3细胞接种用移液管吸取细胞悬液,缓慢加入至装有完全培养基的离心管中;用移液管吸取细胞悬液冲洗冻存管内壁,收集残留细胞,转移至离心管中,充分混匀后,室温600g,5min,离心;离心结束后吸弃上清液,并加入完全培养基,轻轻吹打混匀,计数。根据计数结果,按8000-12000/cm2接种密度接种,吹打混匀,用10ml移液管吸取1ml细胞悬液依次转移至每个t75培养瓶中,补充完全培养基。将t75培养瓶水平放入二氧化碳培养箱5%co2、37℃中培养3天。重复传代至p5为工作细胞。
57.p5代细胞定向检测趋化因子中,hgf、vegf分泌量大于975pg/1
×
106cells,对th1抑制率大于60%,treg促进率大于50%,对tnf-α抑制率大于95%。
58.实施例2、人脂肪间充质干细胞的鉴定和功能评价1、细胞数及活率将冻存细胞置于37℃恒温水浴锅中快速融化,然后把冻存管内悬液转移至含9ml完全培养基的15ml离心管中并混匀,置于离心机中500g、5min离心,离心完毕后弃上清,轻弹离心管底部并加入10ml完全培养基,轻轻吹打混匀,从悬液中部取样至ep管中,每个样本不少于200μl,重复此步骤三次,取三个样本,分别对3份细胞悬液进行aopi染色后置于细胞计数仪中计数,细胞数应在0.8
×
107~1.5
×
107,活率都不低于80%。
59.2、细胞表面标志物利用流式细胞技术检测每代细胞表面标志物,cd105、cd73和cd90不低于95%的细胞表达,且表达cd45、cd34、cd11b、cd19、hla-dr类分子的细胞不应超过总数的2%,例如取p2和p5细胞通过流式细胞仪检测标记对应抗体的间充质干细胞,以确定间充质干细胞符合标准。检测结果如图1所示。
60.3、三系分化
本发明p5细胞成脂分化后的细胞经油红o染色应成红色脂滴,成骨分化后的细胞经茜素红染色应成红色钙结节,成软骨分化后的细胞经切片后番红o染色呈红色。实验结果表明,本发明p5细胞向着脂肪细胞、骨细胞分化的分化能力与其他间充质干细胞群体相比显著提高。
61.4、用elisa法检测hgf分泌率供试品制备:待测样本为供试品,对待检测样本稀释4倍。取适量酶标板孔,将assay diluent rd1-38以100μl/孔加入到酶标板中,每个浓度标准品2个孔,供试品2个孔。将稀释后的标准品、供试品分别以50μl/孔加入到酶标板中,盖好封板膜,室温下500
±
50rpm水平震荡孵育2h。取出酶标板,重复洗板4次。将human hgf conjugate抗体320以200μl/孔加入到酶标板中,盖好封板摸,室温下500
±
50rpm水平震荡孵育1h。取出酶标板,重复洗板4次。将streptavidin-hrp 1以200μl/孔加入到酶标板中,盖好封板摸,室温下避光500
±
50rpm水平震荡孵育0.5h。取出酶标板,重复洗板4次。将显色液a与显色液b等体积混合制成显色液。以200μl/孔加入到酶标板中;盖好封板膜,室温避光孵育0.5h。取出酶标板,以50μl/孔加入终止液,充分混匀。将酶标板放入酶标仪,盖上盖子;在gen5软件上选择450nm/570nm波长,四参数拟合曲线测定各孔od值;以标准品浓度为横坐标,所测od值为纵坐标制作标准曲线,进行回归分析并计算r2。p5代细胞hgf分泌率为12160.4
±
3568.5pg/1
×
106cells。
62.5、用elisa法检测vegf分泌率待检测样本稀释25倍。将稀释后的标准品、供试品分别以100μl/孔加入到酶标板中,盖好封板膜,室温孵育2h,每个浓度标准品2个孔,供试品2个孔。取出酶标板,重复洗板4次。将human vegf conjugate抗体以200μl/孔加入到酶标板中,盖好封板膜,室温下孵育2h。取出酶标板,重复洗板4次。将显色液a与显色液b等体积混合制成显色液。以200μl/孔加入到酶标板中;盖好封板膜,室温避光孵育0.5h。取出酶标板,以50μl/孔加入终止液,充分混匀。将酶标板放入酶标仪,盖上盖子;在gen5软件上选择450nm/570nm波长,四参数拟合曲线测定各孔od值;以标准品浓度为横坐标,所测od值为纵坐标制作标准曲线,进行回归分析并计算r2。p5代细胞vegf分泌率为4229.4
±
165.3pg/1
×
106cells。
63.6、 检测th1、treg和tnf-α免疫调节(1)elisa方法检测tnf-α将人脂肪间充质干细胞与激活后的免疫细胞共培养,检测其增殖比例,检测其抑制免疫细胞增殖能力。淋巴细胞阳性样本:用稀释液将阳性样本稀释10倍,检测样本:用稀释液将检测样本稀释2倍。
64.将稀释后的标准品、供试品分别以100μl/孔加入到酶标板中,盖好封板膜,室温下孵育2h,每个浓度标准品2个孔,供试品2个孔。取出酶标板,弃去酶标板内溶液,重复洗板4次。将human tnf-α conjugate抗体以200μl/孔加入到酶标板中,盖好封板膜,室温下孵育2h。取出酶标板,弃去酶标板内溶液,重复洗板4次。将显色液a与显色液b等体积混合制成显色液。以200μl/孔加入到酶标板中;盖好封板膜,室温避光孵育30min。取出酶标板,以50μl/孔加入终止液,充分混匀。将酶标板放入酶标仪,盖上盖子;在gen5软件上选择450nm/570nm波长,四参数拟合曲线测定各孔od值;以标准品浓度为横坐标,所测od值为纵坐标制作标准曲线,进行回归分析并计算r2。样本检测结果如下表1所示,p2代和p5代都达到96%以上。
65.(2)基于共培养法的treg调控检测法将供试品人脂肪间充质干细胞以2
×
105cells/ml/孔的细胞量接种至24孔板的2个孔内(分别设置为msc对照孔及共培养孔),将其放置于5%co
2 、37℃的二氧化碳培养箱中培养2h。将cd3
+
t细胞置于电热恒温水浴锅设置温度为37℃,放置1~2min,待其融化后按照1
×
106cells/孔接种至共培养孔内,并接种cd3
+
t细胞单培养孔,接种完成后向共培养孔内及cd3
+
t细胞单培养孔内加入il-2置于5%co
2 、37℃的二氧化碳培养箱中培养90
±
1h。待培养90
±
1h后将共培养孔及cd3
+
t细胞单培养孔细胞取出,用1ml pbs重悬细胞,标记zombie violettm fixable viability kit,避光孵育30min。
66.标记表面抗体cd4,cd25,破膜固定后标记foxp3+用流式细胞仪检测treg亚群细胞比例。样本检测结果如下表1所示,p2代和p5代都达到60%以上。
67.(3)基于共培养法的th1调控检测法。
68.二氧化碳培养箱中培养时间为60
±
1h,待细胞培养60
±
1h后向共培养孔内及cd3+t细胞单培养孔内加入试剂cell stimulation cocktail继续培养6h。标记表面抗体cd4,cd8,破膜固定后标记cd4,ifn-γ用流式细胞仪检测th亚群细胞比例。其余步骤同treg调控检测法。样本检测结果如下表1所示,p2代和p5代都达到50%以上。
69.表1免疫细胞的免疫调节能力实施例3 动物实验剂量探索1、材料(1)实验动物:c57bl/6j小鼠,雌性,6-8周龄,18-20g,购于斯贝福(北京)生物技术有限公司。
70.(2)材料与仪器:分析天平(sartorius),人脂肪间充质干细胞 (adscs,p5),间充质干细胞无血清基础培养基(友康生物科技北京股份有限公司);间充质干细胞无血清培养基添加剂3(友康生物科技北京股份有限公司),masson 三色染色液(北京索莱宝科技有限公司);博来霉素(mce)。cd31(abcam); tgf-β1(abcam); collagen iii (abcam); α-sma(abcam); hgf(abcam),显微镜玻片扫描仪(型号:aperio cs2,徕卡公司)。
71.(3)造模方法:博来霉素腰背部皮下注射诱导小鼠系统硬化症模型,每天给药(100μl/只,50μg/只),持续28天。
72.2、实验分组(1)剂量探索组1:已通过博来霉素诱导造模的小鼠根据体重随机分成9组(组2-9),另设生理盐水模拟造模组作为空白对照(组1),每组18只小鼠。分组及具体给药方式如表2所示:表2.剂量探索组1分组和实验方案情况
a.第1组前9只动物与后9只动物分别于给药后7/14/28天取皮肤,进行病理检查,3只/时间点; 2-10组动物于给药后7/14/28天取皮肤,进行病理检查,6只/时间点。b.第1-3组给予同等体积溶媒(100μl/只),其中第1组前9只动物单次给药,后9只动物两次给药。qw:"quaque week",每周一次。
73.(2)剂量探索组2完成博来霉素诱导造模的小鼠根据体重随机分成4组(组2-5),另设生理盐水模拟造模组作为空白对照(组1),每组16只小鼠(空白对照组10只)。分组及具体给药方式如表3所示:表3.剂量探索组3分组和实验方案情况c.第1组动物分别于给药后14/28天取皮肤,进行病理检查,5只/时间点; 2-5组动物于给药后14/28天取皮肤,进行病理检查,8只/时间点。d.第1-2组给予同等体积溶媒(100 μl/只)。
74.3、实验方案-测量动物体重:每天称量小鼠体重并记录。根据小鼠体重采用随机数字分组法对造模后的小鼠进行分组,之后记录小鼠体重。皮下注射adscs后,每天监测各组小鼠体重,结果证实,与注射同等体积溶媒的模型小鼠相比,接受adscs中高剂量治疗的小鼠体重在给药14天时明显高于模型小鼠,在28天时与模型组相比未观察显著性差异。具体结果见表4:
表4.注射adscs前后不同组别小鼠体重变化(注:*p《0.05 vs con;p《0.01 vs m)。
75.4、实验方案-病理切片检测取小鼠注射局部病灶组织制作病理组织切片并进行masson 染色,采用aperio imagescope v12.3.3.7014分析masson染色切片,用spss16.0、graphpad 8.0.1统计分析软件进行统计分析和绘图。
76.(1)剂量探索组1单次注射adscs 28天后真皮层厚度变化如图2所示,与模型组相比,单次给药28d后,adscs低、中、高剂量组和静脉组胶原纤维厚度均有下降趋势,且低剂量效果最好,中剂量次之;脂肪层厚度中剂量、高剂量和尾静脉有一定程度增厚,但整体与模型组相比没有显著性差异。各剂量组均未见明显炎症细胞浸润。
77.(2)剂量探索组1两次注射adscs 28d后真皮层厚度变化如图3所示,至adscs两次给药后28天,模型组的皮肤损伤出现较为明显的自愈现象,其脂肪层厚度与真皮层的纤维化程度,与对照组相比,差异不明显。与模型组相比,adscs低、中、高三个剂量组胶原纤维厚度均有下降趋势,脂肪层厚度均有增加,各剂量组炎症细胞浸润均不明显。
78.(3)剂量探索组1不同给药方案下,adscs对模型动物皮肤损伤的疗效分析adscs经不同方案给药后,均能够降低模型小鼠真皮层胶原纤维厚度,减轻纤维化程度。其中在单次给药后,adscs对皮肤胶原纤维厚度改善情况最佳,而重复给药或经尾静脉给药未见疗效优势。给药剂量方面,低、中剂量的治疗效果较好,低剂量5
×
105~1
×
106/只最好。
79.(4)剂量探索组2注射adscs 28天后真皮层厚度变化如图4、5所示,与模型组相比, adscs低、中、高剂量组胶原纤维厚度均显著性下降(p《0.01),三个剂量组之间无显著差异。注射adscs后,各治疗组脂肪层厚度均明显增加(p《0.05),且三个剂量组之间无显著差异。各剂量组均可见炎症细胞浸润。
80.(5)整体结论:博来霉素连续28天皮下注射,成功诱导了小鼠系统性皮肤纤维化的发生,以皮肤胶原纤维增厚、脂肪层变薄且被细胞外纤维化基质取代为主要特征。剂量探索组2皮下单次注射三个不同剂量(5
×
104, 1
×
105, 5
×
105/只)的adscs,对皮肤纤维化均有较为明显的
改善作用,均可以较为显著的降低皮肤胶原纤维厚度,增加脂肪层厚度。相比于剂量探索组1,降低adscs注射剂量后有效减轻了系统性硬化症模型小鼠的免疫排斥反应,取得了更加明确的治疗效果。
81.本发明验证了皮下单次注射adscs,注射剂量5
×
104~5
×
106cells/只,每只小鼠重约20
±
2g,可以较为显著的改善博来霉素诱导的小鼠皮肤纤维化中皮肤损伤,减轻真皮层纤维化程度,增加脂肪层厚度。
82.实施例4 动物实验免疫组化-评估相关指标通过对药效确证实验中小鼠皮肤组织进行免疫组织化学染色,评估人脂肪间充质干细胞(adipose tissue-derived stem cells, adscs)对博来霉素诱导系统性硬化症小鼠纤维化相关指标以及免疫相关指标的改善作用。动物实验材料分组同实施例3剂量探索组1,选取单次注射结果示例。
83.1、实验方法1.1脱蜡、水化(1)将切片放在65度孵箱中,烤15分钟;(2)将切片放入二甲苯中脱水,10分钟两次;(3)将切片放入100%乙醇中脱水,5分钟两次;(4)将切片放入95%乙醇中脱水,5分钟两次;(5)将切片放入85%乙醇中脱水,5分钟两次;(6)将切片放入75%乙醇中脱水,5分钟两次;(7)用pbs进行冲洗切片,三分钟三次(pbs溶液配制:nacl 16g,kcl 0.4 g,十二水合磷酸氢二钠 7.12g,磷酸二氢钾 0.54g,溶于2l的双蒸水中)。
84.1.2抗原修复暴露抗原决定簇(1)将切片放入柠檬酸钠缓冲溶液中(ph6.0)(柠檬酸钠缓冲液配制:二水合柠檬酸三钠 2.4g,一水合柠檬酸 0.4g在1l双蒸水中溶解),在微波炉里高火4分钟至沸腾后,再加热6分钟四次,每次间隔补足液体,防止干片。(2)将切片放在冷水浴中降温至室温。
85.1.3封闭内源性过氧化物酶将切片取出,周围水分滤纸吸干,在组织的中央滴加适量的过氧化物酶阻断剂,放入湿盒中,避光孵育10min。
86.1.4封闭非特异性蛋白(1)将切片用pbs溶液进行冲洗3分钟三次;(2)取出切片,周围水分用滤纸吸干,在组织的中央滴加200ul 左右5%bsa溶液(5g bsa 溶于100ml pbs中)放入湿盒中,进行封闭30min。
87.1.5孵育一抗用pbs 稍微将片子冲洗一下,周围水分用滤纸吸干,在组织的中央加入已经稀释好的一抗(抗体用1%的bsa 稀释),放入湿盒中,4度过夜。
88.1.6孵育二抗(1)将切片在37度复温;(2)用pbs进行冲洗5分钟三次;(3)加入反应增强液适量,孵育20min,然后用pbs进行冲洗3分钟三次;(4)加入二抗适量,孵育20min,然后用pbs进行冲洗3分钟三次。
89.1.7 dab 显色加入dab(1mldab底物液中加入一滴浓缩dab溶液),控制好显色时间,由显微镜下观察颜色控制时间。
90.1.8苏木素复染加一大滴苏木素染液,染色20s左右的时间,然后用自来水冲洗,再泡在pbs里,进行返蓝5min。
91.1.9脱水、封片(1)将切片放入85%乙醇中脱水,5分钟两次;(2)将切片放入95%乙醇中脱水,5分钟两次;(3)将切片放入100%乙醇中脱水,15分钟两次;(4)将切片放入二甲苯中脱水,5分钟两次;(5)将片子晾干,至没有气味;(6)封片:在片子的一边慢慢滴几滴中性树胶,缓慢盖上盖玻片,然后使其晾干。
92.1.10定量分析用显微镜玻片扫描仪(徕卡)进行全景扫描,使用image
‑ꢀ
pro
®ꢀ
plus 6.0 软件(media cybernetics公司,美国)进行分析。
93.2、统计学分析实验结果均以均值+标准差(x+sd)形式表示,两组之间的比较,采用student’s
ꢀ‑
test 检验进行分析,多组之间比较采用fisher lsd检验,并用spss16.0(ibm公司,美国)、graphpad prism 8.0.1(graphpad software公司,美国)统计分析软件。
94.3、实验结果(1)注射人脂肪间充质干细胞对皮肤cd31的影响cd31,又称血小板内皮细胞粘附分子1 (pecam-1),被认为是血管分化的敏感和特异性标志物,是一种由内皮细胞和多种造血细胞表达的细胞表面糖蛋白,免疫组化染色定位在胞膜上,对新生血管特异性着色,镜下可观察到棕黄色的血管圈。通过统计血管圈的数量可以明确人人脂肪间充质干细胞促血管新生能力。如图6所示,单次给药28天,模型组小鼠新生血管数量明显低于对照组,给药后各组新生血管数量均显著性升高,以低剂量效果最佳。
95.(2)注射人脂肪间充质干细胞对皮肤tgf-β1的影响tgf-β1是促进纤维化的关键细胞因子。如图7所示,单次给药28天时,模型组tgf-β1表达水平高于对照组,给药后各组tgf-β1表达水平均下降。
96.(3)注射adscs对i型胶原的影响i型胶原蛋白(collagen i)可聚集成纤维,形成皮肤和其他结缔组织的结构和机械支架,研究发现i型胶原和iii型胶原是导致系统性硬化症纤维化的主要成分,其含量是衡量系统性硬化症严重程度的重要指标。在免疫组化染色时,可观察到i型胶原弥漫分布于真皮层,棕黄色的颜色深度和面积可反映i型胶原的含量。我们通过相对积分光密度(sum/length)来综合评价i型胶原的表达情况。如图8所示,单次给药28天,模型组小鼠i型胶原表达水平明显高于对照组,给药后各组i型胶原表达水平均显著性降低。
97.(4)注射adscs对皮肤iii型胶原的影响iii型胶原蛋白(collagen iii)是一种由三条α1(iii)链组成的纤维形成型胶原蛋白,研究发现iii型胶原是导致系统性硬化症纤维化的主要成分之一,其含量是衡量系统性硬化症严重程度的重要指标。在免疫组化染色时,可观察到iii型胶原弥漫分布于真皮层,棕黄色的颜色深度和面积可反映iii型胶原的含量,我们通过相对积分光密度来衡量iii型胶原的表达量。我们研究结果表明,皮下注射adscs不同时间点模型组iii型胶原表达
水平均高于对照组,给药后各组iii型胶原表达水平均有一定程度下降。如图9所示,单次给药28天,模型组小鼠iii型胶原表达水平高于对照组,给药后各组iii型胶原表达水平均有一定程度的降低。
98.(5)小鼠i型胶原与iii型胶原比值的变化通过对不同给药剂量、不同给药方法、不同给药阶段小鼠i型胶原与iii型胶原的相对比例变化来分析小鼠皮肤纤维化程度,如图10所示。通过对比我们发现,与对照组相比,各个时间点的模型组小鼠i型胶原与iii型胶原表达的相对比例(col 1/col 3)有一定程度的升高,而在给药后col 1/col 3有一定程度的下降,在后期(给药28天后)各个剂量组表现出了比较明显的效果,说明人脂肪间充质干细胞治疗可以在一定程度上改善系统性硬化症模型小鼠皮肤纤维化状态。
99.(6)注射人脂肪间充质干细胞对皮肤α-sma的影响α-平滑肌肌动蛋白(α-sma)是一种主要存在于血管平滑肌细胞内的肌动蛋白亚型,在纤维形成中起着重要作用,它是肌成纤维细胞的特异性标志物,而肌成纤维细胞的激活在纤维化反应的发展中起着关键作用。免疫组化染色显示,α-sma位于肌成纤维细胞胞浆内,可使肌成纤维细胞呈棕黄色,我们通过统计α-sma+细胞数量来衡量小鼠皮肤纤维化程度。我们的研究结果表明,与对照组相比,系统性硬化症模型小鼠α-sma+细胞数量均增加,注射adscs的小鼠,部分组皮肤α-sma+细胞数量出现统计学差异。图11结果表明,单次给药28天后,与对照组相比,模型组α-sma+细胞数量显著升高(p《0.05),给药后低剂量可显著降低系统性硬化症模型小鼠α-sma的表达(p《0.05),其它剂量具有减轻α-sma+细胞数量的趋势。
100.(7)注射人脂肪间充质干细胞对皮肤tnf-α的影响tnf-α即肿瘤坏死因子α,是一种多效性的系统性炎症反应介质。tnf-α属于促炎细胞因子,参与免疫炎症反应,主要由巨噬细胞产生,单核细胞、嗜酸性细胞、成纤维细胞以及上皮细胞等也能分泌tnf-α。在系统性硬化症模型小鼠皮肤中,tnf-α主要由m1型巨噬细胞分泌,免疫组化染色成棕黄色弥散性点状分布。我们通过单位长度皮肤阳性区域面积(阳性区域面积/皮肤长度)来衡量tnf-α的表达强度。我们的免疫组化结果表明,皮下注射低、中、高三个剂量adscs均能显著降低模型小鼠皮肤中tnf-α的表达,尾静脉给药组也可以显著降低tnf-α的表达水平。图12表明,单次给药28天后,模型组tnf-α的表达量明显高于对照组,三个剂量adscs给药组tnf-α表达水平均明显低于模型组(p《0.01或p《0.05),尾静脉组也有明显效果(p《0.01)。(*,#表示p《0.05,**,##表示p《0.01,*表示与对照组相比,#表示与模型组相比)。
101.(8)注射人脂肪间充质干细胞对皮肤il-17的影响il-17是一种促炎细胞因子,是由炎症条件下活化的cd4+ t细胞亚群产生的,参与系统性硬化症的发病过程。免疫组化染色il-17呈点状分布,我们通过计算il-17+细胞的数量来衡量il-17的表达情况,来反映模型小鼠的炎症和免疫状态。我们的免疫组化结果表明,单次注射adscs不同时间点模型组il-17+细胞数量均显著高于对照组,低、中、高三个剂量adscs给药后il-17+细胞数量均有显著性下降。图13结果显示,单次给药28天后,模型组小鼠il-17+细胞数量明显高于对照组(p《0.01),三个不同剂量adscs给药后各组il-17+细胞数量均显著性降低,中剂量最佳(p《0.01),低剂量、高剂量皮下注射与尾静脉注射也都有
明显效果(p《0.05)。
102.实施例5 体内示踪动物种属及建模过程同上,分组试验共分成3组动物,共10只,空白对照组1只健康小鼠,不做任何处理;正常对照组3只健康未建模小鼠,皮下注射膜染料标记的adscs(1
×
105个/只);实验组6只博来霉素诱导建模小鼠,皮下注射膜染料标记的adscs(1
×
105个/只)。在注射后的2天、7天、14天、 28天(视荧光消失情况而定,后续每7天拍照一次)通过小动物活体成像观察脂肪间充质干细胞在 c57小鼠体内的存留及分布情况。
103.实验结果显示,小鼠在皮下注射adscs后药物的体内分布和代谢情况,发现adscs主要聚集在受损的皮肤注射局部,部分干细胞也可通过血液循环到达肺等血流供应比较丰富的部位。提示adscs经局部皮肤给药后,可随血液循环分布,发挥一定全身治疗作用。小鼠注射荧光标记adscs后体内相对荧光强度变化图如图14所示。部分小鼠在46d仍可观察到较少量adscs。可见,adscs在体内存留时间较长,半衰期长,发挥药效的时间长,有助于提高用药的疗效。
104.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1