一种药物组合物及其应用以及一种治疗前列腺癌的组合物及其应用
1.本发明属于肿瘤治疗技术领域,特别是涉及一种药物组合物及其应用以及一种治疗前列腺癌的组合物及其应用。
背景技术:
2.前列腺癌(prostate cancer,pc)是美国男性癌症相关死亡的第二大原因,到2021年,新发的pc病例估计超过24万例,超过34000名男性将死于这种疾病。尽管新治疗方法(包括化疗[多西他赛和卡巴他赛],免疫疗法[sipuleucel-t]、骨靶向疗法[镭-233二氯化物]和新型激素疗法[醋酸阿比特龙、恩扎鲁胺、阿帕鲁胺和达鲁鲁胺])的发展使转移性趋势抵抗型前列腺癌(metastatic castration-resistant prostate cancer,mcrpc)患者的总生存率(os)得到了改善,但这并不意味着这些患者的生活质量得到了提高,大多数mcrpc患者最终会死于前列腺癌进展,所以仍需要寻求更好的药物来治疗mcrpc。
[0003]
自2004年以来,多西他赛已成为治疗mcrpc的标准一线化疗。多西他赛的细胞毒性作用主要是通过阻滞细胞于g2和m期从而抑制癌细胞的有丝分裂和增殖来发挥抗肿瘤作用的。然而,许多肿瘤对其没有反应,并且由于恶性肿瘤具有无限增殖、浸润转移、代谢异常、免疫逃逸等特性使得长期暴露于化疗药物所致应激环境中的肿瘤细胞逐渐诱导自噬而产生耐药,导致大多数患者会产生耐药性,使其治疗效果欠佳。即使在有肿瘤反应的患者中,药物相关的不良反应也是常见的,这最终导致了多西他赛治疗在给药剂量和持续时间上受到限制,而瘤内多西他赛浓度不足可能是治疗结果降低的原因之一。另有研究显示,多西他赛治疗周期的延长(8个或更多或6个周期)与前列腺癌患者的优越生存率相关。
技术实现要素:
[0004]
针对以上技术问题,本发明提供一种药物组合物及其应用以及一种治疗前列腺癌的组合物及其应用。该药物组合物能够抑制癌细胞增殖和化疗药物诱导的自噬,减少化疗药物的耐药,从而提高疗效、降低给药剂量,减轻化疗带来的副作用。
[0005]
为达到上述发明目的,本发明实施例采用了如下的技术方案:
[0006]
一方面,本发明提供一种药物组合物,包括可溶性铜盐和铜离子载体,所述铜离子载体为伊利司莫和双硫仑中的至少一种。
[0007]
铜为必须酶的辅助因子,但细胞内的稳态机制会使铜浓度保持在非常低的水平,以防止游离铜的积累对细胞造成伤害。伊利司莫(elesclomol,es)和双硫仑(disulfiram)是能够与铜离子结合的高亲脂性小分子,在哺乳动物细胞系中铜运输缺陷的情况下能够将铜跨膜传递给关键的酶从而恢复线粒体功能,铜与三羧酸(tca)循环中脂酰化成分的直接结合导致脂酰化蛋白聚集和随后的铁硫簇蛋白丢失,从而导致蛋白质毒性应激和最终的细胞死亡。本发明经试验研究证实,该药物组合物能够抑制癌细胞增殖,缩小实体瘤体积。
[0008]
本发明在研究中还意外发现,在使用化疗药物多西他赛的基础上联合应用可溶性
铜盐与铜离子载体伊利司莫组成的药物组合物能够对前列腺癌细胞增殖和克隆形成产生明显的抑制作用,并能增强各自原有的抗前列腺肿瘤活性,二者在特定的药物浓度下表现出明显的协同效应,这使得多西他赛的疗效能够得以大大增强。并且经试验研究发现,该药物组合物能够抑制化疗药物多西他赛诱导的自噬,从而改善多西他赛的耐药,使多西他赛能够在降低给药剂量的情况下依然产生理想的疗效,从而能够降低多西他赛的药物用量,减轻化疗带来的副作用。并且该药物组合物并不会明显增加不良反应,在与多西他赛联合应用时,在提高多西他赛疗效的同时也不会明显地增加不良反应。目前,可溶性铜盐和铜离子载体的组合物与多西他赛等化疗药物联合应用的治疗方法未见报道,将可溶性铜盐和铜离子载体的组合物用于抑制化疗药物诱导的自噬以改善化疗药物不耐受也未见报道。
[0009]
本发明为前列腺癌的治疗提供了新的联合用药方案,该方案能够提高疗效,并能大大降低化疗药物的剂量,减轻患者的不良反应。
[0010]
结合第一方面,所述可溶性铜盐为氯化铜和硫酸铜中的至少一种。
[0011]
可选地,所述可溶性铜盐为氯化铜,所述离子载体为伊利司莫。
[0012]
优选地,所述氯化铜和伊利司莫的摩尔比为0.8~1.2:1。
[0013]
优选地,所述氯化铜和伊利司莫的摩尔比为1:1。
[0014]
第二方面,本发明还提供了上述药物组合物在制备治疗前列腺癌的药物中的应用。
[0015]
第三方面,本发明还提供了上述药物组合物在制备抑制化疗药物诱导的细胞自噬的药物中的应用。该药物组合物能够抑制化疗药物诱导的自噬,进而可改善化疗药物的耐药,使得化疗药物在降低给药剂量的情况下也能产生理想的疗效,从而能够实现化疗药物用量的降低,减轻化疗带来的副作用。
[0016]
结合第三方面,所述化疗药物为多西他赛。
[0017]
第四方面,本发明还提供了一种治疗前列腺癌的组合物,包括多西他赛和上述药物组合物。
[0018]
本发明通过研究发现,上述药物组合物与多西他赛联合应用可以明显增强各自原有的抗前列腺肿瘤活性,二者在特定药物浓度下联合应用表现出明显的协同效应;并且,上述药物组合物能够抑制多西他赛诱导的自噬,从而改善多西他赛的耐药,使得多西他赛在降低给药剂量的情况下也能产生理想的疗效。该组合物为癌症患者提供了一种新型高效的联合治疗方案,既缓解了多西他赛的副作用影响,又提高了抗肿瘤疗效,从而能够改善癌症患者的预后,提高患者生活质量。
[0019]
优选地,所述多西他赛和所述药物组合物的摩尔比为1~8:40。
[0020]
优选地,所述多西他赛和所述药物组合物的摩尔比为1~2:40。在该摩尔比下二者的协同作用更为显著。
[0021]
进一步优选地,所述多西他赛和所述药物组合物的摩尔比为1:40。在该摩尔比下二者的协同作用最为显著。
[0022]
第五方面,本发明实施例还提供了上述组合物在制备治疗前列腺癌的药物中的应用。
[0023]
优选地,所述药物为注射剂,包括注射液、注射用冻干粉针等。
[0024]
将本发明所提供的组合物制成注射剂后,通过注射的给药方式即可发挥治疗前列
腺癌的作用。
附图说明
[0025]
图1为实施例19中加入不同浓度氯化铜-伊利司莫组合物后的细胞活力;
[0026]
图2为实施例19中加入不同浓度多西他赛以及加入多西他赛与氯化铜-伊利司莫组合物后的细胞活力;
[0027]
图3为实施例19中加入1nm多西他赛和/或20nm氯化铜-伊利司莫组合物后的细胞活力;
[0028]
图4为实施例20中氯化铜-伊利司莫组合物及其与多西他赛联合应用对pc3细胞克隆生长的影响;
[0029]
图5为实施例21中氯化铜-伊利司莫组合物及其与多西他赛联合应用对小鼠肿瘤体积的影响;
[0030]
图6为实施例21中氯化铜-伊利司莫组合物及其与多西他赛联合应用对小鼠肿瘤重量的影响;
[0031]
图7为实施例21中氯化铜-伊利司莫组合物及其与多西他赛联合应用对小鼠体重的影响;
[0032]
图8为实施例21中氯化铜-伊利司莫组合物及其与多西他赛联合应用对小鼠谷丙转氨酶(alt)的影响;
[0033]
图9为实施例21中氯化铜-伊利司莫组合物及其与多西他赛联合应用对小鼠谷草转氨酶(ast)的影响;
[0034]
图10为实施例21中氯化铜-伊利司莫组合物及其与多西他赛联合应用对小鼠肌酐的影响;
[0035]
图11为实施例21中氯化铜-伊利司莫组合物及其与多西他赛联合应用对小鼠尿素氮(bun)的影响;
[0036]
图12为实施例21中氯化铜-伊利司莫组合物及其与多西他赛联合应用对小鼠白细胞(wbc)的影响;
[0037]
图13为实施例22中western blot验证氯化铜-伊利司莫组合物及其与多西他赛联合应用后自噬标志蛋白lc3水平的变化。
具体实施方式
[0038]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本发明进行进一步举例说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
[0039]
以下实施例中所采用的原料、试剂等,如无特殊说明,均从商业途径获得。
[0040]
实施例1
[0041]
本发明实施例提供了一种药物组合物,由氯化铜和伊利司莫组成,氯化铜和伊利司莫的摩尔比1:1。
[0042]
实施例2
[0043]
本发明实施例提供了一种药物组合物,由氯化铜和伊利司莫组成,氯化铜和伊利
司莫的摩尔比0.8:1。
[0044]
实施例3
[0045]
本发明实施例提供了一种药物组合物,由氯化铜和伊利司莫组成,氯化铜和伊利司莫的摩尔比1.2:1。
[0046]
实施例4
[0047]
本发明实施例提供了一种药物组合物,由硫酸铜和伊利司莫组成,硫酸铜和伊利司莫的摩尔比1:1。
[0048]
实施例5
[0049]
本发明实施例提供了一种药物组合物,由硫酸铜和双硫仑组成,硫酸铜和双硫仑的摩尔比1:1。
[0050]
实施例6
[0051]
本发明实施例提供了一种药物组合物,由氯化铜和双硫仑组成,氯化铜和双硫仑的摩尔比1:1。
[0052]
实施例7
[0053]
本发明实施例提供了一种药物组合物,由氯化铜、硫酸铜和伊利司莫组成,氯化铜、硫酸铜和伊利司莫的摩尔比1:1:2。
[0054]
实施例8
[0055]
本发明实施例提供了一种药物组合物,由氯化铜、硫酸铜、伊利司莫和双硫仑组成,氯化铜、硫酸铜、伊利司莫和双硫仑的摩尔比1:1:1:1。
[0056]
实施例9
[0057]
本发明实施例提供了一种治疗前列腺癌的组合物,由多西他赛、氯化铜和伊利司莫组成,多西他赛、氯化铜和伊利司莫的摩尔比为1:20:20。
[0058]
实施例10
[0059]
本发明实施例提供了一种治疗前列腺癌的组合物,由多西他赛、氯化铜和伊利司莫组成,多西他赛、氯化铜和伊利司莫的摩尔比为1:10:10。
[0060]
实施例11
[0061]
本发明实施例提供了一种治疗前列腺癌的组合物,由多西他赛、氯化铜和伊利司莫组成,多西他赛、氯化铜和伊利司莫的摩尔比为1:5:5。
[0062]
实施例12
[0063]
本发明实施例提供了一种治疗前列腺癌的组合物,由多西他赛、氯化铜和伊利司莫组成,多西他赛、氯化铜和伊利司莫的摩尔比为2:5:5。
[0064]
实施例13
[0065]
本发明实施例提供了实施例1的药物组合物在制备治疗前列腺癌的注射剂中的应用,具体方法为:将实施例1的药物组合物根据所需剂型与药学上可接受的注射剂辅料按常规方法制成注射液或注射用冻干粉针,即得。
[0066]
该方法也可用于实施例2~8任一实施例的药物组合物。
[0067]
实施例14
[0068]
本发明实施例提供了一种治疗前列腺癌的注射液,包括实施例1~8中任一实施例的药物组合物以及药学可接受的注射液辅料。
[0069]
实施例15
[0070]
本发明实施例提供了一种治疗前列腺癌的注射用冻干粉针,包括实施例1~8中任一实施例的药物组合物以及药学可接受的注射用冻干粉针辅料。
[0071]
实施例16
[0072]
本发明实施例提供了实施例9的组合物在制备治疗前列腺癌的注射剂中的应用,具体方法为:将实施例9的组合物根据所需剂型与药学上可接受的注射剂辅料按常规方法制成注射液或注射用冻干粉针,即得。
[0073]
该方法也可用于实施例10~12所得药物组合物。
[0074]
实施例17
[0075]
本发明实施例提供了一种治疗前列腺癌的注射液,包括实施例9~12中任一实施例的组合物以及药学可接受的注射液辅料。
[0076]
实施例18
[0077]
本发明实施例提供了一种治疗前列腺癌的注射用冻干粉针,包括实施例9~12中任一实施例的组合物以及药学可接受的注射用冻干粉针辅料。
[0078]
实施例19
[0079]
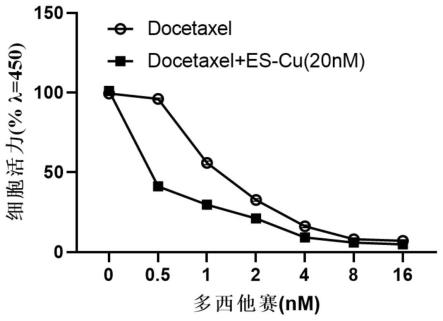
本发明实施例提供了实施例1的药物组合物(下称氯化铜-伊利司莫组合物)及其与多西他赛联用时对前列腺癌pc3细胞增殖的抑制效果。
[0080]
用常规的含10%胎牛血清+1%青/链霉素的1640培养基制备前列腺癌pc3细胞悬液,计数后接种于96孔板中,每孔约100μl(4000个细胞),同样的样本做4个重复。
[0081]
将接种有前列腺癌pc3细胞悬液的96孔板放入培养箱中预培养(37℃,5%co2),细胞贴壁生长后继续孵育,待细胞数量呈指数增长时,随机分为对照组以及多个给药组,对照组加入含10%胎牛血清+1%青/链霉素的1640培养基,各给药组分别加入等体积、预设浓度的多西他赛和/或实施例1的氯化铜-伊利司莫组合物(es-cu)溶液。加药后培养48小时,然后向各孔加入100μl含10%cck-8的培养基,放入培养箱中孵育4h,之后酶标仪测定450nm处的吸光值(od)。
[0082]
利用吸光度计算加入不同浓度实施例1的氯化铜-伊利司莫组合物后的细胞活力,结果如图1和表1所示,加入不同浓度多西他赛以及同时加入不同浓度多西他赛与20mm氯化铜-伊利司莫组合物后的细胞活力如表2、表3和图2所示。
[0083]
表1加入不同浓度氯化铜-伊利司莫组合物后的细胞活力
[0084][0085]
表2加入不同浓度多西他赛后的细胞活力
[0086]
多西他赛终浓度(nm)00.5124816细胞活力(%)99.596.056.032.716.18.17.1
[0087]
表3加入不同浓度多西他赛与氯化铜-伊利司莫组合物后的细胞活力
[0088][0089]
由表1~表3以及图1、图2可见,当多西他赛终浓度为0.5nm时,细胞活力为96.0%,与对照组相比无明显下降,当浓度提高后细胞活力随之下降。该结果与公认的多西他赛浓度与其治疗效果的相关度基本一致。而在该浓度下同时加入终浓度为20nm氯化铜-伊利司莫组合物后,细胞活力大幅度下降至41.2%,且此时细胞活力远远低于只添加20μm/l氯化铜-伊利司莫组合物时的细胞活力(约65%),说明氯化铜-伊利司莫组合物与多西他赛在该浓度下对于抑制前列腺癌细胞增殖具有协同作用。
[0090]
同理,当多西他赛终浓度为1nm~4nm时,单用多西他赛可分别使细胞活力下降至56.0%、32.7%、16.1%,当同时加入终浓度为20nm氯化铜-伊利司莫组合物后,理论上细胞活力应再下降为原值的65%,即分别降至36.4%、21.3%、10.5%,而实际上细胞活力下降至29.7%、21.1%、9.2%,可见氯化铜-伊利司莫组合物与多西他赛在上述浓度下对于抑制前列腺癌细胞增殖也具有协同作用。当多西他赛终浓度为8~16nm时,对于抑制前列腺癌细胞增殖未显示出明显的协同作用。
[0091]
选择多西他赛为1nm的浓度对上述结果进行验证:将接种有前列腺癌pc3细胞悬液的96孔板放入培养箱中预培养(37℃,5%co2),细胞贴壁生长后继续孵育,待细胞数量呈指数增长时,随机分为对照组以及多个给药组,对照组加入含10%胎牛血清+1%青/链霉素的1640培养基,各给药组分别加入等体积、预设浓度的多西他赛和/或实施例1的氯化铜-伊利司莫组合物溶液。加药后培养48小时,然后向各孔加入100μl含10%cck-8的培养基,放入培养箱中孵育1h,之后酶标仪测定450nm处的吸光值(od)。
[0092]
利用吸光度计算加入不同浓度实施例1的氯化铜-伊利司莫组合物后的细胞活力,结果如图3和表4所示,加入不同浓度多西他赛以及同时加入不同浓度多西他赛与20mm氯化铜-伊利司莫组合物后的细胞活力如表2、表3和图2所示。
[0093]
表4加入多西他赛和/或氯化铜-伊利司莫组合物后的细胞活力
[0094][0095]
由表4和图3可见,当多西他赛终浓度为1nm时,单用多西他赛可使细胞活力下降至59.7%,当同时加入终浓度为20nm氯化铜-伊利司莫组合物后,理论上细胞活力应再下降为原值的62.3%,即降至37.2%,而实际上细胞活力下降至34.3%,可见氯化铜-伊利司莫组合物与多西他赛在上述浓度下对于抑制前列腺癌细胞增殖确实具有协同作用。
[0096]
实施例20
[0097]
本发明实施例提供了实施例1的药物组合物(下称氯化铜-伊利司莫组合物)及其
与多西他赛联合应用对前列腺癌pc3细胞克隆形成的抑制效果。
[0098]
用常规的含10%胎牛血清+1%青/链霉素的1640培养基中制备前列腺癌pc3细胞悬液,以500个/孔的密度接种于6孔板中,细胞贴壁后培养48小时(细胞数量呈指数增长),然后更换新鲜的含10%胎牛血清+1%青/链霉素的1640培养基,分别加入培养基或预设浓度的多西他赛和/或实施例1的氯化铜-伊利司莫组合物,处理10天。吸取培养基后加入1ml 4%的多聚甲醛固定10min,吸去废液后用pbs洗涤2遍,然后每孔加入1ml的结晶紫染色10min,之后用自来水清洗直至无任何染色,放入65℃烘箱烘干后克隆计数。各样品的药物浓度如表5所示。
[0099]
表5各样品中的药物及其浓度
[0100][0101]
结果如图4所示,氯化铜-伊利司莫组合物和多西他赛联合应用10天显著减少了集落数量,说明氯化铜-伊利司莫组合物和多西他赛联合应用显著抑制了前列腺癌pc3细胞克隆形成。
[0102]
实施例21
[0103]
本发明实施例提供了实施例1的药物组合物(下称氯化铜-伊利司莫组合物)及其与多西他赛联合应用对体内肿瘤生长的抑制效果。
[0104]
首先选用6~8周龄雄性c57bl/6小鼠,于前肢肋腹部皮下注射2
×
106个rm-1小鼠前列腺癌细胞构建小鼠荷瘤模型,然后随机分为对照组、氯化铜-伊利司莫组合物治疗组、多西他赛治疗组和联合治疗组。氯化铜-伊利司莫组合物治疗组按氯化铜0.5mg/kg、伊利司莫1.5mg/kg的给药剂量腹腔注射,多西他赛治疗组按多西他赛2mg/kg的给药剂量腹腔注射,联合治疗组按氯化铜0.5mg/kg、伊利司莫1.5mg/kg、多西他赛2mg/kg的给药剂量腹腔注射,对照组注射生理盐水,各组给药体积均为100μl。各组均于荷瘤后第4天开始腹腔注射,每3天注射一次。每三天测量小鼠一次体重和肿瘤体积。共注射药物6次,最后一次给药24h后测量小鼠肝肾功能和血常规,处死小鼠,取下肿瘤称重。各组小鼠肿瘤体积变化如表6和图5所示,肿瘤重量如表7和图6所示。
[0105]
表6各组小鼠肿瘤体积(mm3)
[0106][0107]
表7各组小鼠肿瘤重量(g)
[0108][0109]
结果发现单纯氯化铜-伊利司莫组合物或者多西他赛治疗组,肿瘤体积均较对照组缩小,而联合治疗组肿瘤体积明显减小,说明氯化铜-伊利司莫组合物和多西他赛联合治疗后明显提高了二者的肿瘤抑制作用。
[0110]
各组小鼠体重如表8和图7所示,肝肾功能和血常规结果如图8~12所示。
[0111]
表8各组小鼠体重(g)
[0112][0113]
由表8和图7~12的结果可见,氯化铜-伊利司莫组合物并不会明显增加机体的不良反应,与多西他赛联用后也不会明显增加机体的不良反应。
[0114]
实施例22
[0115]
本发明实施例提供了实施例1的药物组合物(下称氯化铜-伊利司莫组合物)及其与多西他赛联合应用在通过抑制多西他赛诱导的自噬从而改善多西他赛的耐药的效果。
[0116]
本实验通过western blot验证了自噬标志蛋白lc3水平的变化,实验所用培养基为含10%胎牛血清+1%青/链霉素的1640培养基。实验具体步骤为:
[0117]
pc-3细胞接种到25cm2细胞培养瓶4瓶,在保持恒温37℃、5%含量的co2的培养箱中培养,待细胞贴壁生长至60%-70%密度,随机分为对照组、氯化铜-伊利司莫组合物组、多西他赛组,联合用药组,常规更换培养基,氯化铜-伊利司莫组合物组将氯化铜-伊利司莫组合物按20nm的终浓度加入细胞培养瓶,多西他赛组将多西他赛按1nm的终浓度加入细胞
培养瓶,联合用药组按氯化铜-伊利司莫组合物20nm、多西他赛1nm的终浓度将氯化铜-伊利司莫组合物和多西他赛加入细胞培养瓶,继续孵育48小时后提取细胞总蛋白。各组取等质量的蛋白提取液,用ripa裂解液补齐体积,与5xloading buffer混合均匀,沸水浴5min使蛋白变性。配制5%的浓缩胶和不同浓度的分离胶。将等质量的各组样品及ladder marker分别加入凝胶的上样孔内,开始电泳并半干转膜,5%脱脂奶粉封闭2小时,一抗结合过夜后封闭二抗2小时后利用化学发光仪自动曝光检测抗体特异性结合条带。结果如图13所示,氯化铜-伊利司莫组合物能够抑制多西他赛诱导的自噬,从而改善多西他赛的耐药。
[0118]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1