一种尼可地尔缓释制剂及其制备方法与流程
1.本发明涉及药物技术领域,具体涉及一种尼可地尔缓释制剂及其制备方法。
背景技术:
2.尼可地尔是日本研制的新一类抗心绞痛药物,具有双重抗心绞痛机制:硝酸酯类作用是扩张静脉和心外膜冠状动脉,以及开放k+-atp通道引起外周动脉和冠状动脉阻力血管扩张。其药理作用是降低心脏前后负荷,增加冠状动脉血流,改善冠状循环,并防止冠状动脉痉挛。扩张全身阻力和容量血管,降低心脏前后负荷和心肌耗氧量;此外,还能解除冠状动脉痉挛,增加侧支循环及心内膜下供血。因此,尼可地尔降低心肌耗氧量的同时增加心肌供氧,双重改善心肌缺血。
3.国内市售片剂为普通制剂,规格为每片5 mg,口服1片/次,3次/d。该药半衰期较短(约为1 h),为了减少给药次数,增加患者的依从性,达到缓慢释放药物,使其更好地发挥药效,减少体内血药浓度的“峰-谷”波动,减轻不良反应,研究开发尼可地尔的缓释制剂具有强烈的临床需求。
4.徐斌【尼可地尔缓释骨架片的制备[j]. 中南药学 2015年3月 第13卷 第3期】报道了一种尼可地尔的骨架缓释制剂,以尼可地尔与胶态二氧化硅先行混合后,再与60%的缓释材料hpmc k100m,填充剂磷酸氢钙等混合,用10%pvp的乙醇溶液为黏合剂,进行湿法制粒压片,虽然能实现药物24 h内缓慢释放,使用了60% 的hpmc k100m骨架材料,载药量仅为3.75%,且制备工艺较复杂不适合产业化生产,该缓释制剂的制造成本较高;由于尼可地尔遇水容易降解,采用湿法制粒所制备的尼可地尔缓释片不稳定。
[0005]
罗平【尼可地尔缓释片制备工艺及其体内外释药研究[s]. 湖北中医药大学. 2015年】报道了一种尼可地尔缓释片的制剂处方:hpmc k4m用量为37.5%,乙基纤维素ec为22.5%,微晶纤维素mcc为20%,乳糖为15%,粉末直接压片,缓释骨架材料hpmc k4m和ec合计用量达到了60%,而载药量仅为2.5%,该缓释制剂的制造成本仍然较高;采用粉末直接压片很容易导致活性成分的含量不均匀,且尼可地尔规格仅10mg/片,更容易出现尼可地尔含量不均匀的问题。
[0006]
目前报道的尼可地尔缓释制剂的均使用了高达60%的骨架缓释材料导致生产制造成本明显较高,采用湿法制粒容易导致尼可地尔降解,采用粉末直接压片由于尼可地尔成分仅占片剂的2.5%必然会导致尼可地尔含量不均匀的问题,目前研究报道的技术方案均不适用于工业大生产,亟需研究开发一种能适应于工业化大生产的尼可地尔缓释制剂的制备方法。
技术实现要素:
[0007]
针对现有技术的不足,本发明的目的在于提供一种使用骨架缓释材料占比更少的、载药量相对更高、尼可地尔含量更均匀且稳定性更好的、适合工业化大生产的尼可地尔缓释制剂。
[0008]
为了解决上述技术问题,本发明采用如下技术方案:提供一种尼可地尔的缓释制剂,包含尼可地尔、缓释材料、填充剂、润滑剂。
[0009]
本发明的缓释材料选自羟丙甲纤维素k4m cr和羟丙甲纤维素k100 lv的组合,且尼可地尔与羟丙甲纤维素k4m cr和羟丙甲纤维素k100 lv的质量比为15:13~18:18~25。
[0010]
本发明的填充剂选自乳糖,所述尼可地尔与填充剂的质量比为15:30~55。
[0011]
本发明的润滑剂选自硬脂酸或其药学上可接受的盐,所述尼可地尔与润滑剂的质量比为15:0.3~1.0。
[0012]
进一步地,所述的润滑剂为硬脂酸镁,尼可地尔与硬脂酸镁的质量比为15:0.5。
[0013]
本发明提供一种制备尼可地尔缓释制剂的方法,包括以下步骤:a)预混:按处方量称量填充剂、尼可地尔、缓释材料,依次加入设备混合均匀;b)干法制粒:混匀物料置于干法制粒机中制粒;c)总混:加入处方比例的硬脂酸镁进行混合,得总混颗粒;d)压片:总混颗粒进行压片即得。
[0014]
本发明所述的尼可地尔缓释制剂为24小时缓慢释放药物,在中国药典方法(2020年版四部通则0931第二法,50rpm,ph6.8溶出介质)条件下,所述的尼可地尔缓释制剂的累计溶出率同时满足以下三个特征:a)在1小时内溶出不超过20%的尼可地尔活性成分;b)在6小时内溶出40%~55%的尼可地尔活性成分;c)在24小时内溶出不低于90%的尼可地尔活性成分。
[0015]
与现有技术相比,本发明具有以下有益效果:本发明的缓释制剂可以实现24小时缓慢释放,且所用的骨架缓释材料的量仅占片剂重量的35%(w/w),载药量达到15%,并且制备工序简单,含量均匀度更好,质量稳定,生产成本明显较低,可以有效解决现有技术中使用高达60%的缓释材料的高成本问题,更适合工业化大生产。
附图说明
[0016]
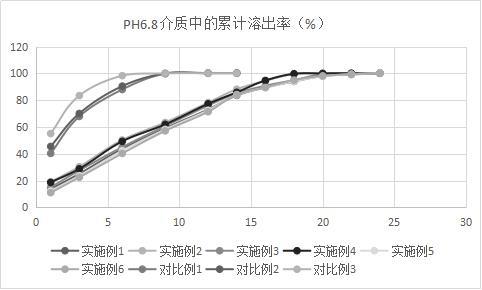
图1为ph6.8介质中尼可地尔缓释片的累计溶出曲线图(溶出率%,n=6)。
具体实施方式
[0017]
通用制备例:(1)预混:按处方量称量乳糖、尼可地尔、羟丙甲纤维素k4m cr、羟丙甲纤维素k100 lv,乳糖过80目筛(筛网孔径0.18mm),尼可地尔原料药粒径d90小于50μm,置于三维混合机混匀12min。
[0018]
(2)干法制粒:混匀物料置于干法制粒机中制粒,制粒参数: 水平进料速度10rpm/min、垂直进料速度400rpm/min、压轮压力12 kn/cm、压轮间隙1.6mm、压轮转速3rpm/min、整粒转速100rpm/min、整粒筛网孔径0.8mm。
[0019]
(3)总混:按处方比例加入硬脂酸镁,置于三维混合机混匀10min。
[0020]
(4)压片:压片机压片,调整片重:100mg,片剂硬度控制在3~6kg。
[0021]
以上制备工序,还可根据需要进行尼可地尔缓释片的薄膜包衣或其他包衣,目的是保护药片。
[0022]
实施例1:处方配比(15mg规格):物料名称作用处方/mg质量占比/%试制1000片/g尼可地尔活性成分1515.015羟丙甲纤维素k4mcr缓释材料1515.015羟丙甲纤维素k100lv缓释材料2020.020乳糖填充剂49.549.549.5硬脂酸镁润滑剂0.50.50.5片重/100//制备方法:参照通用制备例进行预混、干法制粒、总混、压片等工序制备尼可地尔缓释片。
[0023]
所制备的尼可地尔缓释片,骨架缓释材料羟丙甲纤维素(hpmc)k4m cr和hpmc k100 lv共占35%,尼可地尔的载药量为15%,制备工序简单,顺应性好。
[0024]
实施例2-6和对比例1-3:处方配比(试制1000片,单位g),如下:
物料名称实施例2实施例3实施例4实施例5实施例6对比例1对比例2对比例3尼可地尔1515151515151510hpmck4mcr1313151818/6035hpmck100lv202218222560//乙基纤维素///////20微晶纤维素///////19.5乳糖51.549.551.544.541.524.524.515硬脂酸镁0.50.50.50.50.50.50.50.5
制备方法:实施例2-6和对比例1-2参照通用制备例进行预混、干法制粒、总混、压片等工序制备尼可地尔缓释片;对比例3为更换hpmc k100 lv为乙基纤维素(ec)同时添加微晶纤维素,采用常规的粉末直接压片法进行制备。
[0025]
试验1:尼可地尔缓释片在ph6.8介质中的累计溶出率(%)试验参照《中国药典》2020年版四部通则0931 溶出度与释放度测定法第二法桨法,50rpm,ph6.8的溶出介质,介质温度37℃,取样时间点和累计溶出率的数据见下表:
取样点(h)136912141618202224实施例113.725.143.75973.183.689.69498.199.2100.1实施例21930.450.363.478.288.294.599.5100100.2100.3实施例31527.64560.77685.290.89599.499.9100.1实施例418.728.849.36277.385.994.799.7100100.1100.2实施例512.223.642.358.272.58489.394.197.899.4100.3实施例61122.540.357.171.484.289.59598.199.4100.2对比例140.367.98899.8100.1100.1/////对比例245.570.190.5100100.3100.3/////对比例355.183.498.3100100.2100.2/////
由于药物在胃里停留约2小时,本试验直接采用ph6.8的溶出介质作为制剂研究中
有区分力的溶出介质进行试验,结果见图1。从上表实施例1-6和对比例1-3的溶出数据可以看出,hpmc k4m cr和hpmc k100 lv是影响尼可地尔溶出的关键因素,然而并非骨架材料使用量越多越能够起到缓释效果,数据显示:hpmc k4m cr和hpmc k100 lv的合用明显优于单用,也明显优于hpmc k4m与ec的合用。尼可地尔与hpmc k4m cr和hpmc k100 lv的质量比为15:(13~18):(18~25)时,所制得的尼可地尔缓释制剂可以保持24小时内平稳释放,其中1小时内释放不超过20%,3小时释放20~35%,6小时释放40~55%,9小时释放55~65%,12小时释放70~80%,18-24小时释放大于90%。此外,从实施例5-6与实施例1的对比发现,增加hpmc k4m cr和hpmc k100 lv的量并不能显著影响尼可地尔的缓释作用,为了节约生产成本,尼可地尔与hpmc k4m cr和hpmc k100 lv的最优质量比为15:15:20。
[0026]
试验2:含量均匀度测试按照《中国药典》2020年版四部通则0941 含量均匀度检查法,取实施例1-6和对比例1-3所制备的尼可地尔缓释片各10片进行含量均匀度测定,计算a+2.2s值,见下表:
序号实施例1实施例2实施例3实施例4实施例5实施例6对比例1对比例2对比例3平均值(%)100.10100.0899.87100.02100.2199.95100.45100.24102.01a+2.2s5.36.25.85.75.56.17.87.013.8
从上表数据看出,实施例1-6和对比例1-2采用干法制粒制备的尼可地尔缓释片的含量均匀度a+2.2s的值明显小于对比例3所述的粉末直接压片制备的尼可地尔缓释片,说明干法制粒制备的尼可地尔缓释制剂的含量均匀性相比粉末直接压片更好。从10片药片的含量测定的平均值也看出,对比例3的平均值为102.01%,较明显地偏移投药量2个百分点,说明对比例3采用的粉末直接压片制备的尼可地尔缓释制剂含量容易出现偏差、不够均匀,不适合进入工业化大生产。
[0027]
进一步地分析,实施例1-6的a+2.2s数值略比对比例1-2要低,也就是对比例1-2的含量均匀性相对于实施例1-6略差,说明缓释材料用量较大时会存在混合不够均匀的一些不足。
[0028]
试验3:填充剂的筛选参照实施例1的处方配比,填充剂为乳糖,或微晶纤维素,或乳糖和微晶纤维素的组合(质量比为3:4)。考察制备尼可地尔缓释片的工艺顺应性、尼可地尔缓释片在ph6.8介质中的溶出情况、加速试验中有关物质变化情况。
[0029]
试验结果显示,填充剂为乳糖,或者为乳糖和微晶纤维素的组合(质量比为3:4)时,其干法制粒的颗粒流动性较好,制粒的顺应性均较好,使用乳糖作为填充剂的片子较光滑,而使用微晶纤维素作为填充剂时制粒顺应性较差。所制得的三种尼可地尔缓释片在ph6.8介质中的溶出情况显示,微晶纤维素有促进尼可地尔溶出的现象,乳糖和微晶纤维素的组合(质量比为3:4)作为填充剂时12小时即溶出达到90%以上。在加速试验的稳定性考察中,乳糖和微晶纤维素的组合(质量比为3:4)、微晶纤维素分别作为填充剂制备的尼可地尔缓释片的有关物质明显增长,药片存在吸湿现象。为了使所制备的尼可地尔实现24小时稳定释放且质量稳定,优选乳糖作为填充剂,且乳糖的售价比微晶纤维素要便宜。
[0030]
试验4:乳糖用量考察拟定尼可地尔与hpmc k4m cr和hpmc k100 lv的质量比为15:15:20,尼可地尔与乳糖的质量比为15:30、15:45、15:55、15:60,参照实施例1所述的制备方法制成尼可地尔缓
释片,参照试验1所述的ph6.8介质进行溶出试验。发现乳糖的用量并不明显影响尼可地尔缓释制剂的溶出,尼可地尔与乳糖的质量比为15:60时的溶出略有减慢,说明尼可地尔与乳糖的质量比为15:30、15:45、15:55所制备的缓释制剂都能满足24小时平稳释放药物的效果。
[0031]
试验5:硬脂酸镁的用量考察参照实施例1的的处方配比,硬脂酸镁质量占比为0.3%、0.5%、1%时参照实施例1所述制粒方法制备尼可地尔缓释片,考察所制得的尼可地尔缓释片在ph6.8介质中的溶出情况。
[0032]
试验结果显示,硬脂酸镁质量占比为0.3%、0.5%、1.0%时不影响尼可地尔缓释制剂的溶出,优选硬脂酸镁质量占比为0.5%。
[0033]
试验6:尼可地尔原料药粒径的考察将d90粒径为33μm、49μm、78μm和150μm的四种尼可地尔原料药,参照实施例1的的处方配比,参照通用制备例制备成尼可地尔缓释片,按试验1所述方法考察在ph6.8介质中的溶出情况。
[0034]
数据结果显示,d90为33μm和49μm的尼可地尔原料药制备的尼可地尔片能达到24小时缓慢释放,d90为78μm的尼可地尔原料药制备的尼可地尔缓释片在16小时时释放达到99%,而d90为150μm尼可地尔原料药制备的尼可地尔缓释片在10小时时释放达到99%。随着尼可地尔原料药d90粒径的增加,溶出明显加快,优选以d90为50μm以内的尼可地尔原料药来制备尼可地尔缓释制剂,可制备成24小时缓慢释放的尼可地尔缓释片。
[0035]
试验7:稳定性考察对实施例1所制得的尼可地尔缓释片在加速条件(温度为40℃,湿度为75%)和长期条件下放置3个月,进行稳定性考察,主要考察指标为含量测定和有关物质,结果见下表:从上表看出,实施例1所制得的尼可地尔缓释片在长期条件和加速条件下放置3个月均较稳定,均符合质量标准的限度范围,即n-(2-羟乙基)异烟酰胺硝酸酯的峰面积不得大于供试品溶液主峰面积的0.5%,其他单杂的峰面积不得大于供试品溶液主峰面积的0.1%,除n-(2-羟乙基)异烟酰胺硝酸酯外的总杂质的峰面积不得大于供试品溶液主峰面积的0.25%。
[0036]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1