兼具电位记录及组织采样功能的颅内深部电极的制作方法
1.本技术涉及植介入医疗设备技术领域,尤其涉及兼具电位记录及组织采样功能的颅内深部电极。
背景技术:
2.传统的颅内深部电极是将一系列电极触点植入到脑内的特定区域,电极触点可以检测其所在区域的局部场电位(lfp),然后该电信号可以通过导线传输到与电极尾端连接的电生理信号记录设备上,然后存储下来。这种技术使临床医生或者研究者可以对脑内特定位置的深部脑电信号进行记录和分析,从而为很多功能神经外科疾病的靶点或病灶的定位提供依据,为疾病的治疗提供了帮助。
3.近年来的研究发现,有许多脑相关的疾病与病灶区域的神经细胞蛋白质表达异常有很强的关联,同时也会在病灶区域表现出脑电信号的异常。典型的就是β-淀粉样蛋白在大脑中聚合堆积形成β-淀粉样斑块(β-amyloid plaques)沉积,其是阿尔茨海默氏症的主要病理特征之一,也被认为是主要发病原因。
技术实现要素:
4.有益的是,开发一种技术可以帮助临床医生和研究者研究特定位置的脑电信号与该位置的蛋白质表达之间的关联,从而对更多的疾病获得更深的认知。更具体地,有益的是,开发一种装置或方法,可以采集脑深部某个特定位置的脑电信号,并在同一位置进行神经组织的取样。
5.为此,本技术提供了兼具电位记录及组织采样功能的颅内深部电极。
6.该颅内深部电极包括设置于其周壁的电极触点,所述电极触点包括微纳结构。
7.在至少一个实施方式中,所述微纳结构构成周期变化图形。
8.在至少一个实施方式中,所述微纳结构的变化周期长度为纹理尺度d,所述微纳结构的纹理尺度d满足,50μm≤d≤200μm。
9.在至少一个实施方式中,所述微纳结构为微孔结构。
10.在至少一个实施方式中,所述微孔的横截面为圆形、椭圆形或矩形。
11.在至少一个实施方式中,所述微纳结构为沟槽结构,所述沟槽结构的槽宽l满足,750nm≤l≤100μm。
12.在至少一个实施方式中,所述微纳结构为或者包括tio2纳米管。
13.在至少一个实施方式中,所述颅内深部电极包括3个或更多个所述电极触点,相邻的所述电极触点之间的间距相同。
14.在至少一个实施方式中,一个所述电极触点包括一个或多个局部区域,所述微纳结构被加工于所述局部区域,在所述颅内深部电极的轴向上相邻的所述局部区域之间的间距相同。
15.在至少一个实施方式中,所述电极触点包括局部区域,所述微纳结构被加工于所
述局部区域,所述局部区域的面积s满足,1000μm2≤s≤100000μm2。
16.在至少一个实施方式中,所述局部区域的形状为圆形、椭圆形或矩形。
17.在至少一个实施方式中,所述微纳结构被加工于所述电极触点的整个表面或半个表面。
18.在至少一个实施方式中,所述电极触点的粗糙度ra大于0.8μm。
19.本技术通过在电极触点上设置微纳结构,改善生物细胞在该区域表面的黏附和固定状态。进而,拔出颅内深部电极后,对微纳结构区域黏附的细胞组织采样,即可以实现对电极触点植入位置原位的神经组织的采样,使得本技术提供的颅内深部电极兼具电位记录和组织采样功能。
附图说明
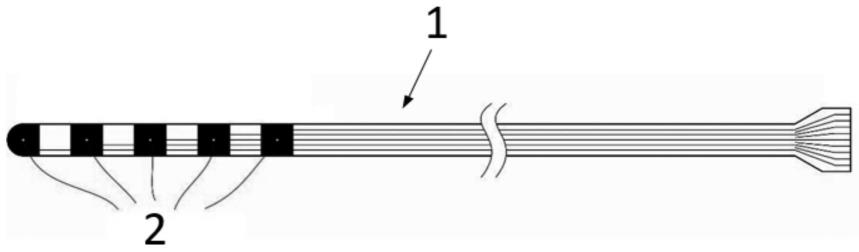
20.图1示出了根据本技术实施方式的兼具电位记录及组织采样功能的颅内深部电极。
21.图2示出了根据本技术实施方式的兼具电位记录及组织采样功能的颅内深部电极的电极触点的放大的剖视示意图。
22.图3示出了根据本技术实施方式的兼具电位记录及组织采样功能的颅内深部电极的电极触点的放大的俯视示意图。
23.附图标记说明
24.1颅内深部电极;2电极触点;21电极触点主体;22微纳结构。
具体实施方式
25.下面参照附图描述本技术的示例性实施方式。应当理解,这些具体的说明仅用于示教本领域技术人员如何实施本技术,而不用于穷举本技术的所有可行的方式,也不用于限制本技术的范围。
26.传统的颅内深部电极,从设计上只具备采集脑深部特定位置脑电信号的功能。由于颅内深部电极的表面并不是严格光滑,尤其是在电极触点的边缘处,具有一定的棱角。这些棱角部位在植入电极的过程中,拔出电极的过程中都有可能从电极的路径(例如颅内)刮下一些神经组织。
27.当电极拔出后,科学家利用这些被带到颅外的神经组织,确实可以做一些蛋白质相关的分析。但是这种方法的问题在于,无法确定这些神经组织是从脑内的什么区域被带出来的。一方面是因为这些神经组织有很高的可能性是在电极移动的过程中被刮下来的,即被刮下组织的部位不一定是电极最终的植入部位;另一方面是电极对神经组织的吸附力不强,在植入和拔出过程中电极表面的神经组织很有可能发生滑移,离开初始的位置。所以,利用这些神经组织,无法在脑电信号与蛋白质表达之间建立可靠的关联。
28.另一种方法是,在电极被从人体颅内拔出以后,利用活检采样的技术,在电极触点原来植入的位置进行组织取样。这种方法的缺陷有两个:一方面是定位精度不足,电极触点的定位精度例如是1~2毫米量级的,在种种因素的影响下,现有的活检取样技术难以达到这样的定位精度;另一方面是这种方法大大地提高了手术的风险。
29.通过在器件表面制备微纳结构,通过接触诱导机制对细胞及组织进行调控,可以
改善金属植介入器件表面生物功能。
30.示例性地,钛(ti)植入体经喷砂之后获得的粗糙表面可以促进上皮细胞及成纤维细胞的早期附着,进而提高种植体截面的骨结合强度,加快种植体早期固定并增加长期服役的成功率。内径约为70nm、管壁厚为20nm以及管长为250nm的锐钛矿型tio2纳米管具有较好的促成骨细胞生长作用,细胞丝状伪足可延伸至纳米管内形成机械锁合,有利于骨结合。通过离子束刻蚀再ti6al4v表面制备的微米/纳米多级粗糙结构更利于促进成骨细胞黏附,提高骨组织结合面积。
31.即现有技术使用微纳结构的目的在于促进植介入装置更好地与人体结合,改善生物相容性。
32.参见图1、图2和图3,本技术的实施方式提供了一种兼具电位记录及组织采样功能的颅内深部电极(后面,简称“颅内深部电极1”)。颅内深部电极1整体可以呈筒状或柱状,颅内深部电极1包括设置于其周壁的电极触点2,电极触点2包括电极触点主体21和微纳结构22。
33.本技术即利用了微纳结构22带来的与生物细胞的黏附和固定的能力,在颅内深部电极1拔出头颅时,微纳结构22处黏附的生物细胞能够随颅内深部电极1被取出。在不影响记录脑电信号的功能,也不提高手术风险的基础上,可以对微纳结构22植入位置原位的生物细胞(例如神经组织)进行采样。可以理解,现有技术未示出亦未启示将微纳结构设置在电极触点上,以起到组织采样功能。
34.传统的电极触点表面为机加工出来的表面,其粗糙度ra例如为0.8μm或者更小。在本技术的一个实施方式中,本技术提供的微纳结构22可以为规律排布的粗糙结构(周期变化图形),其纹理尺度d(周期变化图形的变化周期长度)可以满足,50μm≤d≤200μm。申请人研究得出,纹理尺度d处于50~200μm范围内更有利于神经组织的黏附和固定,另外周期变化的图形也容易制造。
35.在本技术的另一个实施方式中,本技术提供的微纳结构22可以为非规律排布的粗糙结构,微纳结构22可以随机制造于电极触点2的表面或随机制造于电极触点2的表面的局部区域(后面介绍)。
36.本技术的电极触点2的表面的粗糙度ra可以大于0.8μm(或称光洁度可以大于
▽
7)。
37.可以理解,电极触点表面还可以形成不规则的粗糙表面,例如,可以通过喷砂处理获得不规则粗糙表面,从而有利于细胞的黏附。喷砂之后获得的粗糙表面可以细胞的早期附着,示例性地,其粗糙度ra可以为1.5μm。
38.在一个示例中,可以用羟基磷灰石(ha)颗粒进行喷砂处理。在另一示例中,可以用ti(钛)颗粒进行喷砂处理。
39.示例性地,微纳结构22可以为阵列设置的微孔、沟槽/谷脊结构等形状。其加工方法包括但不限于酸蚀处理、阳极氧化处理、表面刻蚀技术等表面微结构的制备技术。
40.参见图2和图3,微纳结构22可以为阵列设置的微孔,形成类似于网状的纹理,其纹理尺度d可以满足,50μm≤d≤200μm。可以用飞秒激光刻蚀的方法,在电极触点主体21的表面打盲孔,加工出微纳结构22。微孔的横截面可以为圆形、椭圆形、矩形等。可以理解,图2和图3示出了单个电极触点2上的电极触点主体21和微纳结构22的俯视图和侧视视角的剖视
图,其均为示意图。可以理解,图3为电极触点2展成平面后的俯视示意图。
41.示例性地,沟槽结构可以为通过飞秒激光刻蚀产生的连续凸凹变换的条形沟槽。示例性地,沟槽结构的槽宽l满足,750nm≤l≤100μm。
42.示例性地,微纳结构22可以为呈阵列排列的tio2纳米管,其内径可以为20~100nm,壁厚可以为10~30nm,长度可以为200~400nm。在一个实施方式中,tio2纳米管的直径可以为30nm。tio2纳米管可以不依附凹坑或凹槽地设置于电极触点主体21的表面。可以通过hf水溶液在电极触点主体21制备出纳米管。
43.示例性地,微纳结构22可以为微米级的沟状、岛状、孔洞和纳米条纹与颗粒组成的复合微结构。
44.示例性地,单个电极触点2上可以包括不同种的上述各形状的微纳结构22。
45.颅内深部电极1的电极触点表面的面积可以处于1~10mm2之间,主要用于检测并记录脑深部神经活动的局部场电位(lfp)。一般神经元胞体的直径大致在10~100μm之间。
46.为了平衡人用电极的安全风险以及确保能够取到足够的神经组织,可以在电极触点2的表面选择一个或多个局部区域,示例性地,该局部区域的面积s可以满足,1000μm2≤s≤100000μm2。或者,使其面积可容纳一定数量(例如大于100个)的神经元细胞。该局部区域可以为圆形、椭圆形、矩形等或其他形状,在该局部区域加工出微纳结构22,用于人体的神经组织采样。
47.在操作人员对颅内深部电极1进行具体使用时,由于本技术各个电极触点2的相对位置已经固定且已知。就可以将电极触点2作为刻度使用。例如,事先确定出轴向上相邻的电极触点的间距,在测量或取得某一电极触点在颅内的具体位置后,其他电极触点的位置可通过计算得出,既便于操作人员确认颅内深部电极1插入深度是否合适,又便于在颅内深部电极1拔出后快速确认各电极触点黏附的神经组织的所对应的颅内位置。
48.在本技术的一个实施方式中,可以在颅内深部电极1上设置多个(3个或更多个)电极触点2,轴向上相邻的电极触点2的间距相同。相同间距的电极触点2,可以使得操作人员更方便计算不同电极触点2黏附的神经组织的所对应的颅内位置。更具体地,可以使各电极触点2的微纳结构22所位于的局部区域之间的轴向间距相同。
49.本技术提供的颅内深部电极1的使用过程可以为:
50.1.将颅内深部电极1正常植入颅内;
51.2.于一定周期(例如7~30天)采集脑电信号,期间,颅内的神经组织逐渐黏附固定于微纳结构22;
52.3.脑电信号采集结束,拔出颅内深部电极1;以及
53.4.剥离微纳结构22黏附的神经组织,对这些神经组织进行分析(例如进行蛋白质分析)。
54.在本技术的又一个实施方式中,在电极触点2的整个表面或半个表面加工微纳结构22,用于动物实验中的神经组织采样。此实施方式的神经组织采样量大,便于研究;无需先选定局部区域,易于加工。
55.本技术在传统的颅内深部电极技术的基础上,结合材料表面处理技术,对传统颅内深部电极的表面进行处理,改变电极触点的表面形貌,制备微纳结构,可以增强生物细胞在该区域表面的黏附和固定作用。进而,在不影响颅内深部电极记录脑电信号的功能,也不
提高手术风险的基础上,可以对电极触点植入位置原位的神经组织进行采样。
56.以上所述是本技术的优选实施方式,应当指出,对于本领域技术人员来说,在不脱离本技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本技术的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1