药物制剂中作为阴离子螯合剂的磷脂的制作方法
本公开涉及药物组合物领域,所述药物组合物包含碱性或酸性活性药物成分和游离阴离子。本发明还涉及所述药物组合物的制备方法和使用方法。
背景技术:
1、口服给药是最优选的药物给药途径之一。需要将足够高的量的药物溶解在胃肠(gi)道中,通过血流吸收和分布,以到达靶标部位。超过40%的新发现化学实体溶解性差(bsc ii类)、渗透性差(bsc iii类)或两者兼而有之(bcs类)。由于溶解性差,这些药物的溶出度低,吸收受限。提高药物在胃肠道中的溶出是药物研发中的一个挑战。溶解度低的化合物(在水溶液中低于100g/ml)通常被视为溶出受限。已使用多种技术来提高药物的水溶解度。在这些技术中,api的成盐是药物发现的常见方法,尤其是对于碱性化合物。
2、活性药物成分(api)的特定盐类通常是为了获得理想的制剂特性而形成的。根据api上存在的官能团,可以选择潜在的抗衡离子来生成盐形式。成盐可用于低熔化温度api(通常为游离碱形式的液体),以提高其熔化温度并保持稳定的结晶状态。成盐也是增加药物分子的水溶解度或亲脂性的众所周知的技术,取决于递送媒介物和药物的目的(guptad.,bhatia d.,dave v.,sutariya v.,gupta s.v.“salts of therapeutic agents:chemical,physicochemical and biological considerations.”molecules 23:1719-1734(2018),下文称为“gupta等人,2018”)。酸性药物的盐通常使用钠(na+)作为抗衡离子,而氯离子(来自盐酸)是碱性药物的常见抗衡离子(vioglio p.c.,chierotti m.r.,gobetto r.“pharmaceutical aspects of salt and cocrystal forms of apis andcharacterization challenges.”advanced drug delivery reviews.117:86-110(2017),下文称为“vioglio等人,2017”)。
3、盐形式api中的酸性或碱性抗衡离子可改变液体剂型中微环境的ph值。api和赋形剂之间的反应性可能会受到ph值变化的影响,这可能会导致api降解并在药物产品中产生大量杂质。游离离子引起的ph值变化也会影响载体的完整性,如药物产品的明胶外壳。使用螯合剂稳定溶液中的化学物质和药物是一种常见策略。螯合剂可以结合抗衡离子/游离离子,并稳定制剂的物理和化学性质。
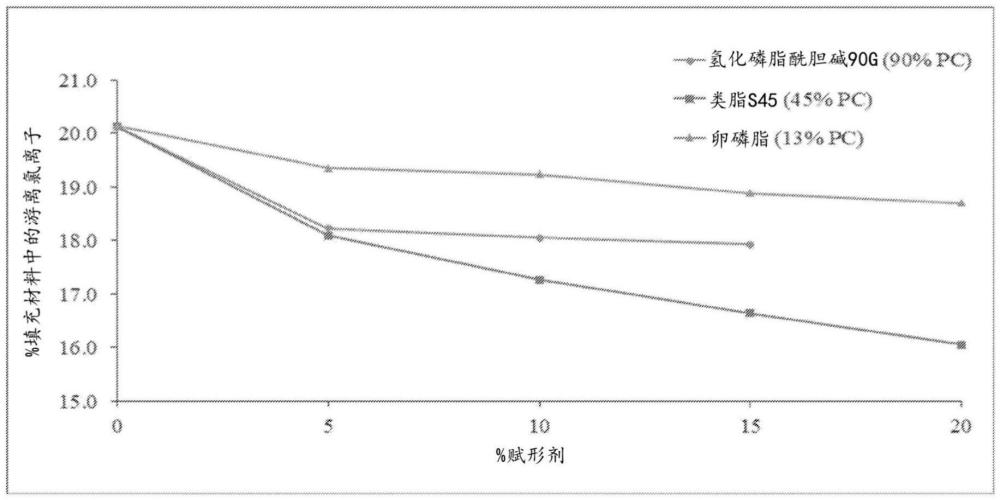
4、最常见的是,离子络合侧重于药物制剂中的重金属螯合,乙二胺四乙酸(edta)及其盐是有效的金属离子螯合剂。然而,药物应用中最常见的螯合剂是阳离子螯合剂。目前,已被证明既安全又有效的用于药物产品的阴离子螯合剂的选择非常有限。
5、需要安全和有效的阴离子螯合剂,可用于配制含有游离阴离子的碱性或酸性api的药物组合物,同时在延长的持续时间内保持组合物的稳定性。
技术实现思路
1、本公开的某些实施方案的目的是提供包含碱性api和游离阴离子的剂型,其中所述剂型在延长的持续时间内是稳定的。
2、本公开的某些实施方案的目的是提供包含酸性api和游离阴离子的剂型,其中所述剂型在延长的持续时间内是稳定的。
3、本公开内容的某些实施方案的另一个目的是提供一种在延长的持续时间内稳定包含碱性api和游离阴离子的剂型的方法。
4、本公开内容的某些实施方案的另一个目的是提供一种在延长的持续时间内稳定包含酸性api和游离阴离子的剂型的方法。
5、本公开内容的某些实施方案的另一个目的是提供制备包含碱性api和游离阴离子的剂型的方法,其中所述剂型在延长的持续时间内是稳定的。
6、本公开内容的某些实施方案的另一个目的是提供制备包含酸性api和游离阴离子的剂型的方法,其中所述剂型在延长的持续时间内是稳定的。
7、本公开内容的某些实施方案的另一个目的是制备一种剂型,该剂型使剂型中碱性或酸性api的量最大化并且使剂型中无附加价值(non-value adding)赋形剂的量最小化。
8、本公开的上述目的和其它目的可以通过本公开来实现,本公开涉及胶囊,其具有包封在壳组合物中的填充材料,其中所述填充材料包含包括卵磷脂的阴离子螯合剂,碱性或酸性api的盐形式和游离阴离子,卵磷脂与游离阴离子的摩尔比为约0.5至约3。在某些实施方案中,游离阴离子是氯离子、溴离子、氟离子、硫酸盐、磷酸盐、甲酸盐、乙酸盐、三氟乙酸盐、马来酸盐、酒石酸盐、甲磺酸盐、苯磺酸盐、硝酸盐或其组合中的至少一种。在某些实施方案中,基于卵磷脂的总重量,卵磷脂包含约10wt%至约95wt%的具有带正电荷官能团的磷脂组分(例如,磷脂酰胆碱(pc)、磷脂酰乙醇胺(pe)或其混合物)。
9、在某些实施方案中,本公开涉及胶囊,其具有包封在壳组合物中的填充材料,其中所述填充材料包含包括卵磷脂的阴离子螯合剂,碱性或酸性api的盐形式和游离阴离子,所述卵磷脂具有约10wt%至约95wt%的具有带正电荷官能团的磷脂组分(例如,磷脂酰胆碱(pc)、磷脂酰乙醇胺(pe)或其混合物)。
10、在某些实施方案中,本公开的胶囊在40℃下保持其完整性超过三周,其中基于填充材料从壳组合物的泄漏来测量胶囊的完整性。
11、在一些实施方案中,本公开涉及用于稳定胶囊的方法。在某些实施方案中,所述方法包括将碱性或酸性活性药物成分(api)的盐形式和游离阴离子与阴离子螯合剂结合以制备填充材料,所述阴离子螯合剂包括卵磷脂,其中卵磷脂与游离阴离子的摩尔比为约0.5至约3;以及将填充材料包封在壳组合物中。在某些实施方案中,稳定化胶囊在40℃下保持其完整性超过三周,其中胶囊的完整性基于填充材料从壳组合物中的泄漏来测量。
12、在一些实施方案中,本公开涉及制备剂型(例如,硬胶囊或软明胶胶囊)的方法。在某些实施方案中,所述方法可包括制备本文所述的任何填充材料,所述填充材料包含碱性或酸性api的盐形式、游离阴离子和阴离子螯合剂,并将所述填充材料包封在壳组合物中。
13、在一些实施方案中,本公开涉及一种治疗方法,该方法包括向有需要的患者给药治疗有效量的本文公开的任何剂型。
14、定义
15、如本文所用,单数形式“一个(a)”、“一个(an)”和“该/所述(the)”包括复数引用,除非上下文另有明确指示。因此,例如,提及“活性药物成分”包括单一活性药物成分以及两种或多种不同活性药物成分的混合物,提及“赋形剂”包括单一赋形剂以及两种或多种不同赋形剂的混合物等。
16、如本文所用,与测定量相关的术语“约”是指该测定量的正常变化,如本领域普通技术人员在进行测量和行使与测量目标和测量设备的精度相称的谨慎程度时所预期的。在某些实施方案中,术语“约”包括所述数字10%,使得“约10”将包括9至11。
17、如本文所用,术语“活性剂”、“活性成分”、“活性药物成分”和“药物”是指旨在产生治疗、预防或其它预期效果的任何材料,无论是否由政府机构为此目的而批准。关于特定药物的这些术语包括所有药物活性剂、其所有药学上可接受的盐、络合物、立体异构体、结晶形式、共晶、醚、酯、水合物、溶剂化物及其混合物,其中所述形式是药物活性的。
18、如本文所用,术语“立体异构体”是单个分子的所有异构体的总称,这些异构体仅在空间中的原子取向不同。它包括化合物的对映异构体和具有一个或多个手性中心的不是彼此镜像的异构体(非对映异构体)。
19、术语“对映异构体”或“对映异构的”是指在其镜像上不可叠加的分子,因此是光学活性的,其中对映异构体使偏振光平面在一个方向上旋转一定程度,而其镜像使偏振光平面在相反方向上旋转相同程度。
20、术语“手性中心”是指连接有四个不同基团的碳原子。
21、术语“患者”是指已经表现出提示需要治疗的一种或多种特定症状的临床表现的受试者、动物或人、针对病症进行防止性或预防性治疗的受试者、或已经被诊断出患有待治疗病症的受试者。术语“受试者”包括术语“患者”的定义,且不排除其他方面健康的个体。
22、除非本文中另有说明,否则本文中数值范围的叙述仅旨在作为单独提及落入该范围内的每个单独数值的简写方法,并且每个单独数值被并入说明书中,如同其在本文中被单独叙述一样。这里描述的所有方法都可以以任何合适的顺序实施,除非本文另有说明或者上下文明显矛盾。本文提供的任何和所有实例或示例性语言(例如,“诸如”)的使用仅旨在说明某些材料和方法,而不构成对范围的限制。说明书中的任何语言都不应被解释为将任何未要求保护的要素指示为实施所公开的材料和方法所必需的。
23、术语“病症”是指可通过向受试者给药有效量的活性剂来治疗或预防的那些医学病症。
24、术语“……的治疗”和“治疗”包括减轻病症的严重性或病症的停止,或减轻病症的症状的严重性或病症的症状的停止。
25、术语“……的预防”和“预防”包括避免病症发作。
26、“治疗有效量”旨在包括活性剂的量或活性剂的组合的量,例如,治疗或预防受试者的病症或治疗该病症的症状的活性剂的量或活性剂的组合的量。
27、短语“药学上可接受的”是指在合理的医学判断范围内,适于与人和动物的组织接触使用而没有过度毒性、刺激、过敏反应或其它问题或并发症,并与合理的益处/风险比相称的那些化合物、材料、组合物和/或剂型。
28、术语“延长释放”是指活性剂在一段时间内释放,例如提供每日一次或每日两次的剂型。
29、术语“立即释放”是指允许药物在胃肠道中溶解而不是旨在延迟或延长药物的溶出或吸收的剂型。例如,在约5分钟、约15分钟、约30分钟、约45分钟或约60分钟内释放至少85%、至少90%或至少95%的活性剂,如通过在usp装置1(#40目筛篮)、usp装置2(浆式)或usp装置3(往复式圆筒)中于室温下在水性介质(ph 1-8)中的体外溶出度所测定。
- 还没有人留言评论。精彩留言会获得点赞!