嵌合抗原受体T细胞疗法的制作方法
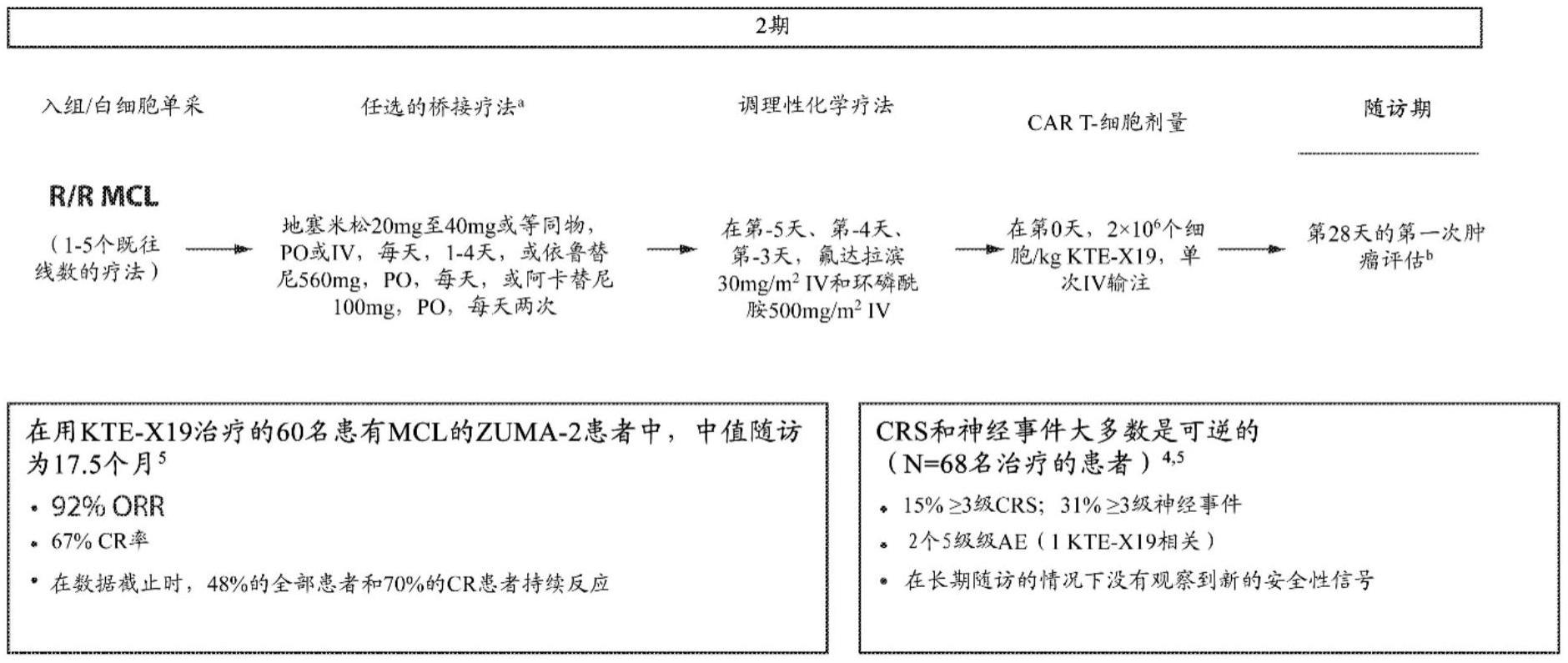
背景技术:
1、人癌本质上由正常细胞构成,这些正常细胞发生了遗传转化或表观遗传转化而变成异常癌细胞。这样一来,癌细胞开始表达与正常细胞所表达的那些不同的蛋白质和其他抗原。身体的先天免疫系统可使用这些异常肿瘤抗原来特异性地靶向和杀死癌细胞。然而,癌细胞采用各种机制来防止免疫细胞(诸如t和b淋巴细胞)成功靶向癌细胞。
2、人t细胞疗法依赖于经富集或修饰的人t细胞来靶向和杀死患者体内的癌细胞。为了增加t细胞靶向和杀死特定癌细胞的能力,已开发了工程化t细胞以表达将t细胞引导至特定靶癌细胞的构建体的方法。包含能够与特定肿瘤抗原相互作用的结合结构域的嵌合抗原受体(car)允许t细胞靶向并杀灭表达特定肿瘤抗原的癌细胞。
3、需要了解car阳性t细胞的属性以及患者的免疫状态如何与免疫疗法的临床结果相关。
技术实现思路
1、本文提供了细胞(例如,工程化t细胞)和/或其组合物用于治疗患有疾病或病症的受试者的方法和用途,所述疾病或病症通常是或包括癌症或肿瘤,诸如白血病或淋巴瘤。在一些方面,与某些替代方法相比,所述方法和用途在用一些方法治疗的受试者中提供或实现改善的反应和/或更持久的反应或功效和/或降低的毒性或其他副作用的风险。在一些实施方案中,所述方法包括施用指定数量或相对数量的工程化细胞、施用确定比率的特定类型的细胞、治疗特定患者群体(诸如具有特定风险概况、分期和/或既往治疗史的那些)、施用另外的治疗剂和/或它们的组合。
2、还提供了涉及评估特定参数的方法,例如,特定生物标志物或分析物的表达,这些参数可以与结果相关,诸如治疗结果,包括反应,诸如完全反应(cr)或部分反应(pr);或安全结果,诸如在施用细胞疗法后产生毒性,例如神经毒性或crs。还提供了基于参数的评估来评估反应的可能性和/或毒性风险的可能性的方法,所述参数诸如生物标志物或分析物的表达。
3、在一个方面,本公开提供了治疗有需要的受试者的表达肿瘤抗原的癌症的方法,所述方法包括向受试者施用治疗有效量的表达识别肿瘤抗原的抗原结合分子的car t细胞。在一些实施方案中,癌症是白血病或淋巴瘤。在一些实施方案中,癌症是套细胞淋巴瘤(mcl)。在一些实施方案中,mcl在≥2个线数的全身疗法后复发/难治。在一些实施方案中,癌症是(复发性/难治性)惰性非霍奇金淋巴瘤(inhl)。在一些实施方案中,癌症是滤泡性淋巴瘤(fl)。在一些实施方案中,癌症是边缘区淋巴瘤(mzl)。在一些实施方案中,受试者患有在从首次接受含抗cd20的化学免疫疗法起24个月内具有进展的高风险特征的mcl(mclpod24)。在一些实施方案中,癌症是在诊断的24个月内具有疾病进展的高风险特征的inhl(inhl pod24)。在一些实施方案中,肿瘤抗原是cd19。在一些实施方案中,早期施用car t细胞治疗。例如,car t-细胞治疗可以作为第一线疗法和/或在进展之前施用。
4、以下实施方案是本公开的举例说明并且是非限制性的:
5、1.一种治疗癌症非霍奇金淋巴瘤(nhl)的方法,所述方法包括向受试者施用治疗有效量的抗肿瘤抗原的免疫细胞。
6、2.根据实施方案1所述的方法,其中所述受试者处于疾病进展的高风险下。
7、3.根据实施方案1或2所述的方法,其中所述nhl是套细胞淋巴瘤(mcl)或惰性nhl(inhl)。
8、4.根据实施方案1或2所述的方法,其中所述inhl是边缘区淋巴瘤(mzl)或滤泡性淋巴瘤(fl)。
9、5.根据实施方案2所述的方法,其中如果所述受试者在初始诊断后24个月内显示疾病进展,则所述受试者处于高风险下。
10、6.根据实施方案2所述的方法,其中如果所述受试者在从首次接受含抗cd20的化学免疫疗法起24个月内显示疾病进展,则所述受试者处于高风险下。
11、7.根据实施方案6所述的方法,其中所述化学免疫疗法包括烷化剂。
12、8.根据实施方案1至7中任一项所述的方法,其中所述免疫细胞作为第一线、第二线、第三线、第四线、第五线或第六线疗法施用。
13、9.根据实施方案1至8中任一项所述的方法,其中所述免疫细胞选自肿瘤浸润性淋巴细胞(til)、nk细胞、自体t细胞、同种异体t细胞和工程化自体t细胞(eact)以及它们的任何组合。
14、10.根据实施方案9所述的方法,其中所述免疫细胞是car t细胞。
15、11.根据实施方案10所述的方法,其中所述car t细胞治疗包括阿基仑赛(axicabtagene ciloleucel)或brexucabtagene autoleucel/kte-x19。
16、12.根据实施方案1、2或9所述的方法,其中所述治疗有效量或有效剂量的免疫细胞是至少约104个细胞、至少约105个细胞、至少约106个细胞、至少约107个细胞、至少约108个细胞、至少约109个细胞或至少约1010个细胞。
17、13.根据实施方案1、2或9所述的方法,其中所述治疗有效量或有效剂量的免疫细胞是约104个细胞、约105个细胞、约106个细胞、约107个细胞或约108个细胞。
18、14.根据实施方案1、2或9所述的方法,其中所述治疗有效量或有效剂量的免疫细胞是约2×106个细胞/kg、约3×106个细胞/kg、约4×106个细胞/kg、约5×106个细胞/kg、约6×106个细胞/kg、约7×106个细胞/kg、约8×106个细胞/kg、约9×106个细胞/kg、约1×107个细胞/kg、约2×107个细胞/kg、约3×107个细胞/kg、约4×107个细胞/kg、约5×107个细胞/kg、约6×107个细胞/kg、约7×107个细胞/kg、约8×107个细胞/kg或约9×107个细胞/kg。
19、15.根据实施方案1、2或9所述的方法,其中所述治疗有效量或有效剂量的免疫细胞介于每kg体重约1×106与约2×106个免疫细胞之间直至约1×108个免疫细胞的最大剂量。
20、16.根据实施方案1、2或9所述的方法,其中免疫细胞的治疗有效剂量介于75×106个与200×106个免疫细胞之间。
21、17.根据实施方案1至16中任一项所述的方法,其中所述肿瘤抗原选自肿瘤相关表面抗原、5t4、甲胎蛋白(afp)、b7-1(cd80)、
22、b7-2(cd86)、bcma、b-人绒毛膜促性腺激素、ca-125、癌胚抗原(cea)、cd123、cd133、cd138、cd19、cd20、cd22、
23、cd23、cd24、cd25、cd30、cd33、cd34、cd4、cd40、
24、cd44、cd56、cd8、cll-1、c-met、cmv-特异性抗原、cs-1、
25、cspg4、ctla-4、dll3、双唾液酸神经节苷脂gd2、导管上皮粘蛋白、ebv特异性抗原、egfr变体iii(egfrviii)、elf2m、内皮糖蛋白、肝配蛋白b2、表皮生长因子受体(egfr)、上皮细胞粘附分子(epcam)、上皮肿瘤抗原、erbb2(her2/neu)、成纤维细胞相关蛋白(fap)、flt3、叶酸结合蛋白、gd2、gd3、神经胶质瘤相关抗原、鞘糖脂、gp36、hbv特异性抗原、hcv特异性抗原、her1-her2、her2-her3的组合、herv-k、高分子量黑色素瘤相关抗原(hmw-maa)、hiv-1包膜糖蛋白gp41、
26、hpv特异性抗原、人类端粒酶逆转录酶、igfi受体、igf-ii、il-11rα、il-13r-a2、流感病毒特异性抗原;cd38、胰岛素生长因子(igfl)-l、肠羧基酯酶、κ链、laga-la、λ链、拉沙病毒-特异性抗原、凝集素反应性afp、谱系特异性或组织特异性抗原诸如
27、cd3、mage、mage-a1、主要组织相容性复合体(mhc)分子、呈递肿瘤特异性肽表位的主要组织相容性复合体(mhc)分子、
28、m-csf、黑色素瘤相关抗原、间皮素、mn-ca ix、muc-1、mut hsp70-2、突变p53、突变ras、嗜中性粒细胞弹性蛋白酶、nkg2d、
29、nkp30、ny-eso-1、p53、pap、前列腺酶、前列腺特异性抗原(psa)、前列腺癌肿瘤抗原-1(pcta-1)、前列腺特异性抗原蛋白、steap1、steap2、psma、rage-1、ror1、ru1、ru2
30、(as)、表面粘附分子、生存素和端粒酶、tag-72、纤连蛋白的额外结构域a(eda)和额外结构域b(edb)以及腱生蛋白-c的al结构域(tnc al)、甲状腺球蛋白、肿瘤基质抗原、血管内皮生长因子受体-2(vegfr2)、病毒-特异性表面抗原诸如hiv-特异性抗原(诸如hivgpl20),以及这些表面抗原的任何衍生物或变体。
31、18.根据实施方案17所述的方法,其中所述靶抗原是cd19。
32、19.根据实施方案1或2所述的方法,其中所述nhl是(复发性或难治性)弥漫性大b细胞淋巴瘤(dlbcl)非特指型、原发纵隔大b细胞淋巴瘤、高级别b细胞淋巴瘤或由滤泡性淋巴瘤引起的dlbcl。
33、20.根据实施方案1至19中任一项所述的方法,所述方法还包括用一种或多种预调理剂预调理所述受试者。
34、21.根据实施方案20所述的方法,其中所述受试者用烷化剂和/或铂类药剂的施用进行预调理。
35、22.根据实施方案21所述的方法,其中所述烷基化剂选自由以下组成的组:美法仑、苯丁酸氮芥、环磷酰胺、二氯甲基二乙胺、氮芥(hn2)、乌拉莫司汀、尿嘧啶氮芥、美法仑、苯丁酸氮芥、异环磷酰胺、苯达莫司汀、卡氮芥、洛莫司汀、链脲霉素、烷基磺酸盐、白消安、噻替派或其类似物以及它们的任何组合。
36、23.根据实施方案21所述的方法,其中所述铂类预调理剂选自由以下组成的组:铂、顺铂、卡铂、奈达铂、奥沙利铂、赛特铂、四硝酸三铂、甲基苄肼、六甲蜜胺、三氮烯、达卡巴嗪、米托唑胺、替莫唑胺、达卡巴嗪、替莫唑胺以及它们的任何组合。
37、24.根据实施方案20所述的方法,其中所述预调理剂包含环磷酰胺和氟达拉滨。
38、25.根据实施方案20至24中任一项所述的方法,其中所述一种或多种预调理剂的施用在所述细胞疗法的施用之前至少七天、至少六天、至少五天、至少四天、至少三天、至少两天或至少一天开始。
39、以下附加的实施方案是本公开的举例说明并且是非限制性的:
40、1.一种治疗有需要的受试者的癌症的方法,其中所述癌症是非霍奇金淋巴瘤(nhl)或复发性/难治性b前体急性淋巴细胞白血病或复发性/难治性b细胞非霍奇金淋巴瘤(r/r b-all),所述方法包括向所述受试者施用治疗有效量的抗肿瘤抗原的免疫细胞;任选地,其中所述受试者是儿科或青少年受试者。
41、2.根据权利要求1所述的方法,其中所述受试者处于疾病进展的高风险下。
42、3.根据权利要求1或2所述的方法,其中所述nhl是套细胞淋巴瘤(mcl)或惰性nhl(inhl)。
43、4.根据权利要求1或2所述的方法,其中所述inhl是边缘区淋巴瘤(mzl)或滤泡性淋巴瘤(fl)。
44、5.根据权利要求2所述的方法,其中如果所述受试者在初始诊断后24个月内显示疾病进展,则所述受试者处于高风险下。
45、6.根据权利要求2所述的方法,其中如果所述受试者在从首次接受含抗cd20的化学免疫疗法起24个月内显示疾病进展,则所述受试者处于高风险下。
46、7.根据权利要求6所述的方法,其中所述化学免疫疗法包括烷化剂。
47、8.根据权利要求1至7中任一项所述的方法,其中所述免疫细胞作为第一线、第二线、第三线、第四线、第五线和/或第六线疗法施用,或在疾病进展之前施用。
48、9.根据权利要求1至8中任一项所述的方法,其中所述免疫细胞选自肿瘤浸润性淋巴细胞(til)、nk细胞、自体t细胞、同种异体t细胞和工程化自体t细胞(eact)以及它们的任何组合。
49、10.根据权利要求9所述的方法,其中所述免疫细胞是car t细胞。
50、11.根据权利要求10所述的方法,其中所述car t细胞治疗包括阿基仑赛或brexucabtagene autoleucel/kte-x-19。
51、12.根据权利要求1、2或9所述的方法,其中所述治疗有效量或有效剂量的免疫细胞是至少约104个细胞、至少约105个细胞、至少约106个细胞、至少约107个细胞、至少约108个细胞、至少约109个细胞或至少约1010个细胞。
52、13.根据权利要求1、2或9所述的方法,其中所述治疗有效量或有效剂量的免疫细胞是约104个细胞、约105个细胞、约106个细胞、约107个细胞或约108个细胞。
53、14.根据权利要求1、2或9所述的方法,其中所述治疗有效量或有效剂量的免疫细胞是约2×106个细胞/kg、约3×106个细胞/kg、约4×106个细胞/kg、约5×106个细胞/kg、约6×106个细胞/kg、约7×106个细胞/kg、约8×106个细胞/kg、约9×106个细胞/kg、约
54、1×107个细胞/kg、约2×107个细胞/kg、约3×107个细胞/kg、约4×107个细胞/kg、约5×107个细胞/kg、约6×107个细胞/kg、约7×107个细胞/kg、约8×107个细胞/kg或约9×107个细胞/kg。
55、15.根据权利要求1、2或9所述的方法,其中所述治疗有效量或有效剂量的免疫细胞介于每kg体重约1×106与约2×106个免疫细胞之间直至约1×108个免疫细胞的最大剂量。
56、16.根据权利要求1、2或9所述的方法,其中所述免疫细胞的治疗有效剂量介于75×106个与200×106个免疫细胞之间。
57、17.根据权利要求1至16中任一项所述的方法,其中所述肿瘤抗原选自肿瘤相关表面抗原、5t4、甲胎蛋白(afp)、b7-1(cd80)、
58、b7-2(cd86)、bcma、b-人绒毛膜促性腺激素、ca-125、癌胚抗原(cea)、cd123、cd133、cd138、cd19、cd20、cd22、
59、cd23、cd24、cd25、cd30、cd33、cd34、cd4、cd40、
60、cd44、cd56、cd8、cll-1、c-met、cmv-特异性抗原、cs-1、
61、cspg4、ctla-4、dll3、双唾液酸神经节苷脂gd2、导管上皮粘蛋白、ebv特异性抗原、egfr变体iii(egfrviii)、elf2m、内皮糖蛋白、肝配蛋白b2、表皮生长因子受体(egfr)、上皮细胞粘附分子(epcam)、上皮肿瘤抗原、erbb2(her2/neu)、成纤维细胞相关蛋白(fap)、flt3、叶酸结合蛋白、gd2、gd3、神经胶质瘤相关抗原、鞘糖脂、gp36、hbv特异性抗原、hcv特异性抗原、her1-her2、her2-her3的组合、herv-k、高分子量黑色素瘤相关抗原(hmw-maa)、hiv-1包膜糖蛋白gp41、
62、hpv特异性抗原、人类端粒酶逆转录酶、igfi受体、igf-ii、il-11rα、il-13r-a2、流感病毒特异性抗原;cd38、胰岛素生长因子(igfl)-l、肠羧基酯酶、κ链、laga-la、λ链、拉沙病毒-特异性抗原、凝集素反应性afp、谱系特异性或组织特异性抗原诸如
63、cd3、mage、mage-a1、主要组织相容性复合体(mhc)分子、呈递肿瘤特异性肽表位的主要组织相容性复合体(mhc)分子、m-csf、黑色素瘤相关抗原、间皮素、mn-ca ix、muc-1、mut hsp70-2、突变p53、突变ras、嗜中性粒细胞弹性蛋白酶、nkg2d、nkp30、ny-eso-1、p53、pap、前列腺酶、前列腺特异性抗原(psa)、前列腺癌肿瘤抗原-1(pcta-1)、前列腺特异性抗原蛋白、steap1、steap2、psma、rage-1、ror1、ru1、ru2(as)、表面粘附分子、生存素和端粒酶、tag-72、纤连蛋白的额外结构域a(eda)和额外结构域b(edb)以及腱生蛋白-c的al结构域(tnc al)、甲状腺球蛋白、肿瘤基质抗原、血管内皮生长因子受体-2(vegfr2)、病毒-特异性表面抗原诸如hiv-特异性抗原(诸如hiv gpl20),以及这些表面抗原的任何衍生物或变体。
64、18.根据权利要求17所述的方法,其中所述靶抗原是cd19。
65、19.根据权利要求1或2所述的方法,其中所述nhl是(复发性或难治性)弥漫性大b细胞淋巴瘤(dlbcl)非特指型、原发纵隔大b细胞淋巴瘤、高级别b细胞淋巴瘤或由滤泡性淋巴瘤引起的dlbcl。
66、20.根据权利要求1至19中任一项所述的方法,所述方法还包括用一种或多种预调理剂预调理所述受试者。
67、21.根据权利要求20所述的方法,其中所述受试者用烷化剂和/或铂类药剂的施用进行预调理。
68、22.根据权利要求21所述的方法,其中所述烷基化剂选自由以下组成的组:美法仑、苯丁酸氮芥、环磷酰胺、二氯甲基二乙胺、氮芥(hn2)、乌拉莫司汀、尿嘧啶氮芥、美法仑、苯丁酸氮芥、异环磷酰胺、苯达莫司汀、卡氮芥、洛莫司汀、链脲霉素、烷基磺酸盐、白消安、噻替派或其类似物以及它们的任何组合。
69、23.根据权利要求21所述的方法,其中所述铂类预调理剂选自由以下组成的组:铂、顺铂、卡铂、奈达铂、奥沙利铂、赛特铂、四硝酸三铂、甲基苄肼、六甲蜜胺、三氮烯、达卡巴嗪、米托唑胺、替莫唑胺、达卡巴嗪、替莫唑胺以及它们的任何组合。
70、24.根据权利要求20所述的方法,其中所述预调理剂包括环磷酰胺和氟达拉滨。
71、25.根据权利要求20至24中任一项所述的方法,其中所述一种或多种预调理剂的施用在所述细胞疗法的施用之前至少七天、至少六天、至少五天、至少四天、至少三天、至少两天或至少一天开始。
72、26.根据权利要求1所述的方法,其中在用抗cd19 car t细胞疗法治疗后,向所述受试者施用同种异体干细胞疗法(allosct)。
73、27.根据权利要求1所述的方法,其中所述受试者具有肿瘤负荷。
74、28.根据权利要求1所述的方法,其中仅在细胞因子释放综合征的情况下施用托珠单抗以用于管理神经事件和/或开始使用类固醇以用于管理2级神经事件。
75、以下附加的实施方案是本公开的举例说明并且是非限制性的:
76、本公开的一个实施方案涉及治疗受试者的复发性/难治性b前体急性淋巴细胞白血病的方法,所述方法包括向所述受试者施用治疗有效量的抗肿瘤抗原的免疫细胞,其中所述受试者是儿科或青少年受试者。
77、本公开的一个实施方案涉及上述方法,其中免疫细胞的治疗有效量介于每kg体重约1×106个与约2×106个免疫细胞之间。
78、本公开的一个实施方案涉及上述方法,其中以介于约40ml至68ml之间的总体积施用免疫细胞。
79、本公开的一个实施方案涉及上述方法,其中以约40ml的总体积施用免疫细胞。
80、本公开的一个实施方案涉及上述方法,其中所述免疫细胞的治疗有效量为每kg体重约1×106个免疫细胞。
81、本公开的一个实施方案涉及上述方法,其中所述免疫细胞作为第一线、第二线、第三线、第四线、第五线或第六线疗法施用,或在疾病进展之前施用。
82、本公开的一个实施方案涉及上述方法,其中所述肿瘤抗原选自肿瘤相关表面抗原、5t4、甲胎蛋白(afp)、b7-1(cd80)、b7-2(cd86)、bcma、b-人绒毛膜促性腺激素、ca-125、癌胚抗原(cea)、cd123、cd133、cd138、cd19、cd20、cd22、cd23、cd24、cd25、cd30、cd33、cd34、cd4、cd40、cd44、cd56、cd8、cll-1、c-met、cmv-特异性抗原、cs-1、cspg4、ctla-4、dll3、双唾液酸神经节苷脂gd2、导管上皮粘蛋白、ebv特异性抗原、egfr变体iii(egfrviii)、elf2m、内皮糖蛋白、肝配蛋白b2、表皮生长因子受体(egfr)、上皮细胞粘附分子(epcam)、上皮肿瘤抗原、erbb2(her2/neu)、成纤维细胞相关蛋白(fap)、flt3、叶酸结合蛋白、gd2、gd3、神经胶质瘤相关抗原、鞘糖脂、gp36、hbv特异性抗原、hcv特异性抗原、her1-her2、her2-her3的组合、herv-k、高分子量黑色素瘤相关抗原(hmw-maa)、hiv-1包膜糖蛋白gp41、hpv特异性抗原、人类端粒酶逆转录酶、igfi受体、igf-ii、il-11rα、il-13r-a2、流感病毒特异性抗原;cd38、胰岛素生长因子(igfl)-l、肠羧基酯酶、κ链、laga-la、λ链、拉沙病毒-特异性抗原、凝集素反应性afp、谱系特异性或组织特异性抗原诸如cd3、mage、mage-a1、主要组织相容性复合体(mhc)分子、呈递肿瘤特异性肽表位的主要组织相容性复合体(mhc)分子、m-csf、黑色素瘤相关抗原、间皮素、mn-ca ix、muc-1、mut hsp70-2、突变p53、突变ras、嗜中性粒细胞弹性蛋白酶、nkg2d、nkp30、ny-eso-1、p53、pap、前列腺酶、前列腺特异性抗原(psa)、前列腺癌肿瘤抗原-1(pcta-1)、前列腺特异性抗原蛋白、steap1、steap2、psma、rage-1、ror1、ru1、ru2(as)、表面粘附分子、生存素和端粒酶、tag-72、纤连蛋白的额外结构域a(eda)和额外结构域b(edb)以及腱生蛋白-c的al结构域(tnc al)、甲状腺球蛋白、肿瘤基质抗原、血管内皮生长因子受体-2(vegfr2)、病毒-特异性表面抗原诸如hiv-特异性抗原(诸如hiv gpl20),以及这些表面抗原的任何衍生物或变体。
83、本公开的一个实施方案涉及上述方法,其中所述靶抗原是cd19。
84、本公开的一个实施方案涉及上述方法,所述方法还包括用一种或多种预调理剂预调理所述受试者,其中所述一种或多种预调理剂选自烷化剂和铂类药剂中的至少一种,其中所述烷化剂选自由以下组成的组:美法仑、苯丁酸氮芥、环磷酰胺、二氯甲基二乙胺、氮芥(hn2)、乌拉莫司汀、尿嘧啶氮芥、美法仑、苯丁酸氮芥、异环磷酰胺、苯达莫司汀、卡莫司汀、洛莫司汀、链脲霉素、烷基磺酸盐、白消安、噻替派或其类似物以及它们的任何组合,并且其中所述铂类预调理剂选自由以下组成的组:铂、顺铂、卡铂、奈达铂、奥沙利铂、赛特铂、四硝酸三铂、甲基苄肼、六甲蜜胺、三氮烯、达卡巴嗪、米托唑胺、替莫唑胺、达卡巴嗪、替莫唑胺以及它们的任何组合。
85、本公开的一个实施方案涉及上述方法,其中所述预调理剂包含环磷酰胺和氟达拉滨。
86、本公开的一个实施方案涉及上述方法,其中所述环磷酰胺以介于200mg/m2/天与2000mg/m2/天之间的剂量使用,并且其中所述氟达拉滨以介于20mg/m2/天与900mg/m2/天之间的剂量施用。
87、本公开的一个实施方案涉及上述方法,其中所述一种或多种预调理剂的所述施用在所述免疫细胞的施用前至少七天、至少六天、至少五天、至少四天、至少三天、至少两天或至少一天开始。
88、本公开的一个实施方案涉及上述方法,其中所述受试者具有高肿瘤负荷。
89、本公开的一个实施方案涉及上述方法,所述方法包括以下步骤中的至少一个:仅在细胞因子释放综合征的情况下施用托珠单抗以用于管理神经事件,以及施用皮质类固醇以用于管理2级神经事件。
90、本公开的一个实施方案涉及上述方法,其中所述受试者处于疾病进展的高风险下,其中如果所述受试者在初始诊断后24个月内显示疾病进展,则所述受试者处于高风险下。
91、本公开的一个实施方案涉及上述方法,其中所述免疫细胞选自肿瘤浸润性淋巴细胞(til)、nk细胞、自体t细胞、同种异体t细胞和工程化自体t细胞(eact)以及它们的任何组合。
92、本公开的一个实施方案涉及上述方法,其中所述免疫细胞是car t细胞。
93、本公开的一个实施方案涉及治疗有需要的受试者的癌症的方法,其中所述癌症是非霍奇金淋巴瘤(nhl)或复发性/难治性b前体急性淋巴细胞白血病或复发性/难治性b细胞非霍奇金淋巴瘤(r/r b-all),所述方法包括向所述受试者施用治疗有效量的抗肿瘤抗原的免疫细胞,并且其中所述免疫细胞是表达抗cd19嵌合抗原受体(car)的自体t细胞。
94、本公开的一个实施方案涉及上述方法,其中所述癌是nhl并且所述nhl是套细胞淋巴瘤(mcl)或惰性nhl(inhl)。
95、本公开的一个实施方案涉及上述方法,其中所述inhl是边缘区淋巴瘤(mzl)或滤泡性淋巴瘤(fl)。
96、本公开的一个实施方案涉及上述方法,其中所述癌症是nhl,并且所述nhl是(复发性或难治性)弥漫性大b细胞淋巴瘤(dlbcl)非特指型、原发纵隔大b细胞淋巴瘤、高级别b细胞淋巴瘤或由滤泡性淋巴瘤引起的dlbcl。
- 还没有人留言评论。精彩留言会获得点赞!