包含环糊精的药物制剂的制作方法
本发明涉及药物制剂,其为glp-1受体激动剂与胰淀素受体激动剂的共制剂。所述药物制剂可用于患有以下疾病的受试者的医学治疗:伴有或不伴有一种或多种相关共病的超重或肥胖症;伴有或不伴有一种或多种相关共病的糖尿病;一种或多种心血管疾病;非酒精性脂肪性肝炎(nash);和/或认知障碍,例如由阿尔茨海默病引起的认知障碍。
背景技术:
1、司美格鲁肽是一种胰高血糖素样肽1(glp-1)受体激动剂,并且是中的活性药物成分。适用于(i)作为饮食和运动的辅助手段,以改善患有2型糖尿病的成人的血糖控制,以及(ii)降低患有2型糖尿病和已确诊心血管疾病的成人发生主要心血管不良事件的风险。
2、司美格鲁肽也是中的活性药物成分。适用于在初始身体质量指数(bmi)大于或等于30kg/m2或大于27kg/m2且存在至少一种与体重相关的共病的成年患者中,作为低热量饮食和增加身体活动的辅助手段用于长期体重管理。
3、和是包含8mm磷酸盐且ph约为7.4的液体药物制剂。
4、已经研究了用于治疗超重和肥胖症的胰淀素受体激动剂卡格列肽(cagrilintide)和glp-1受体激动剂司美格鲁肽的固定剂量组合(lancet2021;397:1736–48)。所研究的药物产品是包含卡格列肽或司美格鲁肽的、供皮下使用的单独液体药物制剂的形式。
5、迄今为止,由于这些活性药物成分的物理化学性质不同,因此认为不可能将司美格鲁肽和卡格列肽共同配制。glp-1受体激动剂司美格鲁肽的等电点与胰淀素受体激动剂卡格列肽的最佳ph值不相容。司美格鲁肽在ph 7.4时稳定性最佳,事先需要在ph 7-8的中性至弱碱性溶液中配制,以确保其在水溶液中的溶解性。卡格列肽在ph 4.0时稳定性最佳,需要在酸性溶液中配制,ph升高会加速其化学降解的速度。卡格列肽和司美格鲁肽不同的物理化学性质阻止这两种肽形成简单的混合物。当glp-1受体激动剂和胰淀素受体激动剂具有不相容的最佳ph范围时,它们的其他组合也是如此。
6、本领域仍然需要简单的共施用glp-1受体激动剂如司美格鲁肽和胰淀素受体激动剂如卡格列肽的手段。
技术实现思路
1、本文公开了共同配制胰淀素受体激动剂和glp-1受体激动剂的手段。本文公开了液体药物制剂,其包含胰淀素受体激动剂、glp-1受体激动剂和包含亲水性化学取代如羟丙基取代的环糊精。该环糊精可以是羟丙基取代的α型环糊精,其包含六个环状排列的葡萄糖单元。该环糊精可以是羟丙基取代的β型环糊精,其包含七个环状排列的葡萄糖单元。该药物制剂可进一步包含缓冲剂如组氨酸、张度剂如山梨醇和/或表面活性剂如聚山梨醇酯20和/或80;并且ph约为5.5-6.5,如ph 5.6-6.0。本文公开的药物制剂可通过肠胃外注射,优选通过皮下注射来施用。
2、本文公开的药物制剂可用于患有以下疾病的受试者的医学治疗:伴有或不伴有一种或多种相关共病的超重或肥胖症;伴有或不伴有一种或多种相关共病的糖尿病;一种或多种心血管疾病;非酒精性脂肪性肝炎(nash);和/或认知障碍,例如由阿尔茨海默病引起的认知障碍。本文公开的药物制剂可以提高此类患者的便利性、治疗依从性并最终改善临床结果。
3、具体实施方式
4、本发明涉及液体药物制剂,其包含胰淀素受体激动剂、glp-1受体激动剂和包含羟丙基取代的环糊精。
5、本文公开的药物制剂可包含两种活性药物成分,即glp-1受体激动剂和胰淀素受体激动剂。
6、本文公开了共同配制胰淀素受体激动剂和glp-1受体激动剂的手段,其中该glp-1受体激动剂的等电点阻止其在使该胰淀素受体激动剂能够具有化学稳定性的ph范围内共同配制。本文公开了共同配制等电点(pi)小于6.5,优选小于6.0,如3.5-6.0,如3.0-5.0,如4.0-6.0的glp-1受体激动剂和胰淀素受体激动剂的手段。
7、胰淀素受体激动剂的最佳ph是其在化学和物理上最稳定时的ph。本领域技术人员可以通过在基本上由胰淀素受体激动剂、缓冲液和注射用水组成的水溶液中在整个ph范围内测试其化学和物理稳定性来容易地找到该胰淀素受体激动剂的最佳ph。
8、glp-1受体激动剂的最佳ph是其在化学和物理上最稳定时的ph。本领域技术人员可以通过在基本上由glp-1受体激动剂、缓冲液和注射用水组成的水溶液中在整个ph范围内测试其化学和物理稳定性来容易地找到该glp-1受体激动剂的最佳ph。glp-1受体激动剂的物理稳定性可以是其等电点的反映,该等电点可能与预计物理稳定性最差时的ph一致。
9、本领域技术人员将会明白,任何液体制剂中的任何glp-1受体激动剂和/或任何胰淀素受体激动剂的化学稳定性和纯度可以通过例如反相(超)高效液相色谱法(rp-uhplc或rp-hplc)和/或通过利用例如尺寸排阻色谱法(sec)测量高分子量蛋白质的百分比(%hmwp)来定量。
10、本领域技术人员将会明白,任何液体制剂中的glp-1受体激动剂和/或任何胰淀素受体激动剂的物理稳定性可以通过分别利用微流成像(mfi)或硫代黄素t(tht)荧光应力试验测量颗粒形成和/或原纤维形成来定量。
11、本文公开了配制胰淀素受体激动剂和glp-1受体激动剂的手段,它们的最佳ph相差至少约2个ph单位,如2-5个ph单位,如2-4个ph单位,如3-5个ph单位。
12、所述glp-1受体激动剂可以是司美格鲁肽。所述胰淀素受体激动剂可以是卡格列肽或卡格列肽的生物活性代谢物或降解产物。本文公开的制剂的组成保持/提高了活性药物成分的化学和物理稳定性,即使在ph 5.5-6.5,如ph 5.6-6.0下共同配制时也是如此;保持了活性药物成分在其生物利用度和暴露方面的药代动力学谱;并且在皮下注射时表现出可接受的局部耐受性。
13、术语“药物制剂”、“共制剂”和“药物产品”在本文中可以互换使用,是指包含glp-1受体激动剂和胰淀素受体激动剂的液体药物制剂。
14、本文公开的药物制剂适合于肠胃外注射,优选皮下注射。
15、胰淀素
16、本文中的术语“胰淀素”是指与内源性胰淀素如人胰淀素具有相同氨基酸序列的多肽。
17、胰淀素受体
18、胰淀素受体激动剂可以结合并激活降钙素受体(ctr)和/或胰淀素受体(amyr)。后者由以下两种组分的异二聚体组成:降钙素受体(ctr),和三种受体活性改变蛋白(ramp1–3)之一,从而产生三种可能的复合物,amyr1–3。
19、胰淀素受体激动剂
20、本文公开的药物制剂包含胰淀素受体激动剂。“胰淀素受体激动剂”可被定义为能够与胰淀素受体结合并且能够将其激活或“激动”的化学实体。在本发明的上下文中,胰淀素受体激动剂至少能够结合并激活胰淀素受体3(amyr3)。胰淀素受体激动剂还可以能够激动降钙素受体、胰淀素受体1(amyr1)和/或胰淀素受体2(amyr2)。
21、内源性胰淀素受体激动剂的实例是人胰淀素和人降钙素。外源性胰淀素受体激动剂的实例是卡格列肽和普兰林肽(中的活性药物成分)。
22、胰淀素受体激动剂能够激活胰淀素受体;换句话说,它对胰淀素受体是“有效的”。可以如wo/2022129526的测定2所述测量胰淀素受体激动剂对胰淀素受体3的体外效力。化合物的效力可以通过其ec50值来描述,其中ec50代表观察到其最大效果的50%时的化合物浓度。ec50值越低,化合物越有效。
23、当如wo/2022129526的测定2所述进行测试时,本文公开的胰淀素受体激动剂的ec50值可以小于300pm,如小于200pm,如小于150pm,优选小于100pm,如小于75pm,优选小于50pm,如小于40pm,如小于30pm,如小于20pm,如小于10pm。
24、卡格列肽
25、本文公开的药物制剂中的胰淀素受体激动剂可以是卡格列肽或卡格列肽的生物活性代谢物或降解产物。
26、卡格列肽,又称为am833,是wo2012/168432中的实施例53的化合物:n-α-[(s)-4-羧基-4-(19-羧基十九碳酰基氨基)丁酰基]-[glu14,arg17,pro37]-普兰林肽。卡格列肽可以如wo2012/168432第153-155页所述制备。
27、卡格列肽可以是盐的形式,优选药学上可接受的盐。
28、卡格列肽的生物活性代谢物或降解产物可在位置21或22上具有天冬氨酸(asp)。卡格列肽的生物活性代谢物或降解产物可在位置21或22上具有异天冬氨酸(iso-asp)。
29、当使用wo/2022129526的测定2中描述的程序测试卡格列肽的效力时,卡格列肽的ec50值约为11pm(wo/2022/129526,表4b和4c)。
30、本文公开的药物制剂中卡格列肽的浓度可以是约0.25mg/ml至约22mg/ml。
31、本文公开的药物制剂可包含浓度为约0.33-18mg/ml;如0.25-0.5mg/ml,如约0.33mg/ml;如0.5-1.0mg/ml,如约0.67mg/ml;如1.0-1.5mg/ml,如约1.33mg/ml;如1.5-2.0mg/ml,如约1.5mg/ml;如2.0-2.5mg/ml;如2.5-3.0mg/ml;如3.0-3.5mg/ml;如约3.2mg/ml;如3.5-4.0mg/ml;如4.0-5.0mg/ml;如5.0-6.0mg/ml;如6.0-7.0mg/ml,如7.0-8.0mg/ml,如8.0-9.0mg/ml,如9.0-10.0mg/ml,如约9.6mg/ml;如10-11mg/ml,如11.0-12.0mg/ml,如11-13mg/ml;如13-22mg/ml,如约18mg/ml;如约20-22mg/ml的卡格列肽。
32、本文公开的药物制剂可包含不超过22mg/ml的卡格列肽。本文公开的药物制剂可包含不超过12mg/ml的卡格列肽。
33、glp-1
34、本文中的术语“glp-1”或“天然glp-1”是指人胰高血糖素样肽-1(glp-1(7-37))。
35、glp-1受体激动剂
36、本文公开的药物制剂包含glp-1受体激动剂。“glp-1受体激动剂”可被定义为能够与glp-1受体结合并产生与内源性配体——胰高血糖素样肽1(glp-1(7-37))——相似的生物响应的配体。“完全”glp-1受体激动剂可被定义为能够引发与glp-1(7-37)相同量级的生物响应的glp-1受体激动剂。
37、外源性glp-1受体激动剂的实例包括司美格鲁肽(和中的活性药物成分)、利拉鲁肽(和中的活性药物成分)、替尔泊肽(tirzepatide)(中的活性药物成分)和度拉糖肽(中的活性药物成分)。
38、glp-1受体激动剂能够结合并激活或“激动”glp-1受体;换句话说,它对glp-1受体是“有效的”。可以如wo/2022/129526的测定1所述测量glp-1受体激动剂对glp-1受体的体外效力。化合物的效力可以通过其ec50值来描述,其中ec50代表观察到其最大效果的50%时的化合物浓度。ec50值越低,化合物越有效。
39、当如wo/2022/129526的测定1所述进行测试时,本文公开的glp-1受体激动剂的ec50值可以小于300pm,如小于200pm,如小于150pm,优选小于100pm,如小于75pm,甚至更优选小于50pm,如小于40pm,如小于30pm,如小于20pm,如小于10pm。
40、司美格鲁肽
41、司美格鲁肽是一种glp-1受体激动剂,也被称为n6,26-{18-[n-(17-羧基十七碳酰基)-l-γ-谷氨酰基]-10-氧代-3,6,12,15-四氧杂-9,18-二氮杂十八碳酰基}-[8-(2-氨基-2-丙酸),34-l-精氨酸]人胰高血糖素样肽1(7-37)。司美格鲁肽在wo2006/097537和j.med.chem.2015,58,18,7370–7380中有描述,并且可以使用本领域技术人员公知的方法,如wo2006/097537实施例4中简述的方法来制备。
42、司美格鲁肽可以以其完全或部分离子化的形式存在于本药物制剂中;例如,一个或多个羧酸基团(-cooh)可被去质子化为羧酸根基团(-coo-),并且/或者一个或多个氨基(-nh2)可被质子化为-nh3+基团。
43、司美格鲁肽可以是盐的形式,优选药学上可接受的盐。
44、当按照wo/2022/129526的测定1中描述的程序测试司美格鲁肽的效力时,司美格鲁肽的ec50值约为5.5pm(参见wo/2022/129526,表4b和4c)。
45、本文公开的药物制剂中司美格鲁肽的浓度可以是约0.25mg/ml至约22mg/ml。
46、所述药物制剂可包含浓度为约0.33-18mg/ml;如0.25-0.5mg/ml,如约0.33mg/ml;如0.5-1.0mg/ml,如约0.67mg/ml;如1.0-1.5mg/ml,如约1.33mg/ml;如1.5-2.0mg/ml,如约1.5mg/ml;如2.0-2.5mg/ml;如约2.2mg/ml,如2.5-3.0mg/ml;如3.0-3.5mg/ml;如约3.2mg/ml;如3.5-4.0mg/ml;如4.0-5.0mg/ml;如约4.8mg/ml;如5.0-6.0mg/ml;如6.0-7.0mg/ml,如约6.4mg/ml;如7.0-8.0mg/ml,如约8.0mg/ml;如8.0-9.0mg/ml,如9.0-10.0mg/ml,如约9.6mg/ml;如10-11mg/ml,如约10.7mg/ml;如11.0-12.0mg/ml,如11-13mg/ml;如约12.8mg/ml;如13-22mg/ml,如约16mg/ml;如约18mg/ml;如约20-22mg/ml的司美格鲁肽。
47、本文公开的药物制剂可包含不超过22mg/ml的司美格鲁肽。本文公开的药物制剂可包含不超过12mg/ml的司美格鲁肽。
48、制备方法
49、例如,可以通过经典的肽合成,例如使用t-boc或fmoc化学法的固相肽合成或其他确立的技术,来生产本文公开的药物制剂中的glp-1受体激动剂和/或胰淀素受体激动剂,参见,例如,greene和wuts,“protective groups in organic synthesis”,john wiley&sons,1999;florencio zaragoza“organic synthesis on solid phase”,wiley-vch verlag gmbh,2000;以及由w.c.chan和p.d.white编著的“fmoc solid phasepeptide synthesis”,oxford university press,2000。
50、或者,这些化合物可以通过重组方法来产生,例如通过培养含有编码肽序列的dna序列并能够在允许该肽表达的条件下在合适的营养培养基中表达该肽的宿主细胞。适合表达这些肽的宿主细胞的非限制性实例是大肠杆菌(escherichia coli)、酿酒酵母(saccharomyces cerevisiae)和哺乳动物bhk或cho细胞系。
51、等电点
52、分子的等电点(pi)是该分子不带净电荷时的ph。肽的pi可通过其氨基酸以及末端胺和羧基的pk值来理论计算,并可用于预测该肽在给定ph下的溶解度。
53、理论计算的glp-1受体激动剂的等电点可以在3.5-6.5,如3.5-6.0,如4.0-6.0,如3.8-4.9,如4.0-4.5的范围内。司美格鲁肽的理论计算的等电点约为4.37。
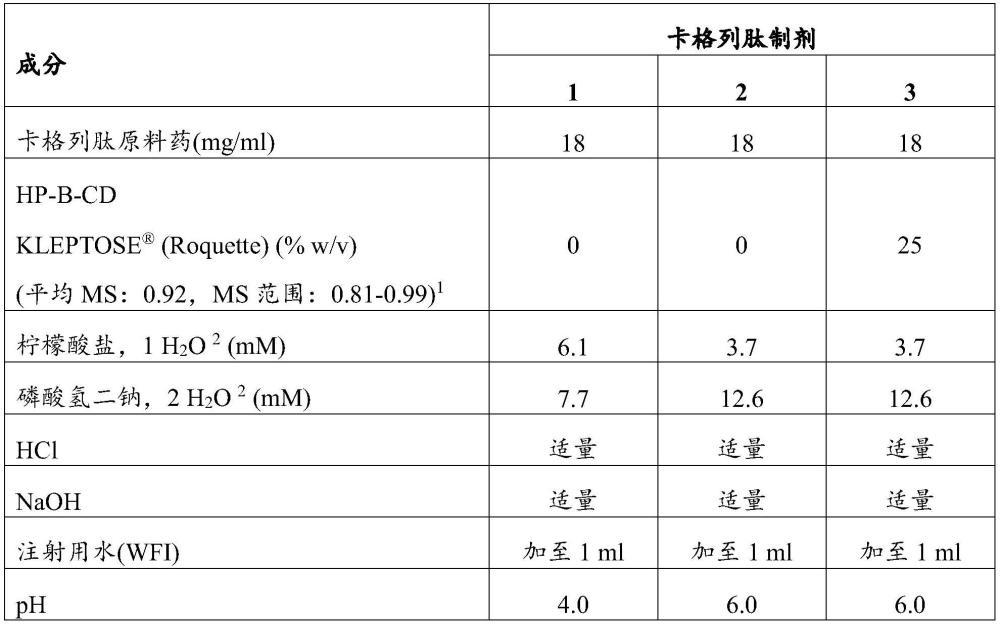
54、理论计算的胰淀素受体激动剂的等电点可具有在8-12,如8-9范围内的等电点(pi)。卡格列肽的理论计算的等电点约为8.56。
55、环糊精
56、本文公开的药物制剂包含含有羟丙基取代的环糊精。
57、该药物制剂可包含约10-25%w/v的含有羟丙基取代的环糊精。该药物制剂可包含超过10%w/v的含有羟丙基取代的环糊精。该药物制剂可包含少于22%w/v的含有羟丙基取代的环糊精。该药物制剂可包含约10-20%w/v、约15-25%w/v、约12-18%w/v、约10-17.5%w/v、约11.25-15%,如约15%w/v的含有羟丙基取代的环糊精。
58、环糊精是由环状排列的6、7或8个α-(1,4)-连接的吡喃葡萄糖(葡萄糖)单元组成的寡糖淀粉衍生物,分别表示α、β或γ型。环糊精具有广泛的应用,尤其是作为药用辅料[p.breen&s.s.jambhekar,cyclodextrins in pharmaceutical formulations ii:solubilization,binding constant,and complexation efficiency,drug discoverytoday,volume 21,number 2,2016年2月]。欧洲药品管理局已描述了关于其作为药用辅料使用的指南[用作辅料的环糊精的背景综述(background review for cyclodextrinsused as excipients),2014,ema/chmp/333892/2013,committee for human medicinalproducts(chmp)],[用作辅料的环糊精(cyclodextrins used as excipients),2017,ema/chmp/333892/2013,committee for human medicinal products(chmp)]。不携带亲水性取代的环糊精类型具有较差的溶解性,且很少用于肠胃外药物产品。
59、为了提高环糊精的溶解度,环糊精的葡萄糖单元的羟基可被不同数目的亲水性化学取代基所取代,例如被羟丙基所取代,从而导致取代度的差异,取代度可被描述为每个环糊精分子中羟丙基的平均数(缩写为ds)或与所述环糊精中存在的每个葡萄糖单元中羟丙基的平均数相对应的摩尔取代度(缩写为ms)。每个环糊精的羟丙基值可以通过将摩尔取代度乘以所述环糊精中包含的葡萄糖单元数来获得。取代度的差异可导致诸如表面活性和复合能力等物理化学性质的改变。羟基也可被磺丁基醚基团化学取代。这些大多是亲水性的修饰产生了非常适合肠胃外给药的环糊精衍生物[用作辅料的环糊精(cyclodextrinsused as excipients),2017,ema/chmp/333892/2013,committee for human medicinalproducts(chmp)]。包含羟丙基取代的环糊精通常缩写为hp-cd,而包含磺丁基醚取代的环糊精缩写为sbe-cd。
60、包含亲水性取代的环糊精采取可被描述为圆锥样的形状,其具有疏水性内腔和由许多能够与邻近水分子形成氢键的亲水性取代基形成的亲水性外表面,从而提高水溶性[t.loftsson,cyclodextrins in parenteral formulations,journal ofpharmaceutical sciences,2020,1-11]。
61、这些圆锥样结构的腔内的疏水性微环境使得它们能够主要通过疏水相互作用形成药物-环糊精复合物[t.loftsson,cyclodextrins in parenteral formulations,journal of pharmaceutical sciences,2020,1-11]。当环糊精与携带一个或多个疏水区的药物分子之间形成复合物时,这些疏水区以及环糊精的疏水腔被屏蔽成与水隔开,从而与单独成分的溶解度相比增加了该复合物的溶解度。此外,一旦环糊精与肽分子之间形成复合物,就会削弱通常会导致聚集的分子间相互作用[t.loftsson,cyclodextrins inparenteral formulations,journal of pharmaceutical sciences,2020,1-11]。
62、本文公开的药物制剂优选地包含羟丙基取代的α型环糊精和/或羟丙基取代的β型环糊精。
63、出乎意料的是,这类带有羟丙基取代的环糊精在稳定卡格列肽和司美格鲁肽的共制剂的能力方面优于带有磺丁基醚取代的相同类型的环糊精。
64、本文公开的药物制剂可包含羟丙基取代的α型环糊精,其包含六个环状排列的葡萄糖单元。羟丙基取代的α型环糊精缩写为hp-a-cd。羟丙基-α-环糊精(cas:128446-33-3/99241-24-4)可商购获得,平均摩尔取代度(ms)为0.8,摩尔取代度范围为0.5-0.9。
65、本文公开的药物制剂可包含每个葡萄糖单元具有最少约0.4个羟丙基的羟丙基-α-环糊精。本文公开的药物制剂可包含每个葡萄糖单元具有最多约1.0个羟丙基的羟丙基-α-环糊精。
66、本文公开的药物制剂可包含摩尔取代度范围为每个葡萄糖单元0.5-0.9个羟丙基的羟丙基-α-环糊精。本文公开的药物制剂可包含平均摩尔取代度(ms)为每个葡萄糖单元约0.8个羟丙基的羟丙基-α-环糊精。
67、本文公开的药物制剂可包含羟丙基取代的β型环糊精,其包含七个环状排列的葡萄糖单元。
68、羟丙基取代的β型环糊精缩写为hp-b-cd。
69、羟丙基-β-环糊精是众所周知的药用辅料,通常用于小分子药物制剂中,主要用于增加溶解度和生物利用度[t.loftsson,cyclodextrins in parenteral formulations,journal of pharmaceutical sciences,2020,1-11]。迄今为止,环糊精和环糊精取代衍生物在蛋白质和肽基药物制剂中的使用是有限的。
70、根据欧洲和美国药典[usp 38nf 33,pharm eur 8,通过usp〈761〉/pharm.eur.2.2.33中描述的方法估算],作为药用辅料的市售羟丙基-β-环糊精的羟丙基取代度(ds)范围在2.8与10.5之间,对应于每个葡萄糖单元0.4-1.5个羟丙基(ms)。市售的环糊精,如羟丙基-β-环糊精,通常通过其摩尔取代度范围的平均摩尔取代度(ms)来描述。
71、羟丙基-β-环糊精(cas:128446-35-5/94035-02-6)可商购获得用作辅料,其平均摩尔取代度(ms)包括:ms 0.62,摩尔取代度范围为0.58-0.68;ms 0.67,摩尔取代度范围为(0.6-0.9);ms 0.68,摩尔取代度范围为(0.58-0.72);ms 0.84,摩尔取代度范围为(0.8-1.0);ms 0.92,摩尔取代度范围为(0.81-0.99);ms1.08,摩尔取代度范围为(0.86-1.14);各值描述每个葡萄糖单元的羟丙基数。
72、本文公开的药物制剂可包含每个葡萄糖单元具有最少约0.4个羟丙基的羟丙基-β-环糊精。本文公开的药物制剂可包含每个葡萄糖单元具有最多约1.0个羟丙基的羟丙基-β-环糊精。
73、本文公开的药物制剂可包含摩尔取代度范围为每个葡萄糖单元0.58-1.0个羟丙基的羟丙基-β-环糊精。本文公开的药物制剂可包含平均摩尔取代度(ms)范围为每个葡萄糖单元约0.62-0.92个羟丙基的羟丙基-β-环糊精。
74、本文公开的药物制剂可包含平均摩尔取代度(ms)为每个葡萄糖单元约0.62-0.84个羟丙基的羟丙基-β-环糊精。
75、本文公开的药物制剂可包含每个葡萄糖单元具有约0.4-0.75个羟丙基的羟丙基-β-环糊精。
76、本文公开的药物制剂可包含每个葡萄糖单元具有约0.75个羟丙基的羟丙基-β-环糊精。
77、本文公开的药物制剂可包含平均摩尔取代度(ms)约为0.62的羟丙基-β-环糊精。本文公开的药物制剂可包含每个葡萄糖单元具有约0.58-0.68个羟丙基的羟丙基-β-环糊精。
78、本文公开的药物制剂可包含平均摩尔取代度(ms)约为0.68的羟丙基-β-环糊精。本文公开的药物制剂可包含每个葡萄糖单元具有约0.58-0.72个羟丙基的羟丙基-β-环糊精。
79、本文公开的药物制剂可包含平均摩尔取代度(ms)约为0.67的羟丙基-β-环糊精。本文公开的药物制剂可包含每个葡萄糖单元具有约0.6-0.9个羟丙基的羟丙基-β-环糊精。
80、本文公开的药物制剂可包含平均摩尔取代度(ms)约为0.84的羟丙基-β-环糊精。本文公开的药物制剂可包含每个葡萄糖单元具有约0.8-1.0个羟丙基的羟丙基-β-环糊精。
81、本文公开的药物制剂可包含平均摩尔取代度(ms)约为0.92的羟丙基-β-环糊精。本文公开的药物制剂可包含每个葡萄糖单元具有约0.81-0.99个羟丙基的羟丙基-β-环糊精。
82、本文公开的药物制剂可包含10-25%w/v,如超过10%w/v且少于22%w/v,如约10-20%w/v,如约12-18%w/v,如约10-17.5%w/v,如约11.25-15%,如约15%w/v的羟丙基-β-环糊精,其具有每个葡萄糖单元最少约0.4个羟丙基且每个葡萄糖单元最多约1.0个羟丙基;例如每个葡萄糖单元平均0.62-0.92个羟丙基,例如每个葡萄糖单元约0.75个羟丙基;例如每个葡萄糖单元平均0.62-0.84个羟丙基;例如每个葡萄糖单元约0.4-0.75个羟丙基;例如每个葡萄糖单元平均0.62个羟丙基,例如每个葡萄糖单元约0.58-0.68个羟丙基。
83、其他辅料
84、所述药物制剂可包含缓冲剂。缓冲剂在药物制剂中的使用是技术人员公知的。为方便起见,参考remington:the science and practice of pharmacy,第20版,2000。
85、ph可在通常被定义为15-25℃或15-20℃的“室温”下测量。ph优选地在约20℃下测量。
86、本文公开的药物制剂可包含pka接近溶液的所需ph的缓冲剂。该药物制剂可包含具有约5.0-7.0的至少一个pka值的缓冲剂。该药物制剂可包含pka约为5.0-7.0的缓冲剂。该药物制剂可包含选自组氨酸、柠檬酸盐和/或磷酸盐的缓冲剂。该缓冲剂可以是浓度为3-30mm的柠檬酸盐。该缓冲剂可以是浓度为3-30mm的组氨酸。该缓冲剂可以是浓度为3-30mm的磷酸盐。
87、所述药物制剂可进一步包含一种或多种用于调节ph的试剂,如naoh和/或hcl。
88、所述药物制剂的所需ph可以是约5.5-6.5。ph优选为5.6-6.0。ph可以是约5.6,如约5.7,如约ph 5.8,如约5.9,如约6.0。
89、所述药物制剂可包含张度剂。张度剂在药物制剂中的使用是技术人员公知的。为方便起见,参考remington:the science and practice of pharmacy,第20版,2000。
90、张度剂的目的是当制剂被注射到体内时保护活组织。张度剂可选自甘露醇、山梨醇或海藻糖,或其组合。在一些实施方案中,该张度剂是甘露醇。在一些实施方案中,该张度剂是山梨醇。在一些实施方案中,该张度剂是海藻糖。
91、张度剂的浓度使得该制剂是等渗的。当张度剂是甘露醇时,它可以以16.5-37.5mg/ml,如约20mg/ml的浓度存在。当张度剂是山梨醇时,它可以以约10-40mg/ml;如约16.5-37.5mg/ml;如约10-30mg/ml;如约16-28mg/ml,如约16.5-25mg/ml,如约16-26mg/ml;如约16-24mg/ml;如约26mg/ml,如约24mg/ml,如约22mg/ml,如约20mg/ml,如约18mg/ml,如约16mg/ml,如约12mg/ml的浓度存在。当张度剂是海藻糖时,它可以以33-75mg/ml,如约38mg/ml的浓度存在。
92、所述药物制剂可包含表面活性剂。表面活性剂可进一步增加制剂在其制备、储存和作为药物使用过程中的物理稳定性和稳健性;例如,当制剂暴露于容器内的空气时保持其稳定性。表面活性剂在药物制剂中的使用是技术人员公知的。为方便起见,参考remington:the science and practice of pharmacy,第20版,2000。
93、表面活性剂可选自聚山梨醇酯20和/或聚山梨醇酯80。该表面活性剂可以是聚山梨醇酯20。该表面活性剂可以是聚山梨醇酯80。
94、所述药物制剂可包含0.01mg/ml或更多的聚山梨醇酯20,且最多2.0mg/ml,例如最多1.5mg/ml的聚山梨醇酯20,例如约0.01-1.0mg/ml的聚山梨醇酯20,例如约0.05mg/ml的聚山梨醇酯20。
95、所述药物制剂可包含0.01mg/ml或更多的聚山梨醇酯80,且最多2.0mg/ml,例如最多1.5mg/ml的聚山梨醇酯80,例如约0.01-1.0mg/ml的聚山梨醇酯80,例如约0.05mg/ml的聚山梨醇酯80。
96、所述药物制剂包含注射用水(wfi)。该药物制剂可包含超过75%w/w的水,如80%w/w的水,如约85%w/w的水,如高达约90%w/w的水。
97、本文公开的药物制剂可以不包含防腐剂。
98、医药应用
99、本文公开的药物制剂可以用于医药用途。
100、本文公开的药物制剂可以通过肠胃外注射来施用。本文公开的药物制剂可以通过皮下注射来施用。
101、如本文所用的,术语“治疗”是指对任何有需要的人类或其他脊椎动物受试者的医药治疗。所述受试者预期已经经历了由执业医师或兽医执业医师进行的体格检查,该执业医师已经给出了初步或明确的诊断,该诊断指明所述特定治疗的使用对所述人类或其他脊椎动物的健康是有益的。根据受试者健康的现状,所述治疗的时间安排和目的可随个体而异。因此,所述治疗可以是预防性的(防止性的)、姑息性的、对症的和/或治愈性的。
102、本文公开的药物制剂可以施用于人类受试者。
103、本文公开的药物制剂可以用于:
104、(i)预防和/或治疗任何形式的糖尿病和相关症状,如高血糖症、2型糖尿病、糖耐量减低、1型糖尿病、非胰岛素依赖性糖尿病、青年成熟发作型糖尿病(mody)、妊娠糖尿病,和/或用于减少hba1c;
105、(ii)延缓或预防糖尿病进展,如2型糖尿病的进展,延缓糖耐量减低(igt)进展成需要胰岛素的2型糖尿病,和/或延缓无需胰岛素的2型糖尿病进展成需要胰岛素的2型糖尿病;
106、(iii)例如通过减少食物摄入量、抑制食欲、诱导饱腹感、减轻体重来预防和/或治疗饮食失调,如肥胖症;治疗或预防暴食症、饮食冲动、神经性贪食症和/或由抗精神病药或类固醇给药诱发的肥胖症;减少胃运动;和/或延缓胃排空;
107、(iv)预防和/或治疗心血管疾病,如延缓或减少选自心血管死亡、非致命性心肌梗死、非致命性卒中、血运重建、因不稳定型心绞痛而住院以及因心力衰竭而住院的主要心血管不良事件(mace)的发展;
108、(v)预防和/或治疗非酒精性脂肪肝病(nafld)和/或非酒精性脂肪性肝炎(nash);
109、(vi)预防和/或治疗认知障碍,如阿尔茨海默病。
110、在一些实施方案中,所述适应症是(i)。在一些实施方案中,所述适应症是(ii)。在又一个特定方面,所述适应症是(iii)。在又一个特定方面,所述适应症是(iv)。在又一个特定方面,所述适应症是(v)。在又一个特定方面,所述适应症是(vi)。在一些实施方案中,所述适应症是2型糖尿病和/或肥胖症。
111、通常,所有罹患肥胖症的受试者也被认为罹患超重。本文公开了用于治疗或预防肥胖症的方法。本文公开了本文公开的制剂用于治疗或预防肥胖症的用途。在一些实施方案中,罹患肥胖症的受试者是人,如成人或儿科病人(包括婴儿、儿童和青少年)。
112、身体质量指数(bmi)是基于身高和体重的体脂量度。计算公式是bmi=以千克为单位的体重/以米为单位的身高2。罹患肥胖症的人类受试者可具有30kg/m2或更高的bmi;该受试者也可被称为肥胖的。在一些实施方案中,罹患肥胖症的人类受试者可具有≥35的bmi或在≥30至<40范围内的bmi。在一些实施方案中,该肥胖症为重度肥胖症或病态肥胖症,其中该人类受试者可具有≥40的bmi。
113、本文公开了任选地在至少一种体重相关共病的存在下治疗或预防超重的方法。本文公开了本文公开的制剂任选地在至少一种体重相关共病的存在下用于治疗或预防超重的用途。
114、在一些实施方案中,罹患超重的受试者是人,如成人或儿科病人(包括婴儿、儿童和青少年)。在一些实施方案中,罹患超重的人类受试者可具有25kg/m2或更高的bmi,如27kg/m2或更高的bmi。在一些实施方案中,罹患超重的人类受试者具有在25至<30范围内或在27至<30范围内的bmi。
115、升高的bmi增加了个体患上多种疾病或共病中的任一种的风险。与体重相关的共病可以是以上提到的疾病中的一种或其组合。在一些实施方案中,与体重相关的共病选自高血压、糖尿病(如2型糖尿病)、血脂异常、高胆固醇和阻塞性睡眠呼吸暂停。
116、本文公开了减轻体重的方法。将要经历体重减轻的人可具有25kg/m2或更高的bmi,如27kg/m2或更高的bmi(超重)或者30kg/m2或更高的bmi(肥胖)。在一些实施方案中,将要经历体重减轻的人可具有35kg/m2或更高的bmi或者40kg/m2或更高的bmi。术语“体重减轻”可包括肥胖症和/或超重的治疗或预防。
117、在一些实施方案中,本文公开的司美格鲁肽和卡格列肽药物制剂的给药可在初始身体质量指数(bmi)为30kg/m2或更高(肥胖)或者27kg/m2或更高(超重)且存在至少一种与体重相关的共病(例如高血压、2型糖尿病或血脂异常)的成年患者中,作为低热量饮食和增加身体活动的辅助手段用于长期体重管理。
118、在一些实施方案中,本文公开的司美格鲁肽和卡格列肽药物制剂的给药在治疗开始的26周内可导致>15%的体重减轻,如>20%的体重减轻,如>25%的体重减轻,如>30%的体重减轻,如约15-40%的体重减轻,如约20-35%的体重减轻,如约25-30%的体重减轻。
119、在一些实施方案中,本文公开的司美格鲁肽和卡格列肽药物制剂的给药在治疗开始的26周内可导致>15%的体重减轻,如>20%的体重减轻,如>25%的体重减轻,如>30%的体重减轻,如约15-40%的体重减轻,如约20-35%的体重减轻,如约25-30%的体重减轻。
120、在一些实施方案中,与使用司美格鲁肽作为唯一活性成分或卡格列肽作为唯一活性成分的治疗结果相比,本文公开的司美格鲁肽和卡格列肽药物制剂的给药导致以百分点计更高的hba1c降低。
121、剂量
122、本发明的药物制剂包含特定浓度的胰淀素受体激动剂和特定浓度的glp-1受体激动剂。例如,如上所述,该药物制剂可包含0.25至22mg/ml的卡格列肽和0.25至22mg/ml的司美格鲁肽。单次注射中施用的glp受体激动剂和胰淀素受体激动剂的剂量取决于药物制剂内这些活性成分的浓度和所施用的药物制剂的体积。
123、本发明的药物制剂可以按预定的时间间隔以单剂量施用。
124、本文公开的药物制剂的单剂量可含有以下任一剂量的胰淀素受体激动剂如卡格列肽和glp-1受体激动剂如司美格鲁肽。
125、可以向有需要的受试者施用有效量的胰淀素受体激动剂如卡格列肽和glp-1受体激动剂如司美格鲁肽。
126、在一些实施方案中,所述剂量大约每周施用一次。在一些实施方案中,两次固定剂量之间的间隔可以是约4天、约5天、约6天、约7天、约8天、约9天或约10天。在优选的实施方案中,大约每7天一次(每周一次)施用固定的维持剂量。
127、在一些实施方案中,将剂量施用于患有以上列出的任何一种疾病或共病或其组合的个体。在一些优选的实施方案中,将剂量施用于患有肥胖症(身体质量指数[bmi]≥30kg/m2)的受试者。在一些优选的实施方案中,将剂量施用于超重(bmi≥27kg/m2–<30kg/m2)并且具有至少一种与体重相关的共病(例如高血压、2型糖尿病或血脂异常)的个体。
128、在一些实施方案中,每周一次的治疗导致统计学上显著的、剂量依赖性的体重减轻。
129、在一些优选的实施方案中,所述剂量作为饮食和运动的辅助手段施用,以改善患有2型糖尿病的成人的血糖控制。
130、在治疗开始后,向有需要的个体施用递增剂量的胰淀素受体激动剂如卡格列肽和glp-1受体激动剂如司美格鲁肽可能是有益的。一旦个体适应了该治疗,则向有需要的个体施用维持剂量的胰淀素受体激动剂如卡格列肽和glp-1受体激动剂如司美格鲁肽可能是有益的。
131、在一些实施方案中,治疗是每周一次并且剂量递增期为16周。
132、在一些实施方案中,治疗是每周一次并且剂量递增大约每周进行一次。
133、在一些实施方案中,治疗是每周一次并且剂量递增大约每隔一周进行一次。
134、在一些实施方案中,治疗是每周一次并且剂量递增大约每三周进行一次。
135、在一些实施方案中,治疗是每周一次并且剂量递增大约每四周进行一次。
136、施用的胰淀素受体激动剂的剂量可以是约0.25-16mg,如约0.25-9.0mg,如约0.25-4.5mg,如约0.25-2.4mg。
137、施用的卡格列肽的剂量可以是约0.25-16mg,如约0.25-9.0mg,如约0.25-4.5mg,如约0.25-2.4mg。
138、在一些实施方案中,施用的卡格列肽的剂量约为0.25mg。
139、在一些实施方案中,施用的卡格列肽的剂量约为0.5mg。
140、在一些实施方案中,施用的卡格列肽的剂量约为1.0mg。
141、在一些实施方案中,施用的卡格列肽的剂量约为1.5mg。
142、在一些实施方案中,施用的卡格列肽的剂量约为1.7mg。
143、在一些实施方案中,施用的卡格列肽的剂量约为2.4mg。
144、在一些实施方案中,施用的卡格列肽的剂量约为3.4mg。
145、在一些实施方案中,施用的卡格列肽的剂量约为3.6mg。
146、在一些实施方案中,施用的卡格列肽的剂量约为4.5mg。
147、在一些实施方案中,施用的卡格列肽的剂量约为7.2mg。
148、在一些实施方案中,施用的卡格列肽的剂量约为8.0mg。
149、在一些实施方案中,施用的卡格列肽的剂量约为9.0mg。
150、在一些实施方案中,施用的卡格列肽的剂量约为16.0mg。
151、施用的glp-1受体激动剂的剂量可以是约0.25-16mg,如约0.25-9.0mg,如约0.25-4.5mg,如约0.25-2.4mg。
152、施用的司美格鲁肽的剂量可以是约0.25-16mg,如约0.25-9.0mg,如约0.25-4.5mg,如约0.25-2.4mg。
153、在一些实施方案中,施用的司美格鲁肽的剂量约为0.25mg。
154、在一些实施方案中,施用的司美格鲁肽的剂量约为0.5mg。
155、在一些实施方案中,施用的司美格鲁肽的剂量约为1.0mg。
156、在一些实施方案中,施用的司美格鲁肽的剂量约为1.5mg。
157、在一些实施方案中,施用的司美格鲁肽的剂量约为1.7mg。
158、在一些实施方案中,施用的司美格鲁肽的剂量约为2.4mg。
159、在一些实施方案中,施用的司美格鲁肽的剂量约为3.6mg。
160、在一些实施方案中,施用的司美格鲁肽的剂量约为4.5mg。
161、在一些实施方案中,施用的司美格鲁肽的剂量约为4.8mg。
162、在一些实施方案中,施用的司美格鲁肽的剂量约为6.0mg。
163、在一些实施方案中,施用的司美格鲁肽的剂量约为6.9mg。
164、在一些实施方案中,施用的司美格鲁肽的剂量约为7.2mg。
165、在一些实施方案中,施用的司美格鲁肽的剂量约为8.0mg。
166、在一些实施方案中,施用的司美格鲁肽的剂量约为9.0mg。
167、在一些实施方案中,施用的司美格鲁肽的剂量约为12mg。
168、在一些实施方案中,施用的司美格鲁肽的剂量约为16.0mg。在一些实施方案中,施用的司美格鲁肽的剂量约为16.0mg。
169、在一些实施方案中,胰淀素受体激动剂与glp-1受体激动剂之比约为1:2。在一些实施方案中,卡格列肽与司美格鲁肽之比约为1:2。
170、在一些实施方案中,卡格列肽的剂量约为0.125mg,且司美格鲁肽的剂量约为0.25mg。
171、在一些实施方案中,卡格列肽的剂量约为0.25mg,且司美格鲁肽的剂量约为0.5mg。
172、在一些实施方案中,卡格列肽的剂量约为0.5mg,且司美格鲁肽的剂量约为1.0mg。
173、在一些实施方案中,卡格列肽的剂量约为0.75mg,且司美格鲁肽的剂量约为1.5mg。
174、在一些实施方案中,卡格列肽的剂量约为0.85mg,且司美格鲁肽的剂量约为1.7mg。
175、在一些实施方案中,卡格列肽的剂量约为1.2mg,且司美格鲁肽的剂量约为2.4mg。
176、在一些实施方案中,卡格列肽的剂量约为2.25mg,且司美格鲁肽的剂量约为4.5mg。
177、在一些实施方案中,施用的卡格列肽的剂量约为3.6mg,且司美格鲁肽的剂量约为7.2mg。
178、在一些实施方案中,卡格列肽的剂量约为4.0mg,且司美格鲁肽的剂量约为8.0mg。
179、在一些实施方案中,卡格列肽的剂量约为7.2mg,且司美格鲁肽的剂量约为14.4mg。
180、在一些实施方案中,卡格列肽的剂量约为8.0mg,且司美格鲁肽的剂量约为16.0mg。
181、在一些实施方案中,卡格列肽的维持剂量约为1.2mg,且司美格鲁肽的维持剂量约为2.4mg。
182、在一些实施方案中,卡格列肽的维持剂量约为2.25mg,且司美格鲁肽的剂量约为4.5mg。
183、在一些实施方案中,卡格列肽的维持剂量约为4.0mg,且司美格鲁肽的维持剂量约为8.0mg。
184、在一些实施方案中,卡格列肽的维持剂量约为8.0mg,且司美格鲁肽的维持剂量约为16.0mg。
185、在一些实施方案中,胰淀素受体激动剂与glp-1受体激动剂之比约为1:1。在一些实施方案中,卡格列肽与司美格鲁肽之比约为1:1。
186、在一些实施方案中,卡格列肽的剂量约为0.25mg,且司美格鲁肽的剂量约为0.25mg。
187、在一些实施方案中,卡格列肽的剂量约为0.5mg,且司美格鲁肽的剂量约为0.5mg。
188、在一些实施方案中,卡格列肽的剂量约为1.0mg,且司美格鲁肽的剂量约为1.0mg。
189、在一些实施方案中,卡格列肽的剂量约为1.7mg,且司美格鲁肽的剂量约为1.7mg。
190、在一些实施方案中,卡格列肽的剂量约为2.4mg,且司美格鲁肽的剂量约为2.4mg。
191、在一些实施方案中,卡格列肽的维持剂量约为2.4mg,且司美格鲁肽的维持剂量约为2.4mg。
192、在一些实施方案中,卡格列肽的剂量约为4.5mg,且司美格鲁肽的剂量约为4.5mg。
193、在一些实施方案中,卡格列肽的剂量约为8.0mg,且司美格鲁肽的剂量约为8.0mg。
194、在一些实施方案中,卡格列肽的剂量约为16.0mg,且司美格鲁肽的剂量约为16.0mg。
195、在一些实施方案中,胰淀素受体激动剂与glp-1受体激动剂之比为1:1至1:7。
196、在一些实施方案中,卡格列肽的剂量约为2.4mg,且司美格鲁肽的剂量约为2.4mg至16.0mg。
197、在一些实施方案中,卡格列肽的剂量约为2.4mg,且司美格鲁肽的剂量约为3.6mg至16.0mg。
198、在一些实施方案中,卡格列肽的剂量约为2.4mg,且司美格鲁肽的剂量约为2.4mg至13.5mg。
199、在一些实施方案中,卡格列肽的剂量约为2.4mg,且司美格鲁肽的剂量约为3.6mg至13.5mg。
200、在一些实施方案中,卡格列肽的剂量约为2.4mg,且司美格鲁肽的剂量约为3.6mg。
201、在一些实施方案中,卡格列肽的剂量约为2.4mg,且司美格鲁肽的剂量约为4.8mg。
202、在一些实施方案中,卡格列肽的剂量约为2.4mg,且司美格鲁肽的剂量约为6.0mg。
203、在一些实施方案中,卡格列肽的剂量约为2.4mg,且司美格鲁肽的剂量约为6.9mg。
204、在一些实施方案中,卡格列肽的剂量约为2.4mg,且司美格鲁肽的剂量约为7.2mg。
205、在一些实施方案中,卡格列肽的剂量约为2.4mg,且司美格鲁肽的剂量约为8.0mg。
206、在一些实施方案中,卡格列肽的剂量约为2.4mg,且司美格鲁肽的剂量约为12mg。
207、在一些实施方案中,卡格列肽的剂量约为3.4mg,且司美格鲁肽的剂量约为13.5mg。
208、在一些实施方案中,卡格列肽和司美格鲁肽以0.25mg的初始剂量每周施用一次,然后递增至0.5mg、1.0mg和1.7mg的后续给药水平,直至达到每周一次2.4mg的目标/维持剂量。
209、在一些实施方案中,每周一次施用0.25mg卡格列肽和司美格鲁肽,并且每四周递增至0.5mg、1.0mg和1.7mg的后续给药水平,直至达到每周一次2.4mg的目标/维持剂量。
210、在一些实施方案中,每周一次施用0.25mg卡格列肽和司美格鲁肽,并且每四周递增至0.5mg、1.0mg和1.7mg的后续给药水平,直至达到每周一次2.4mg的目标/维持剂量。
211、在一些实施方案中,每周一次施用0.25mg卡格列肽和0.25mg司美格鲁肽,持续四周(第0-3周),并且每四周递增至0.5mg卡格列肽和0.5mg司美格鲁肽(第4-7周)、1.0mg卡格列肽和1.0mg司美格鲁肽(第8-11周)以及1.7mg卡格列肽和1.7mg司美格鲁肽(第12-15周)的后续给药水平,直至达到每周一次2.4mg卡格列肽和2.4mg司美格鲁肽(第16周及之后)的目标/维持剂量。
212、在一些实施方案中,卡格列肽和司美格鲁肽以0.25mg的初始剂量每周施用一次,然后递增至0.5mg、1.0mg、1.7mg和2.4mg的后续给药水平,直至达到每周一次4.5mg的目标/维持剂量。
213、在一些实施方案中,卡格列肽和司美格鲁肽以0.25mg的初始剂量每周施用一次,然后递增至0.5mg、1.0mg、1.7mg、2.4mg、3.6mg和4.5mg的后续给药水平,直至达到每周一次7.2mg的目标/维持剂量。
214、在一些实施方案中,卡格列肽和司美格鲁肽以0.25mg的初始剂量每周施用一次,然后递增至0.5mg、1.0mg、1.7mg、2.4mg、3.6mg、4.5mg和7.2mg的后续给药水平,直至达到每周一次8.0mg的目标/维持剂量。
215、在一些实施方案中,卡格列肽和司美格鲁肽以0.25mg的初始剂量每周施用一次,然后递增至0.5mg、1.0mg、1.7mg、2.4mg、3.6mg、4.5mg、7.2mg和8.0mg的后续给药水平,直至达到每周一次16.0mg的目标/维持剂量。
216、在本文中,关于以数字或区间给出的具体值可被解释为具体值或近似值(例如,当某些量可以按重量提供时,具体值加减10%、15%或20%;例如,当测量ph时,加减0.4)。
217、以下是本发明实施方案的非限制性列表。
- 还没有人留言评论。精彩留言会获得点赞!