基于激活的抗原提呈细胞的核酸递送粒子、核酸递送系统及制备方法与流程
本公开涉及免疫治疗领域,尤其涉及一种基于激活的抗原提呈细胞的核酸递送粒子、核酸递送系统及制备方法。
背景技术:
1、信使rna(messenger rna,mrna)是由dna的一条链作为模板转录而来的、携带遗传信息能指导蛋白质合成的一类单链核糖核酸。理论上mrna可以指导合成任意编码的蛋白质,因而具有广泛的应用潜力。目前对mrna的研究主要集中在疫苗接种、蛋白质替代疗法和遗传疾病的治疗上。而且,mrna疫苗目前已被应用于预防covid-19。rna生物学、化学、稳定性和递送系统的技术进步加速了mrna疫苗的开发并且在动物模型中观察到有效、持久和安全的免疫反应。相比于传统疫苗,mrna疫苗能够同时激活机体细胞免疫和体液免疫,产生较强的免疫反应。然而,mrna的胞内递送较寡核苷酸困难,因为mrna分子量较大且极其不稳定,容易被rnase降解,因此合适的递送载体就极为关键,其不仅能保护mrna也有利于mrna成功进入胞内发挥作用。目前研究用于递送mrna的手段主要有rna共聚物、修饰的rna、病毒递送载体、聚合物递送载体、脂质递送载体等,其中发展最成熟的是脂质纳米颗粒(lipidnanoparticle,lnp)。但是,lnp递送mran也存在一些问题,比如无法有效制备稳定的冻干制剂,因而只能在-70℃或者-20℃储存几个月时间,因而需要的运输和储存条件比较苛刻。而且,lnp表面带正电荷,注射进入人体后容易吸附蛋白质和细胞,因而具有一定的毒副作用,而且,peg的使用使得其会在一定程度引起过敏反应。而且,lnp递送的mrna体内的表达效率和疗效也有待进一步提升。因而,目前亟需开发新型递送技术以更好实现mrna等核酸药物的递送。
技术实现思路
1、为解决上述技术问题,本公开提供了一种使用负载抗原组分的纳米粒子(np)或微米粒子(mp)激活过的抗原提呈细胞制备的核酸递送粒子、包含核酸递送粒子的核酸递送系统及其制备方法。本公开将核酸负载于纳米粒子或微米粒子内部,然后使用来源于激活的抗原提呈细胞和/或其分泌的细胞外囊泡的生物膜组分负载于纳米粒子或微米粒子表面,制备得到核酸递送粒子。本公开中核酸递送粒子的表面柔性有效提高,并解决了核酸递送时粒子归巢淋巴结、粒子靶向抗原提呈细胞以及粒子进入细胞后的溶酶体逃逸等问题,提高了递送系统递送核酸药物的效率,增加了核酸药物的功效。
2、本公开的第一个目的是提供一种核酸递送系统,其具有由粒子材料形成的骨架结构,所述骨架结构的内部负载有核酸,所述骨架结构的表面负载有生物膜组分;
3、其中,所述生物膜组分含有来源于激活的抗原提呈细胞和/或由所述激活的抗原提呈细胞分泌的细胞外囊泡;所述激活的抗原提呈细胞由抗原提呈细胞与抗原递送粒子共作用后得到,所述抗原递送粒子具有由粒子材料形成的骨架结构,以及负载于所述骨架结构的内部和/或表面负载有抗原组分。
4、在一些实施方案中,所述核酸递送粒子和所述抗原递送粒子彼此独立地选自纳米粒子或微米粒子。核酸递送粒子或抗原递送粒子的粒径大小为纳米级或微米级,这样能保证粒子被抗原提呈细胞吞噬。
5、进一步地,纳米粒子的粒径大小为1nm-1000nm,更优选地,粒径大小为30nm-1000nm,更优选地,粒径大小为50nm-600nm;更优选地,粒径大小为50-500nm;更优选地,粒径大小为100-400nm。示例性地,纳米粒子的粒径为10nm、50nm、100nm、200nm、210nm、220nm、230nm、240nm、250nm、260nm、270nm、280nm、290nm、300nm、310nm、320nm、330nm、340nm、350nm、400nm、500nm等等。
6、进一步地,微米粒子的粒径大小为1μm-1000μm,更优选地,粒径大小为1μm-100μm,更优选地,粒径大小为1μm-10μm,更优选地,粒径大小为1μm-5μm,更优选为1-10μm;更优选为1-2μm。示例性地,微米粒子的粒径为1μm、1.1μm、1.2μm、1.3μm、1.4μm、1.5μm、1.6μm、1.7μm、1.8μm、1.9μm、2μm、2.5μm、3μm、5μm、10μm等等。
7、在一些实施方案中,核酸递送粒子表面带有负电荷。
8、本公开所述核酸包括dna和rna。
9、本公开所述rna包括但不限于mrna、sirna、lcncrna等。
10、核酸递送粒子的表面电位为-150mv到-1mv。更优选为-50mv到-1mv;更优选为-20mv到-1mv。
11、在一些实施方案中,本公开所述抗原组分包含如下的至少一种:
12、(i)具有免疫原性的蛋白和/或多肽;
13、(ii)编码抗原的核酸。
14、在一些实施方案中,所述具有免疫原性的蛋白和/或多肽来源于如下(1),和任选存在的(2)-(3)中的至少一种;
15、(2)全细胞裂解物;其中,所述全细胞裂解物组分来源于肿瘤组织和/或肿瘤细胞;
16、(2)细菌裂解物;
17、(3)细胞外囊泡裂解物;其中,所述细胞外囊泡由细菌或肿瘤细胞分泌。
18、进一步地,所述全细胞裂解物包括如下的一种或两种:水溶性抗原的裂解物和非水溶性抗原的溶解物。在一些优选的实施方案中,所述全细胞裂解物中,所述非水溶性抗原的溶解物与所述水溶性抗原的裂解物混合的质量比为(0.1-10):(0.1-10);优选为(0.5-2):(0.5-2)。示例性地,非水溶性抗原的溶解物与所述水溶性抗原混合的质量比为1:1、0.5:1、0.8:1、1:1.2、1:1.5、1:2、2:1、3:1、4:1、5:1、1:3、1:4、1:5等等。
19、在一些实施方案中,具有免疫原性的蛋白和/或多肽来源于全细胞裂解物和细胞外囊泡裂解物。进一步地,所述细胞外囊泡裂解物选自癌细胞的细胞外囊泡裂解物和/或细菌的细胞外囊泡裂解物。所述全细胞裂解物与所述细胞外囊泡裂解物的质量比为(0.1-10):(0.1-10);优选为(0.5-2):(0.5-2)。示例性地,所述全细胞裂解物与所述细胞外囊泡裂解物的质量比为1:1、0.5:1、0.8:1、1:1.2、1:1.5、1:2、2:1、3:1、4:1、5:1、1:3、1:4、1:5等等。
20、在一些实施方案中,具有免疫原性的蛋白和/或多肽来源于全细胞裂解物和细菌裂解物。进一步地,所述全细胞裂解物与所述细菌裂解物的质量比为(0.1-10):(0.1-10);优选为(0.5-2):(0.5-2)。示例性地,所述全细胞裂解物与所述细菌裂解物的质量比为1:1、0.5:1、0.8:1、1:1.2、1:1.5、1:2、2:1、3:1、4:1、5:1、1:3、1:4、1:5等等。
21、在一些实施方案中,本公开所述抗原递送粒子还负载如下至少一种:
22、(iii)免疫佐剂;
23、(iv)带正电荷的物质,其选自带正电荷的氨基酸、带正电荷的多肽、带正电荷的脂质、带正电荷的蛋白质、带正电荷的聚合物,和/或带正电荷的无机物。
24、进一步的,所述核酸递送粒子由核酸递送前体粒子与生物膜组分共作用得到;
25、进一步地,所述核酸递送前体粒子和/或所述核酸递送粒子还负载如下至少一种:
26、(iii)免疫佐剂;
27、(iv)带正电荷的物质,其选自带正电荷的氨基酸、带正电荷的多肽、带正电荷的脂质、带正电荷的蛋白质、带正电荷的聚合物,和/或带正电荷的无机物。
28、在一些实施方案中,所述核酸递送粒子中,所述粒子材料、核酸与生物膜组分的质量比(mg:μg:μg)为1:(1-100):(10-300)。
29、进一步地,所述核酸递送粒子进一步包括免疫佐剂和带电荷的物质,所述粒子材料、核酸、免疫佐剂、带正电荷的物质与所述生物膜组分的质量比(mg:μg:μg:μg:μg)为1:(1-100):(1-200):(10-500):(10-300)。
30、在一些实施方案中,核酸递送粒子负载的生物膜组分进一步含有至少一种如下所示的组分:
31、(a)来源于全细胞裂解物的癌细胞膜组分;其中,所述全细胞裂解物组分来源于肿瘤组织和/或肿瘤细胞;
32、(b)来源与细胞外囊泡裂解物的细胞外囊泡膜组分,所述细胞外囊泡由细菌或肿瘤细胞分泌;
33、(c)来源于细菌裂解物的细菌膜组分。
34、在本公开中,细菌包括但不限于卡介苗、大肠杆菌、长双歧杆菌、短双歧杆菌、乳双歧杆菌、嗜酸乳杆菌、格式乳杆菌、罗伊氏乳杆菌、鼠李糖乳杆菌等。
35、在本公开中,免疫增强佐剂包括但不限于模式识别受体激动剂、卡介苗、卡介苗细胞壁骨架、卡介苗甲醇提取残余物、卡介苗胞壁酰二肽、草分枝杆菌、多抗甲素、矿物油、病毒样颗粒、免疫增强的再造流感病毒小体、霍乱肠毒素、皂苷及其衍生物、resiquimod、胸腺素、新生牛肝活性肽、米喹莫特、多糖、姜黄素、免疫佐剂cpg、免疫佐剂poly(i:c)、免疫佐剂poly iclc、短小棒状杆菌苗、溶血性链球菌制剂、辅酶q10、左旋咪唑、聚胞苷酸、锰佐剂、铝佐剂、钙佐剂、sting激动剂、细胞因子、白细胞介素、干扰素、聚肌苷酸、聚腺苷酸、明矾、磷酸铝、羊毛脂、角鲨烯、植物油、内毒素佐剂、脂质体佐剂、mf59、双链rna、双链dna、单链dna、caf01、人参有效成分、黄芪有效成分等。
36、进一步地,免疫增强佐剂选自两种或两种以上toll样受体激动剂。示例性地,免疫佐剂包括toll样受体3激动剂和toll样受体9激动剂中的至少一种。
37、进一步的,免疫增强佐剂包括(1)poly(i:c)和/或poly(iclc);(2)cpg-odn;其中,cpg-odn为a类cpg-odn、b类cpg-odn和c类cpg-odn中的至少一种;优选为至少两种,且至少其中一种为b类cpg-odn或c类cpg-odn。
38、本公开的上下文中,“cpg”或“cpg-odn”(cpg oligonucleotide,cpg寡脱氧核苷酸),是合成的含有非甲基化的胞嘧啶鸟嘌呤二核苷酸(cpg)的寡聚脱氧核苷酸(odn)。不同类型的cpg-odn的结构特征与免疫效应各有不同,一般分为a、b、c三类。
39、在一些实施方案中,cpg-odn包括但不限于:cpg 1018(b类)、cpg 7909(b类)、cpg2006(b类)、cpg-bw006(b类)、cpg 2395(c类)、cpg sl01、cpg 1585(a类)、cpg 2216(a类)、cpg sl03、cpg 2395(c类)、cpg m362(c类)、cpg 2336(a类)。
40、在本公开中,所述带正电荷的物质包括但不限于如下至少一种:带正电荷的氨基酸、带正电荷的多肽、带正电荷的脂质、带正电荷的蛋白质、带正电荷的高分子聚合物、带正电荷的无机物。示例性地,带正电荷的多肽包括但不限于含有精氨酸的多肽、含有组氨酸的多肽和/或组氨酸和/或赖氨酸的kala多肽、rala多肽、蜂毒肽等。
41、示例性地,带正电荷的氨基酸包括但不限于精氨酸、组氨酸、赖氨酸等。
42、示例性地,带正电荷的高分子聚合物包括但不限于聚精氨酸、聚赖氨酸、聚组氨酸等。
43、示例性地,带正电荷的脂质包括但不限于dotap等。
44、示例性地,带正电荷的蛋白质包括但不限于鱼精蛋白、组蛋白等。
45、示例性地,带正电荷的无机物包括但不限于nh4hco3、氢氧化铝等。
46、在一些实施方案中,所述带正电荷的物质包括蜂毒肽、rala多肽、kala多肽、r8多肽、精氨酸、组氨酸、赖氨酸、聚精氨酸、聚赖氨酸、聚组氨酸和nh4hco3中的任意一种或任意组合。
47、在一些实施方案中,抗原递送粒子和/或核酸递送粒子还负载有靶分子。所述靶分子包括如下至少一种:甘露糖、甘露聚糖、cd19抗体、cd20抗体、bcma抗体、cd32抗体、cd11c抗体、cd103抗体、cd44抗体等。
48、在本公开中,所述非水溶性抗原、所述细菌裂解物或所述细胞外囊泡裂解物彼此独立地溶解于包含如下至少一种溶解剂的的溶解液中:尿素、盐酸胍、脱氧胆酸盐、十二烷基硫酸盐、甘油、蛋白质降解酶、白蛋白、卵磷脂、triton、吐温、氨基酸、糖苷和胆碱;更优选地,所述溶质包括如下至少一种:尿素、脱氧胆酸钠、辛基葡萄糖苷和精氨酸。
49、在本公开中,所述细菌裂解物和/或细胞外囊泡裂解物经含有裂解剂的裂解液裂解细菌和/或细胞外囊泡得到;所述裂解剂选自尿素、盐酸胍、脱氧胆酸盐、十二烷基硫酸盐、甘油、蛋白质降解酶、白蛋白、卵磷脂、triton、吐温、多肽、氨基酸、糖苷和胆碱的水溶液中的一种或多种。
50、在本公开中,所述抗原提呈细胞包括b细胞、树突状细胞(dc)和巨噬细胞中的至少一种,优选为两种及以上,更优选为三种细胞的组合。
51、在本公开中,形成所述核酸递送粒子的粒子材料由天然高分子材料和/或合成高分子材料形成。
52、在本公开中,形成所述抗原递送粒子由天然高分子材料和/或合成高分子材料形成。
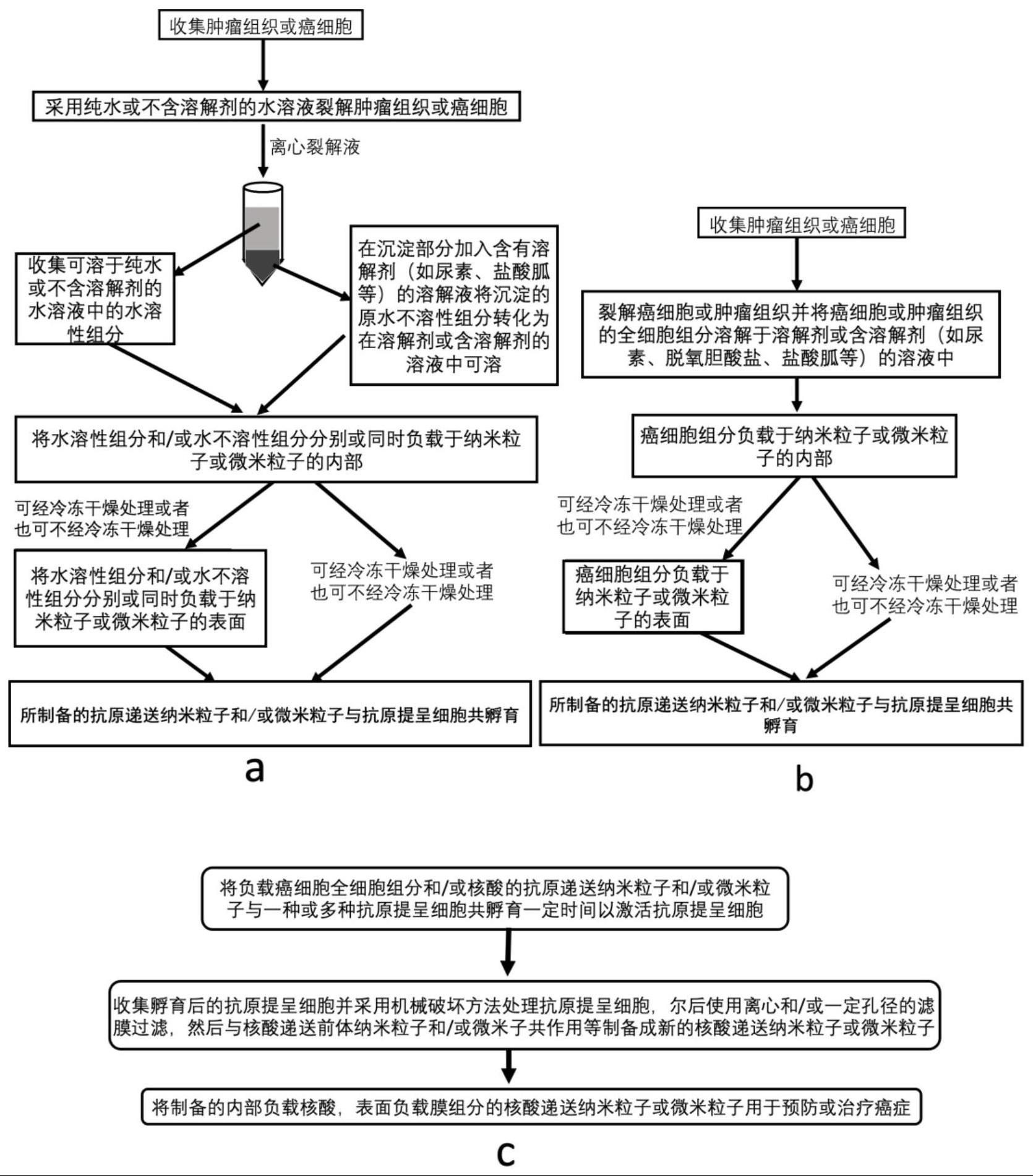
53、示例性地,有机合成高分子材料包括但不限于plga、pla、pga、peg、pcl、poloxamer、pva、pvp、pei、ptmc、聚酸酐、pdon、ppdo、pmma、聚氨基酸、合成多肽等。
54、示例性地,天然高分子材料包括但不限于卵磷脂、胆固醇、海藻酸盐、白蛋白、胶原蛋白、明胶、细胞膜成分、淀粉、糖类、多肽等。
55、示例性地,无机材料包括但不限于三氧化二铁、四氧化三铁、碳酸盐、磷酸盐等。
56、本公开所述的核酸递送粒子、核酸递送前体粒子和抗原递送粒子的形状为常见的任意形状,包括但不限于球形、椭球形、桶形、多角形、棒状、片状、线形、蠕虫形、方形、三角形、蝶形、圆盘形、囊泡形等。
57、在本公开中,所述激活的抗原提呈细胞由抗原提呈细胞与抗原递送粒子共孵育得到;其中,抗原递送粒子的表面和/或内部负载有抗原组分;其中,所述抗原递送粒子负载癌细胞和/或肿瘤组织的全细胞抗原组分和/或核酸;其中,全细胞抗原组分包含水溶性抗原组分和非水溶性抗原组分。
58、在本公开,所述抗原提呈细胞与抗原递送粒子的共孵育体系中可以包含细胞因子和/或抗体。
59、示例性地,细胞因子包括但不限于白介素2(il-2)、白介素7(il-7)、白介素14(il-14)、白介素4(il-4)、白介素15(il-15)、白介素21(il-21)、粒细胞-巨噬细胞集落刺激因子(gm-csf)、白介素17(il-17)、il-12、白介素12(il-12)、白介素6(il-6)、巨噬细胞集落刺激因子(m-csf)、白介素33(il-33)、γ干扰素(ifn-γ)、tnf-α。
60、示例性地,抗体包括但不限于cd80抗体、cd86抗体、αcd-3抗体、αcd-4抗体、αcd-8抗体、αcd-28抗体、αcd-40抗体、αox-40抗体、αox-40l抗体。
61、在本公开中,所述孵育体系中还包括如下至少一种:
62、(1)全细胞裂解物;其中,所述全细胞裂解物组分来源于肿瘤组织和/或肿瘤细胞;
63、(2)细菌裂解物;
64、(3)细胞外囊泡裂解物;其中,所述细胞外囊泡由细菌或肿瘤细胞分泌。
65、本公开中,将核酸负载于纳米粒子或微米粒子中,同时使用负载抗原组分的抗原递送粒子先特异性激活抗原提呈细胞,再将来源于激活的抗原提呈细胞和/或由其分泌的细胞外囊泡的生物膜组分负载于纳米粒子或微米粒子的表面,形成内部负载核酸、表面负载生物膜组分的核酸递送粒子。本公开提供的核酸递送例子可以有效归巢淋巴结,靶向抗原提呈细胞,能够提高核酸药物的递送效率及药物功效。核酸递送粒子在冷冻干燥后可在4℃下长期保存,不影响起药物功效。
66、本公开的第二个目的在于提供一种核酸递送系统,其包括本公开提供的核酸递送粒子。进一步地,核酸递送系统包含的核酸递送粒子可以相同或不同,能够实现对一种或多种核酸药物的体内递送,具有递送效率高、安全性高等优势,可发挥显著的药物预防或者治疗功效。
67、本公开的第三个目的在于提供了一种药物组合物,其包括本公开提供的核酸递送粒子或核酸递送系统。
68、在一些实施方案中,药物组合物还包括一种或多种药学上可接受的载体。
69、本公开提供的药物组合物,可通过核酸递送粒子或核酸递送系统实现高效的核酸递送,发挥显著的疾病预防或治疗效果。
70、本公开的第四个目的在于提供一种核酸疫苗,其包括本公开提供的核酸递送粒子或核酸递送系统。
71、本公开中的核酸递送粒子或核酸递送系统可以靶向抗原提呈细胞,有效激活机体的免疫应答反应,高效发挥核酸疫苗的预防或治疗效果。
72、本公开的第五个目的在于提供上述核酸递送粒子、核酸递送系统或药物组合物在如下(1)-(3)至少一项中的用途:
73、(1)预防或治疗疾病,或制备用于预防或治疗疾病的药物;
74、(2)在受试者中诱导免疫应答,或制备用于在受试者中诱导免疫应答的药物;
75、(3)作为或用于制备核酸疫苗。
76、在一些实施方案中,所述疾病为癌症或肿瘤;
77、在一些实施方案中,所述癌症或肿瘤为实体肿瘤或者血液瘤,所述实体肿瘤或血液瘤包括但不限于鳞状细胞癌、骨髓瘤、小细胞肺癌、非小细胞肺癌、神经胶质瘤、肝细胞癌(hcc)、霍奇金淋巴瘤、非霍奇金淋巴瘤、t细胞淋巴瘤、急性髓性白血病(aml)、多种骨髓瘤、胃肠(道)癌、肾癌、卵巢癌、肝脏癌、淋巴母细胞白血病、淋巴细胞白血病、结肠癌、直肠癌、子宫内膜癌、肾癌、前列腺癌、甲状腺癌、黑色素瘤、软骨肉瘤、神经母细胞瘤、胰腺癌、多形性胶质母细胞瘤、宫颈癌、脑癌、胃癌、膀胱癌、肝癌、乳腺癌、结肠癌和头颈癌。
78、本公开中,用于形成生物膜组分的抗原提呈细胞,与抗原组分来源于受试者、细胞系或由干细胞转化形成。进一步地,抗原提呈细胞与抗原组分来源的受试者为同一个体或同种异体。
79、本公开中,抗原组分来源于所述疾病相关的细胞或组织。进一步地,抗原组分来源于癌细胞和/或肿瘤组织的全细胞抗原组分。
80、本公开的第六个目的在于提供上述核酸递送粒子的制备方法,其包括如下步骤:
81、s1,将抗原提呈细胞与抗原递送粒子共孵育,得到激活的抗原提呈细胞;其中,抗原递送粒子的表面和/或内部负载有抗原组分;
82、s2,制备内部负载核酸的核酸递送前体粒子;
83、s3,将生物膜组分负载于所述核酸递送前体粒子的表面,得到核酸递送粒子;其中,所述生物膜组分来源于所述激活的抗原提呈细胞,或来源于由所述激活的抗原提呈细胞分泌的细胞外囊泡。
84、在一些实施方案中,所述将生物膜组分负载于所述核酸递送前体粒子的表面包括:
85、s31,将激活的抗原提呈细胞经过机械破坏,收集生物膜组分;
86、s32,将所述收集生物膜组分与核酸递送前体粒子共作用,得到核酸递送粒子。
87、进一步地,在步骤s31中,将激活的抗原提呈细胞经过机械破坏,经膜过滤或梯度离心,收集生物膜组分。
88、示例性地,所述机械破坏包括但不限于超声、均质化、挤出、匀浆、高速搅拌、高压破坏、高剪切力破坏、溶胀、化学物质、皱缩中的一种或多种。
89、示例性地,所述共作用包括但不限于共孵育、共挤出、超声、搅拌、透析、超滤、均质化和匀浆中的一种或多种。
90、在一些实施方案中,所述抗原递送粒子的制备步骤包括:
91、分别制备负载水溶性抗原的递送粒子,以及负载非水溶性抗原的溶解物的递送粒子,混合两种递送粒子,得到所述抗原递送粒子;或者,混合所述水溶性抗原和非水溶性抗原的溶解物,得到混合后的抗原组分;利用所述混合后的抗原组分,制备所述抗原递送粒子;或者,使用含有溶解剂的溶解液同时溶解水溶性抗原和非水溶性抗原,并利用所述混合抗原组分制备所述抗原递送粒子。
92、在一些实施方案中,所述抗原组分的制备步骤包括:
93、s11,在水或不含溶解剂的溶解液中裂解目标细胞和/或目标组织,离心;得到的上清液为水溶性抗原组分,沉淀为非水溶性抗原组分;
94、s12,将所述沉淀溶解于含有溶解剂的溶解液中,然后与水溶性抗原组分合并,得到来源于目标细胞和/或目标组织的抗原组分。
95、示例性地,目标细胞为癌细胞,目标组织为肿瘤组织,癌细胞为一种或一种以上,肿瘤组织为一种或者一种以上。
96、进一步地,所述在水或不含溶解剂的溶解液中裂解目标细胞和/或目标组织的步骤包括:将目前细胞和/或目标组织在-20℃~-273℃下冷冻,加水或不含溶解剂的溶液后进行反复冻融裂解。
97、在一些实施方案中,所述抗原组分的制备步骤包括:使用含有溶解剂的溶解液裂解并同时溶解目标细胞和/或目标组织织中的水溶性组分和非水溶性组分,得到抗原组分。
98、示例性地,目标细胞为癌细胞,目标组织为肿瘤组织,癌细胞为一种或一种以上,肿瘤组织为一种或者一种以上。
99、示例性地,溶解剂包括但不限于尿素、盐酸胍、脱氧胆酸盐、十二烷基硫酸盐(如sds)、甘油、蛋白质降解酶、白蛋白、卵磷脂、无机盐(0.1-2000mg/ml)、triton、吐温、多肽、氨基酸、糖苷、胆碱中的至少一种。
100、本公开突破现有核酸递送技术的限制,使粒子上负载核酸药物的同时负载有细胞全细胞抗原表位和/或核酸所表达的蛋白质或多肽的抗原表位,以及来源于激活的抗原提呈细胞的生物膜组分或其分泌的细胞外囊泡的生物膜组分,能够更有效的发挥核酸药物的功能。
101、借由上述方案,本公开至少具有以下优点:
102、mrna等核酸药物目前主要使用脂质纳米粒(lnp)技术递送,但是lnp为带正电荷的纳米粒子,极易吸附带负电的蛋白质或者细胞,因而细胞毒性较大。而且,peg等物质的引入使得lnp易引起过敏反应。本公开提供了一种使用纳米级或微米级粒子递送核酸药物的技术,既能高效负载核酸药物,也能归巢淋巴结和靶向淋巴结内的抗原提呈细胞,从而在降低毒副作用的同时提高了核酸药物的疗效,本公开中的核酸递送粒子可以用于预防和治疗癌症等疾病的核酸药物的递送。而且,本公开所述核酸递送粒子表面带负电,所以降低了递送系统吸附带负电的蛋白质或多肽所引发的毒副作用。而且,本公开所述的核酸递送粒子可以冷冻干燥后长期储存备用,克服了lnp目前无法冷冻干燥以及长期储存的问题。
103、上述说明仅是本公开技术方案的概述,为了能够更清楚了解本公开的技术手段,并可依照说明书的内容予以实施,以下以本公开的较佳实施例并配合详细附图说明如后。
- 还没有人留言评论。精彩留言会获得点赞!