一种纳米靶向载药胶束及其制备方法和应用与流程
本发明涉及药物制剂,尤其是涉及一种纳米靶向载药胶束及其制备方法和应用。
背景技术:
1、随着纳米生物技术的发展,多功能智能型聚合物纳米颗粒越来越受到人们的重视,特别是在癌细胞治疗领域,多功能智能纳米载体作为一种新型药物载体已经广泛应用到靶向载药领域,并且具有较好的发展前景。智能纳米载体将药物选择性传递到特定的靶点后,被化学信号或温度或ph等“触发器”激发后,能响应性地释放被负载药物,这种纳米载体可分为主动靶向载体和被动靶向载体。
2、主动靶向载体因其靶向性较强、毒副作用小等优点,越来越受到医药界的重视。例如透明质酸是一种高分子的聚合物。是由单位d-葡萄糖醛酸及n-乙酰葡糖胺组成的高级直链粘多糖;其具有独特理化性质和生理功能,已经在医学、生物材料方面得到了广泛应用。细胞表面受体多样,选择合适的受体及其配体是实现药物主动勒向的关键,cd44是研究比较广泛的细胞表面受体,在肿瘤的发生、发展方面具有重要的作用。
3、虽然纳米聚合物药物载体已经被证明在传递抗肿瘤药物方面具有极大的发展前景,但是目前仍存在很多的不足,如目前使用的大部分载体作用单一,只是起到包载的作用,载药稳定性差,大部分只是靠被动运输富集在肿瘤部位,这些缺点极大的限制了聚合物纳米载体在临床上的应用。
技术实现思路
1、本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明第一方面提出一种纳米靶向载药胶束,通过透明质酸具有主动靶向,能够更好的富集在肿瘤周围并进入肿瘤细胞,同时靶向信号肽能够诱导纳米光敏剂靶向内质网,通过光动力治疗产生ros,产生内质网应激,在杀伤肿瘤的同时,诱导肿瘤免疫原性死亡(icd)效应,激活肿瘤免疫,改善免疫抑制微环境,实现颗粒的光动力/免疫协同治疗。同时ce6的近红外光学特性能够实现纳米颗粒的体内实时追踪实现诊疗一体化。
2、本发明第二方面还提供一种纳米靶向载药胶束的制备方法。
3、本发明第三方面还提供一种抗肿瘤药物。
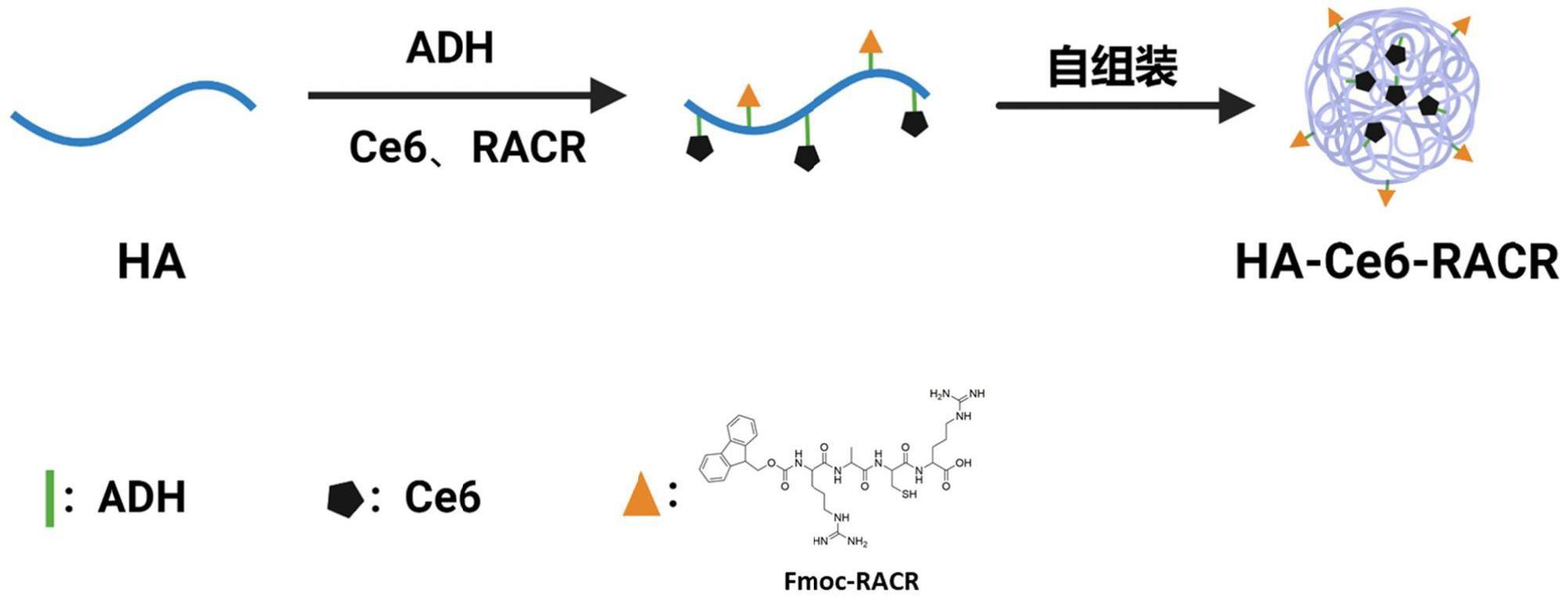
4、根据本发明的第一方面实施例提供的一种纳米靶向载药胶束,所述纳米靶向载药胶束为核壳结构,所述内核为通过己二酰肼基团连接在所述透明质酸直链上的二氢卟吩e6基团;所述外壳为透明质酸;所述外壳的外表面还有通过己二酰肼基团连接在所述透明质酸直链上的内质网靶向信号肽。
5、根据本发明实施例的纳米靶向载药胶束,至少具有如下有益效果:
6、本发明通过过己二酰肼基团将二氢卟吩e6基团和内质网靶向信号肽连接到透明质酸的骨架中,形成核壳结构,疏水性二氢卟吩e6基团为内核,透明质酸为壳,而内质网靶向信号肽连接在壳的外表面。使得其具有主动靶向、免疫抑制微环境改善、免疫治疗及光动力诊疗一体化。由于内质网靶向信号肽在纳米靶向载药胶束的外表面,能有效的诱导纳米光敏剂二氢卟吩e6在内质网聚集,并通过近红外激光照射与二氢卟吩e6配合产生内质网应激,在杀伤肿瘤的同时,诱导肿瘤免疫原性死亡(icd)效应,激活肿瘤免疫,改善免疫抑制微环境实现免疫与光动力的协同抗肿瘤功能。
7、免疫原性细胞死亡(immunogenic cell death,icd)是刺激抗癌免疫应答、增强免疫治疗效果的重要调节类型。通过引起肿瘤icd效应,激活肿瘤原位的免疫细胞已成为最有潜力的癌症治疗策略。
8、本发明通过活性氧(ros)的过度表达引起的内质网(er)应激能够有效地诱导免疫原性细胞死亡(icd),从而达到改善肿瘤免疫抑制微环境。
9、根据本发明的一些实施例,所述二氢卟吩e6基团、内质网靶向信号肽和透明质酸的质量比为(0.2~3):(0.1~3):1。
10、根据本发明的一些实施例,所述纳米靶向载药胶束的平均粒径为50nm~200nm。这粒径大小的纳米颗粒更有利于进入细胞实现其生物特性。
11、根据本发明的一些实施例,所述内质网靶向信号肽为fmoc-racr(精氨酸-丙氨酸-半胱氨酸-精氨酸)多肽。
12、根据本发明的一些实施例,所述透明质酸的重均分子量为10k~100k。透明质酸具有良好的的生物相容性,可生物降解并通过正常的生理途径吸收或排出体外;透明质酸具有主动靶向肿瘤细胞的功能,并且在肿瘤微环境中富含大量的透明质酸酶,通过降解透明质酸链控制抗癌药物在肿瘤部位的缓慢释放。
13、根据本发明的第二方面实施例提供的一种纳米靶向载药胶束的制备方法,包括如下步骤:
14、s1、采用己二酰肼(adh)在酸性水溶液中对透明质酸进行化学修饰,得到ha-adh衍生物;
15、s2、将ha-adh衍生物、用1-(3-二甲氨基丙基)-3-乙基碳二亚胺(edc)和n-羟基琥珀酰亚胺(nhs)活化之后的二氢卟吩e6和内质网靶向信号肽和溶剂混合进行反应,待反应结束后,将反应后的溶液透析处理,得到所述纳米靶向载药胶束。
16、根据本发明的一些实施例,所述溶剂选自甲酰胺、dmf或dmso中的至少一种。。
17、根据本发明的一些实施例,所述采用己二酰肼在酸性水溶液中对透明质酸进行化学修饰的方法如下:
18、将所述己二酰肼加入透明质酸溶液中后,将水溶液的ph值调至4.5~4.8,加入缩合剂,保持ph值为4.5~4.8,使得所述己二酰肼与透明质酸进行缩合反应。
19、根据本发明的一些实施例,所述缩合剂为1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)、1,3-二环己基碳二亚胺(dcc)。
20、根据本发明的一些实施例,步骤s2中,所述反应的温度为室温即可。
21、根据本发明的一些实施例,步骤s2中,反应时间应该至少要保证反应物充分反应完毕,如可以是搅拌反应24小时。
22、本发明第三方面提供一种抗肿瘤药物,包括疏水性抗癌药物和负载所述疏水性抗癌药物的载体,所述载体为上述所述的纳米靶向载药胶束,且所述疏水性抗癌药物负载在所述纳米载药胶束的疏水性内核中。
23、本发明的透明质酸修饰疏水二氢卟吩e6基团和内质网靶向信号肽形成纳米靶向胶束,能很好的包裹疏水性抗癌药物形成稳定、粒径可控、具有联合治疗功能的纳米级载药胶束,同时能增加疏水性抗癌药物的水溶性,降低毒性及特异性靶向并增强载药胶束体内循环的半衰期。
24、根据本发明的一些实施例,所述疏水性抗癌药物与载体的质量比为(0.1~0.5):1。
25、根据本发明的一些实施例,所述疏水性抗癌药物为阿霉素、紫杉醇或喜树碱中的至少一种。
26、根据本发明的一些实施例,上述疏水性抗癌药物只需将上述纳米靶向载药胶束与疏水性抗癌药物溶解于有机溶剂中,实现疏水性抗癌药物的自动负载,其制备方法工艺简单,且条件可控,良品率高,而且药物粒径可控。
27、根据本发明的一些实施例,上述纳米靶向载药胶束和疏水性抗癌药物溶解于有机溶剂后,纳米载药胶束的浓度优选为10~500g/l,疏水性抗癌药物的浓度范围为1~100g/l。
28、本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。
- 还没有人留言评论。精彩留言会获得点赞!