一种临床试验数据监控方法、系统和电子设备与流程
本发明涉及计算机,尤其涉及一种临床试验数据监控方法、系统和电子设备。
背景技术:
1、在临床试验实际开展过程中,由于临床试验数据的记录、整理汇总、监查、分析都是基于手工记录、纸质或简单电子文档形式存储,难以确定数据记录人员真实身份,基本无法追溯难以追溯数据记录及修改过程,容易出现数据记录不及时、伪造数据的情况。其次,在临床试验数据收集过程中,对于数据的合理性检查存在滞后性,在发现数据有误后溯源时,很可能由于时效性问题错过纠正机会,无法订正错误数据,进而导致临床试验结果准确度降低;再者,需要对临床试验数据进行分析汇总,才可以确定临床试验的中止和结束,耗费较大人力、物力、财力和时间。
2、因此,提出一种临床试验数据监控方法、系统和电子设备。
技术实现思路
1、本说明书提供一种临床试验数据监控方法、系统和电子设备,通过临床试验数据预处理模块对上传临床试验数据的上传者进行身份认证并且记录数据的收集和修改过程,通过临床试验约束模块及时发现异常反应并予以提醒,通过临床试验结果分析模块监控所述当前临床试验的试验进度,提高临床试验结果的可靠性。
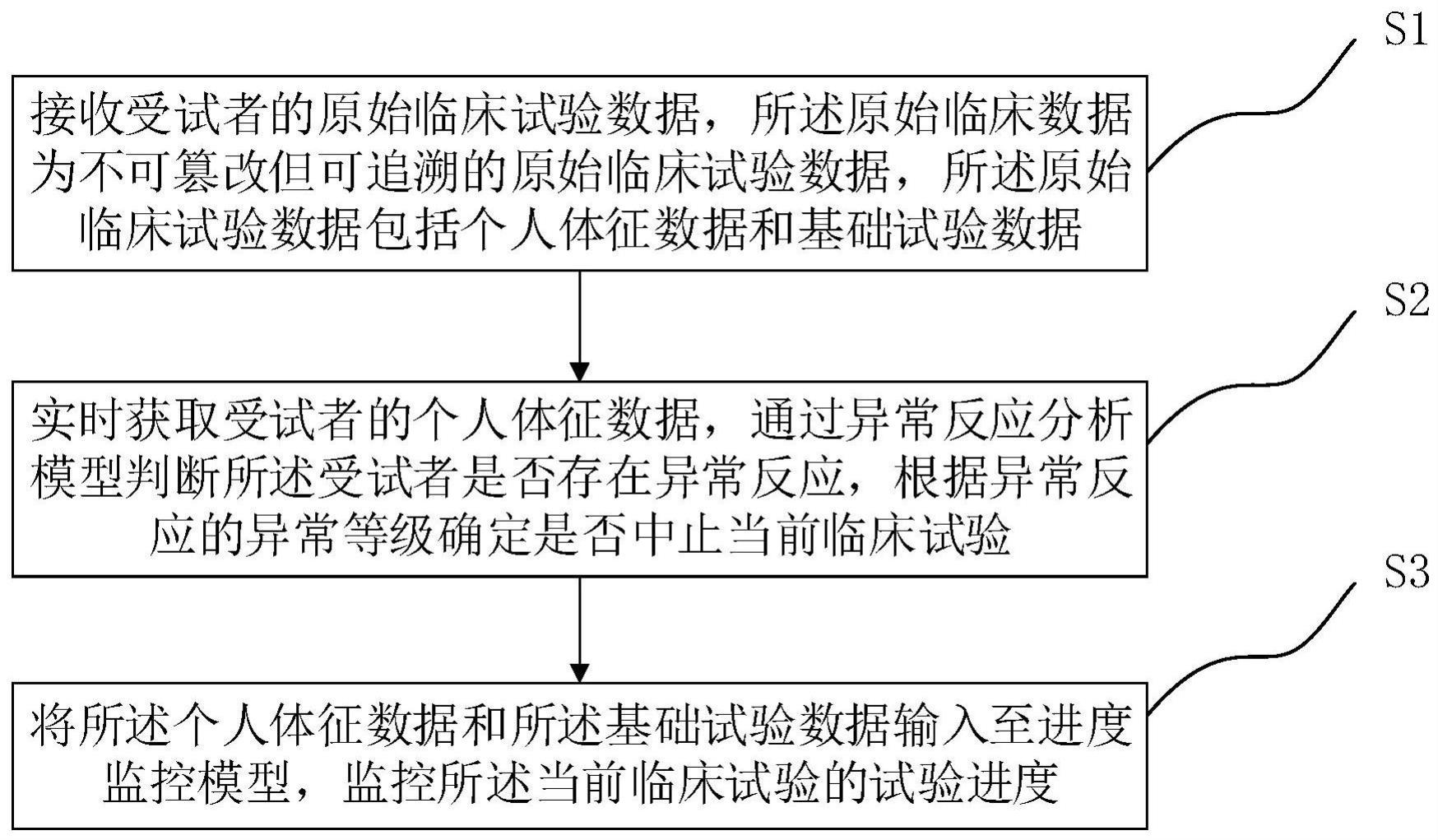
2、本技术提供的一种临床试验数据监控方法采用如下的技术方案,包括:
3、接收受试者的原始临床试验数据,所述原始临床数据为不可篡改但可追溯的原始临床试验数据,所述原始临床试验数据包括个人体征数据和基础试验数据;
4、实时获取受试者的个人体征数据,通过异常反应分析模型判断所述受试者是否存在异常反应,根据异常反应的异常等级确定是否中止当前临床试验;
5、将所述个人体征数据和所述基础试验数据输入至进度监控模型,监控所述当前临床试验的试验进度。
6、可选的,所述接收受试者的原始临床试验数据,所述原始临床试验数据包括个人体征数据和基础试验数据,包括:
7、接收所述受试者的个人体征数据;
8、通过数据校验模型对所述基础试验数据进行合理性校验,基于校验结果接收所述受试者的基础试验数据。
9、可选的,所述通过数据校验模型对所述基础试验数据进行合理性校验,基于校验结果接收所述受试者的基础试验数据,包括:
10、接收上传者发送的上传请求;
11、对所述上传者进行身份认证;
12、基于认证结果接收所述上传者上传的基础试验数据,判断所述基础试验数据是否符合所述预设分析条件,根据判断结果接收所述基础试验数据。
13、可选的,所述接收受试者的原始临床试验数据,所述原始临床试验数据包括个人体征数据和基础试验数据,还包括:
14、接收所述上传者发送的修改请求,确定所述上传者的修改权限;
15、所述接收所述上传者发送的修改请求,确定所述上传者的修改权限,包括:
16、接收所述上传者的修改请求,所述修改请求包括预修改的基础试验数据;
17、根据所述预修改的基础试验数据的录入类型,判断是否需要填写修改理由;
18、获取所述预修改的基础试验数据的修改理由,对基础试验数据进行更新。
19、可选的,所述实时获取受试者的个人体征数据,通过异常反应分析模型判断所述受试者是否存在异常反应,根据异常反应的异常等级确定是否中止当前临床试验,包括:
20、实时调取并记录所述受试者的个人体征数据;
21、判断所述受试者的个人体征数据是否超过预设观测阈值,若是,确定所述受试者的异常反应的异常等级;
22、根据异常反应的异常等级发出警告。
23、可选的,所述根据异常反应的异常等级发出警告,包括:
24、当所述异常反应的异常等级为严重时,中止所述临床试验,发出中止警告,所述中止警告包括暂停基础试验数据的录入和暂停基础试验数据的修改;
25、当中止所述临床试验时,获取人工审核结果,确定是否继续进行所述当前临床试验。
26、可选的,所述将所述个人体征数据和所述基础试验数据输入至进度监控模型,监控所述当前临床试验的试验进度,包括:
27、汇总各受试者的原始临床试验数据,更新临床试验结果;
28、判断所述临床试验结果是否达到预设临床试验结束条件,若是,则发出预结束通知。
29、本技术提供的一种临床试验数据监控系统采用如下的技术方案,包括:
30、临床试验数据接收模块,用于接收受试者的原始临床试验数据,所述原始临床数据为不可篡改但可追溯的原始临床试验数据,所述原始临床试验数据包括个人体征数据和基础试验数据;
31、临床试验约束模块,用于实时获取受试者的个人体征数据,通过异常反应分析模型判断所述受试者是否存在异常反应,根据异常反应的异常等级确定是否中止当前临床试验;
32、临床试验结果分析模块,用于将所述个人体征数据和所述基础试验数据输入至进度监控模型,监控所述当前临床试验的试验进度。
33、可选的,所述临床试验数据接收模块,包括:
34、第一接收子模块,用于接收所述受试者的个人体征数据;
35、第二接收子模块,用于通过数据校验模型对所述基础试验数据进行合理性校验,基于校验结果接收所述受试者的基础试验数据。
36、可选的,所述临床试验数据接收模块,还包括:
37、修改子模块;用于接收所述上传者发送的修改请求,确定所述上传者的修改权限;
38、所述修改子模块,包括:
39、修改请求单元,用于接收所述上传者的修改请求,所述修改请求包括预修改的基础试验数据;
40、修改理由判断单元,用于根据所述预修改的基础试验数据的录入类型,判断是否需要填写修改理由;
41、修改理由补充单元,用于获取所述预修改的基础试验数据的修改理由,对基础试验数据进行更新。
42、可选的,所述临床试验约束模块,包括:
43、用于获取所述受试者的个人体征数据,通过对获取到的所述个人体征数据进行检测,判断所述异常反应的异常等级;
44、异常反应处理子模块,用于根据异常反应的异常等级发出警告。
45、可选的,所述检测子模块,包括:
46、个人体征数据获取单元,用于实时调取并记录所述受试者的个人体征数据;
47、检测单元,用于判断所述受试者的个人体征数据是否超过预设观测阈值,若是,确定所述受试者的异常反应的异常等级。
48、可选的,所述异常反应处理子模块,包括:
49、第一处理单元,用于当所述异常反应的异常等级为严重时,中止所述临床试验,发出中止警告,所述中止警告包括暂停基础试验数据的录入和暂停基础试验数据的修改;
50、第二处理单元,用于当中止所述临床试验时,获取人工审核结果,确定是否继续进行所述当前临床试验。
51、可选的,所述临床试验结果分析模块,包括:
52、实时汇总子模块,用于汇总各受试者的原始临床试验数据,更新临床试验结果;
53、试验结果分析子模块,用于判断所述临床试验结果是否达到预设临床试验结束条件,若是,则发出预结束通知。
54、可选的,还包括:核查模块,用于提供各个所述受试者的原始临床试验数据的查看入口。
55、可选的,还包括:临床试验用品管理模块;
56、所述临床试验用品管理模块,包括:
57、临床试验用品记录子模块,用于实时获取临床试验用品的使用记录;
58、临床试验用品补充子模块,用于记录所述临床试验用品的剩余量,当所述临床试验用品的剩余数量达到预设补充阈值时,发送临床试验用品的补充申请;
59、所述临床试验用品包括临床试验药物和药用器械。
60、本说明书还提供一种电子设备,其中,该电子设备包括:
61、处理器;以及,
62、存储计算机可执行指令的存储器,所述可执行指令在被执行时使所述处理器执行上述任一项方法。
63、本说明书还提供一种计算机可读存储介质,其中,所述计算机可读存储介质存储一个或多个程序,所述一个或多个程序当被处理器执行时,实现上述任一项方法。
64、本发明通过接收受试者的原始临床试验数据,所述原始临床试验数据包括个人体征数据和基础试验数据,避免录入的基础试验数据存在质量化差异,保证数据的真实性;通过实时获取受试者的个人体征数据,通过异常反应分析模型判断所述受试者是否存在异常反应,根据异常反应的异常等级确定是否中止当前临床试验,以便于对异常反应时间予以及时发现和处理;通过将所述个人体征数据和所述基础试验数据输入至进度监控模型,监控所述当前临床试验的试验进度,节省了人力、物力、时间成本。
- 还没有人留言评论。精彩留言会获得点赞!