一种靶向性脂质体纳米药物及其制备方法和应用
本发明涉及脂质体纳米药物制备,具体涉及一种靶向性脂质体纳米药物及其制备方法和应用。
背景技术:
1、近年来,急性心肌梗死(acute myocardial infarction,ami)的发病率呈现明显上升的趋势。心肌细胞不可再生,ami导致心肌细胞死亡后只能进行瘢痕修复,这会对心功能会造成不可逆转的损伤,严重者可导致心力衰竭。因此,探索ami后心脏修复机制,寻找早期干预策略具有重要意义。ami后的心脏修复主要分为三个阶段:炎症期、修复期和成熟期。其中炎症期是损伤心脏愈合的先决条件,炎症期时间过长、幅度过高都会导致不良的心室重构。白介素-1β(interleukin-1β,il-1β)是调节心脏炎症和修复的关键细胞因子,而il-1β需要被炎性小体裂解才有活性。nlrp3炎性小体是由nod样受体热蛋白结构域相关蛋白3(nod-like receptor thermal protein domain associated protein 3,nlrp3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,asc)和前体天冬氨酸蛋白水解酶-1(pro-cysteinyl aspartate-specific proteases-1,pro-caspase-1)组成的复合物。ami发生后,nlrp3蛋白募集asc和pro-caspase-1组成nlrp3炎性小体,促进il-1β的成熟和分泌,从而引起炎症反应。nlrp3炎性小体的活化主要发生在免疫细胞(如巨噬细胞)中,已有研究证实nlrp3炎性小体参与ami、动脉粥样硬化等疾病的病理进程。冬凌草甲素(oridonin,ori)是从中药冬凌草甲素中提取的活性成分,可以与nlrp3蛋白的nacht结构域特异性的共价结合,从而阻断nlrp3炎性小体的激活,可以用作nlrp3炎性小体的抑制剂。但ori的疏水性太强限制了其进一步的使用,因此,如何提高向ami后心梗部位的药物递送效率是基于该抗炎疗法的关键。ami发生后招募的巨噬细胞亚群分泌生长因子,该生长因子会激活肌成纤维细胞,肌成纤维细胞分泌大量细胞外基质蛋白,其中包括fn和纤维胶原,用于保护心室结构。基于心梗后肌成纤维细胞过表达纤连蛋白(fibronectin,fn)的特点,以及多肽半胱氨酸-精氨酸-谷氨酸-赖氨酸-丙氨酸(cys-arg-glu-lys-ala,creka)对fn的特异性靶向能力,构建了一种可以靶向心梗区域的纳米载体,用于向心梗区域靶向递送ori。
2、如今,纳米技术的飞速发展已经在疾病治疗中展现了惊人的一面,利用纳米载体可以实现药物向靶标的可控释放和生物利用度的增强等。脂质体、聚合物纳米颗粒、胶束等都是目前广泛研究的纳米载体,这些纳米载体具有毒性小、从宿主免疫系统逃逸能力、良好的生物相容性、非免疫原性和药物靶向特性。比如,公开号为cn 113262203 a的专利申请文件就公开了一种抗阿尔茨海默症的自组装纳米药物脂质体,其将疏水性抗炎药溶于无水乙醇,加入水中,剧烈搅拌,得到自组装疏水性抗炎纳米粒药物;将二油酰基磷脂酰胆碱、二硬脂酰磷脂酰胆碱、胆固醇、t7肽-聚乙二醇-磷脂酰乙醇胺溶于三氯甲烷中,成溶液,将溶液加入到三氯甲烷中,减压蒸馏,形成薄膜,继续旋蒸,加入自组装疏水性抗炎纳米粒药物,将薄膜分散下来,探超,得抗阿尔茨海默症的自组装纳米药物脂质体。该发明制得的纳米粒径在100~150nm,利用t7肽作为靶向物质,将抗炎纳米粒药物运送至与血脑屏障上的转铁蛋白受体,与转铁蛋白受体tfr特异性结合,从而实现靶向抗炎治疗。
3、因此,纳米医学靶向药物递送在心血管疾病中同样也具有极大的潜力,但是急性心肌梗死毕竟是与阿尔茨海默症疾病位于不同人体位置的疾病,其对药物的要求截然不同,在靶向多肽的选择上也不相同。此外,要将药物运送至nlrp3炎性小体,需要更小尺寸的纳米颗粒(100纳米以下)才可以穿过生物膜、细胞和组织到达目标位置,现有技术无法实现该功能。
技术实现思路
1、针对现有技术中的上述问题,本发明提供一种靶向性脂质体纳米药物及其制备方法和应用,以解决现有技术提供的靶向性脂质体纳米药物无法到达心梗区域并调控ami炎症进展的技术问题。
2、本发明采用的技术方案如下:
3、一种靶向性脂质体纳米药物,所述靶向性脂质体纳米药物采用薄膜分散法制得,靶向性脂质体纳米药物的粒径为60~80nm,由内层抗炎药物ori和含有靶向多肽creka的脂质体外层组成。
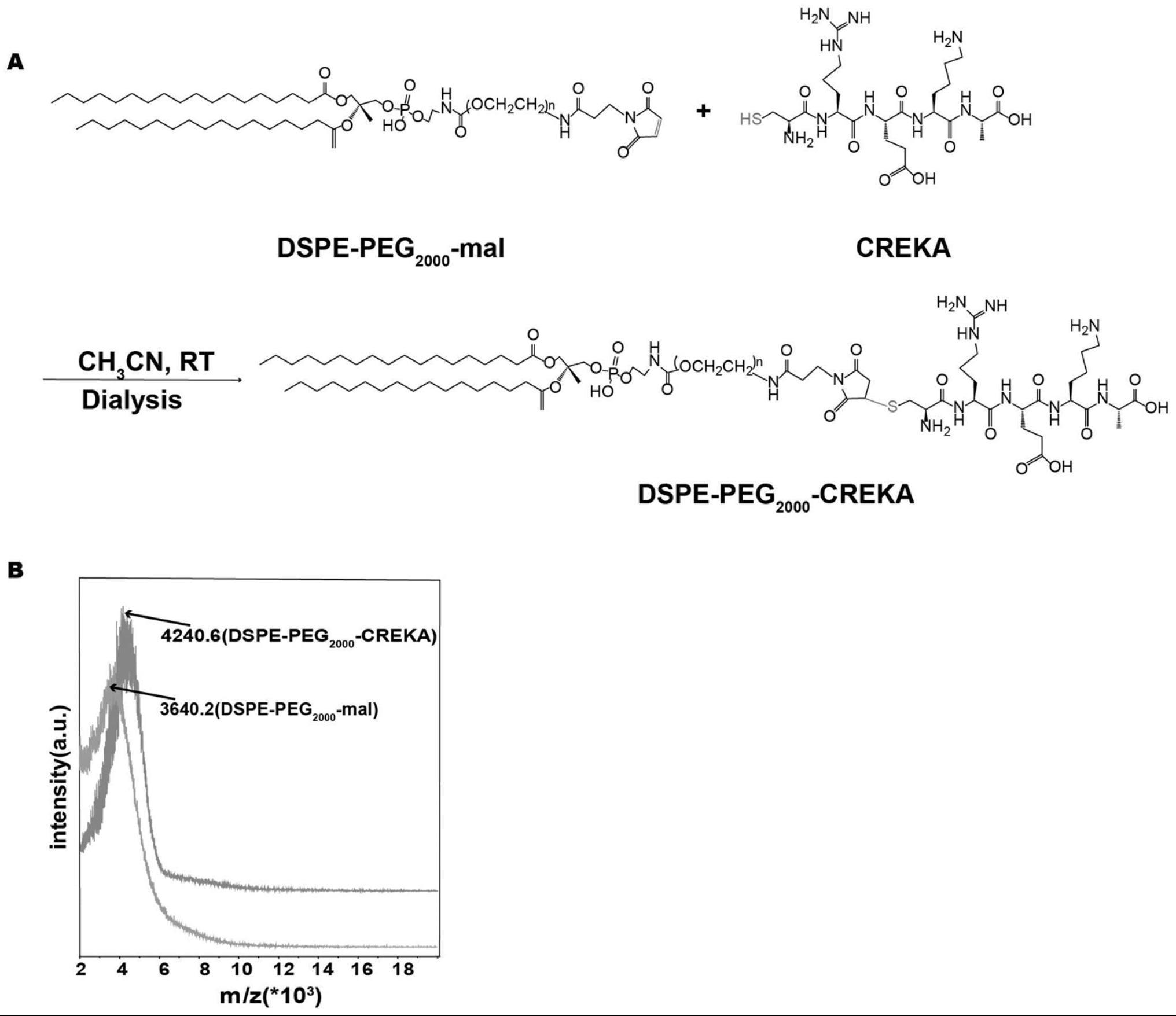
4、作为优选地,所述脂质体外层包括由靶向多肽creka和dspe-peg2000连接形成的dspe-peg2000-creka、胆固醇、卵磷脂,所述卵磷脂为提取自蛋黄的卵磷脂,所述胆固醇和卵磷脂投料摩尔比为1:4,所述creka和dspe-peg2000的摩尔比为1:2,所述dspe-peg2000-creka的摩尔比占脂质体外层总物质的5%。
5、靶向性脂质体纳米药物的制备方法,具体步骤如下:
6、(1)将靶向多肽creka和dspe-peg2000连接形成带有靶向功能的dspe-peg2000-creka;
7、(2)成膜:将胆固醇、卵磷脂、dspe-peg2000-creka和ori投入茄形瓶中,并加入有机溶剂形成有机相,随后使用旋转蒸发仪除去有机相,在反应瓶内壁形成一层薄膜;
8、(3)分散:在茄形瓶中加入水相使薄膜分散进水相中;
9、(4)分离:12000rpm离心15min取沉淀,再重悬成目标浓度的溶液,随后采用探头超声和脂质体挤出器得到均匀分散的脂质体。
10、进一步地,步骤(2)中,所述有机溶剂为体积比1:1的三氯甲烷和甲醇,有机相中dspe-peg2000-creka、胆固醇、卵磷脂溶质总浓度为1~10mg/ml。
11、进一步地,步骤(3)中,所述水相为去离子水或磷酸盐缓冲液,进水相时体系处于非真空状态。
12、进一步地,步骤(4)中,探头超声功率为120w,超声时间为1min。
13、进一步地,步骤(4)中,脂质体挤出器的挤出条件为将溶液依次通过400nm、200nm和100nm聚碳酸酯多孔膜,每个聚碳酸酯多孔膜来回重复通过10~30次。
14、靶向性脂质体纳米药物在作为体外抑制nlrp3炎性小体药物中的应用。
15、靶向性脂质体纳米药物在作为治疗受损心脏的药物中的应用。
16、靶向性脂质体纳米药物在作为改善心功能的药物中的应用。
17、综上所述,相比于现有技术,本发明具有如下优点及有益效果:
18、1、本发明制备的靶向性脂质体纳米药物clo具有良好的生物相容性,能通过creka-fibronectin靶向与缓解急性心肌梗死后炎症损伤相结合,有效地提高了纳米药物在受损心肌区域的富集,是心血管纳米药物领域的创新,具有较高的应用价值;
19、2、本发明通过特定的选材(卵磷脂限定为提取自蛋黄的卵磷脂、脂质体材料限定为dspe-peg2000)、配比和制备过程,能将靶向性脂质体纳米药物粒径控制在60~80nm,使药物得以在ami部分实现高效富集发挥缓解局部炎症的功能。
- 还没有人留言评论。精彩留言会获得点赞!