α-突触核蛋白聚集的基于结构的肽抑制剂
背景技术:
1、帕金森病(pd)、路易体痴呆(dlb)和多系统萎缩(msa)一起归类为突触核蛋白病(synucleinopathies),这是一类特征在于α-突触核蛋白(α-syn)这种蛋白在神经元细胞中病理性积聚的神经退行性疾病。这些共同构成了第二大常见形式的神经退行性疾病。在脑的可溶性和膜相关部分中发现的突触前蛋白α-突触核蛋白(α-syn),在例如帕金森病(pd)中聚集。这些聚集体是路易体(这种神经退行性疾病的限定组织学特征)的主要组分,并且已被证明伴随神经元损伤7。不希望受任何特定机理的束缚,有人提出这一观察结果和两个其他观察结果指出聚集的α-syn是帕金森病的分子原因8。首先是具有遗传型pd的家族携带α-syn突变(诸如a53t)和丰富的路易体9,10,11。其次是具有编码α-syn的重复基因或三重基因的家族发展早发性pd,这可能是因为在高局部浓度下α-syn被迫进入淀粉样蛋白12,13。
2、基于结构研究,已经提出了许多不同的α-syn原纤维模型。有限的蛋白水解和nmr研究表明原纤维核由残基30-100组成(miake h(2002)j biol chem 277(21):19213–19219)。晶体结构和nmr研究暗示了不同的α-syn原纤维模型。在一个基于短区段的晶体结构的模型中,每个折叠结构的两个单体形成延伸的立体拉链(rodriguez ja等人(2015)nature 525(7570):486-490)。在第二个基于ssnmr的模型中,已经显示了每个淀粉样蛋白层具有一个单体的希腊回纹拓扑结构(tuttle md等人(2016)nat struct mol biol 23(5):409-415)。总之,这些研究表明α-syn可以形成多态性纤维结构。α-syn的称为nacore的片段68-78可以形成α-syn原纤维的核。nacore位于淀粉样蛋白沉积物中发现的35个残基的nac(非淀粉样蛋白β组分)结构域内(rodriguez ja等人(2015)nature 525(7570):486-490)。nacore容易聚集,并且聚集体显示出类似于全长α-syn的性质,诸如衍射图和细胞毒性。此外,β-突触核蛋白(一种同源物)不含残基74-84且未在淀粉样蛋白沉积物中发现,并且之前已证实除去残基71-82可在体外和果蝇模型中减少聚集和毒性(giasson等人(2001)j biol chem 276(4):2380-2386和periquet等人(2007)j neurosci 27(12):3338-3346)。此外,thr72处的修饰防止其聚集倾向。
3、本发明人最近表明,利用被设计成特异性“封端”正在生长的聚集体的短氨基酸抑制剂,可能有效地阻止阿尔茨海默病相关蛋白tau和精液源性hiv病毒感染增强因子(sevi)的聚集(sievers等人36;美国专利号8,754,03457)。他们还表明,相同的设计策略可以导致抑制p53淀粉样蛋白的形成、拯救癌细胞系中的突变体p53功能并减少肿瘤增殖的经设计的细胞穿透肽(美国专利申请2014/03738758)。因此,存在一个有吸引力的治疗窗,它靶向α-突触核蛋白淀粉样蛋白聚集,α-突触核蛋白是帕金森病和相关神经退行性疾病中的路易体(lb)形式的细胞内沉积物的主要组分。
4、需要鉴定防止和/或抑制α-突触核蛋白聚集和/或细胞毒性的剂。
技术实现思路
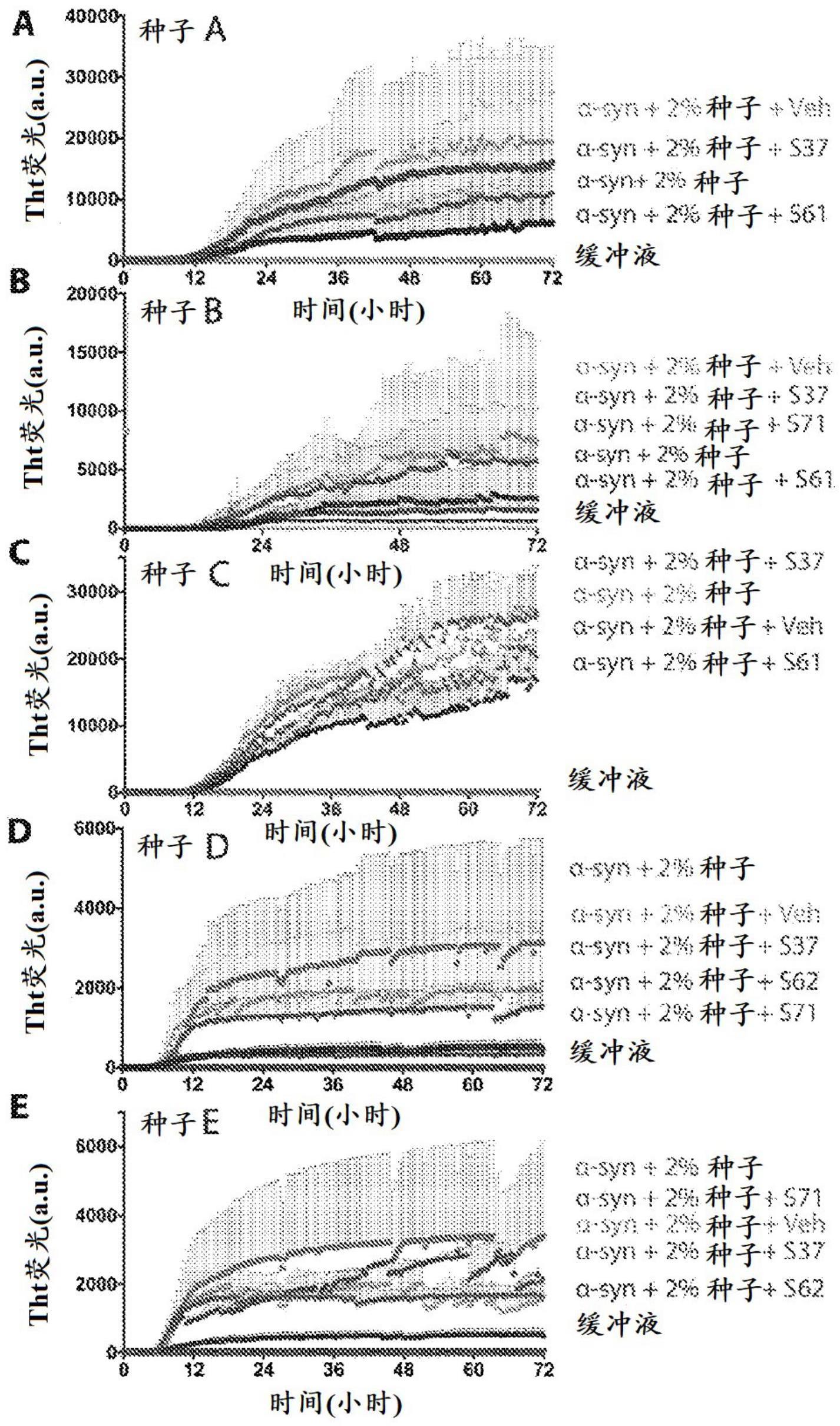
1、尽管已经广泛表征了α-syn淀粉样蛋白形成,但是在开发能够抑制α-syn聚集或减少α-syn聚集体(“种子”)在细胞间的朊病毒样扩散的治疗剂方面取得的进展很小。有希望的方法包括螯合α-syn聚集体的抗体以及结合α-syn单体的小分子稳定剂(参见例如mandler m等人(2015)mol neurodegener 10(1).doi:10.1186/s13024-015-0008-9;wrasidlo w等人(2016)brain:aww238)。使用nacore的原子结构作为模板,我们开发了一类新的抑制剂,即结合α-syn种子并防止它们的生长和伸长的肽剂。如下所示,这些抑制剂抑制许多模型系统中α-突触核蛋白原纤维的形成和接种,以及α-突触核蛋白聚集体的扩散。
2、本文公开的发明具有许多实施方案。本发明的一个实施方案是包含至少一种抑制肽的物质的组合物,该抑制肽通过与α-突触核蛋白(seq id no:1)的残基68-78结合来抑制α-突触核蛋白聚集。在本发明的典型实施方案中,该抑制肽包含序列gavvwgvtavkk(seq idno:3)或ravvtgvtavae(seq id no:4)。任选地,该抑制肽包含序列gavvwgvtavkkkkk(seqid no:5)、gavvwgvtavkkgrkkrrqrrrpq(seq id no:6)或ygrkkrrqrrravvtgvtavae(seq idno:7)。在本发明的某些实施方案中,该组合物包含多种抑制肽。通常,抑制肽的长度为6至30个氨基酸。
3、在本发明的抑制肽组合物中,该抑制肽中的至少一个氨基酸可以包括非天然存在的氨基酸(例如d-氨基酸或包含n-甲基部分的氨基酸);和/或该抑制肽与异源肽标签偶联。此类异源肽标签包括增加肽溶解度的氨基酸序列;或有助于监测或操纵肽的氨基酸序列;或促进肽进入哺乳动物细胞的氨基酸序列。任选地,这些肽组合物包括药学上可接受的载体和肽稳定赋形剂。
4、本发明的另一个实施方案是编码抑制肽的表达载体,该抑制肽通过与α-突触核蛋白的残基68-78结合来抑制α-突触核蛋白聚集。相关实施方案是包含肽或编码这种肽的表达载体的试剂盒,该肽通过与α-突触核蛋白(seq id no:1)的残基68-78结合来抑制α-突触核蛋白聚集。本发明的实施方案还包括通过化学合成或重组产生的方式制备本文公开的肽的方法。本发明的另一个实施方案是包含α-突触核蛋白和通过与α-突触核蛋白的残基68-78结合来抑制α-突触核蛋白聚集的肽的复合物。
5、本发明的又一个实施方案是用于减少或抑制α-突触核蛋白(seq id no:1)聚集的方法,其包括使α-突触核蛋白淀粉样蛋白原纤维与本文公开的抑制肽以足以减少或抑制α-突触核蛋白聚集的量接触。任选地,在该方法中,α-突触核蛋白淀粉样蛋白原纤维处于体内环境中。替代性地,在该方法中,α-突触核蛋白淀粉样蛋白原纤维处于体外环境中。本发明的相关实施方案是调节α-突触核蛋白淀粉样蛋白原纤维的尺寸或生长速率的方法,其包括使该原纤维与一定量的至少一种抑制肽在某一环境中接触,该抑制肽通过与α-突触核蛋白(seq id no:1)的残基68-78结合而抑制α-突触核蛋白聚集,在该环境中该抑制肽接触α-突触核蛋白的残基68-78,使得所接触的α-突触核蛋白淀粉样蛋白原纤维表现出经调节的尺寸或生长速率。
6、本发明的又一个实施方案是观察生物样品中α-突触核蛋白淀粉样蛋白原纤维存在或不存在的方法,其包括将生物样品与结合α-突触核蛋白的残基68-78的肽组合,使肽结合可能存在于生物样品中的α-突触核蛋白淀粉样蛋白原纤维,然后监测该组合在α-突触核蛋白淀粉样蛋白原纤维与肽之间形成的复合物的存在;其中所述复合物的存在表明该生物样品中存在α-突触核蛋白淀粉样蛋白原纤维。在该实施方案中,我们的抑制剂之一可以与成像剂诸如放射性标记、不透射线标记、荧光染料、荧光蛋白、比色标记等结合(例如,从而有利于成像方法,诸如mri或pet),并且我们的抑制剂将与患者脑中的α-突触核蛋白原纤维结合,从而允许对原纤维成像以用于诊断接下来的疾病进展。
7、本发明还包括以下实施方式:
8、实施方式1.一种包含至少一种抑制肽的物质的组合物,所述抑制肽通过与α-突触核蛋白的残基68-78结合来抑制α-突触核蛋白(seq id no:1)聚集;其中:
9、(a)所述抑制肽包含以下序列:
10、gavvwgvtavkk(seq id no:3);或
11、ravvtgvtavae(seq id no:4);并且
12、所述抑制肽中的至少一个氨基酸包含非天然存在的氨基酸;和/或
13、所述抑制肽与异源肽标签偶联。
14、实施方式2.如实施方式1所述的组合物,其中所述抑制肽包含以下序列:
15、gavvwgvtavkkkkk(seq id no:5);
16、gavvwgvtavkkgrkkrrqrrrpq(seq id no:6);或
17、ygrkkrrqrrravvtgvtavae(seq id no:7)。
18、实施方式3.如实施方式1所述的组合物,其中所述非天然存在的氨基酸包含以下中的至少一种:
19、d-氨基酸;或
20、包含n-甲基部分的氨基酸。
21、实施方式4.如实施方式1所述的组合物,其中所述异源肽标签包含:
22、增加肽溶解度的氨基酸序列;
23、有助于监测所述肽的氨基酸序列;和/或
24、促进肽进入哺乳动物细胞的氨基酸序列。
25、实施方式5.如实施方式4所述的组合物,其中所述异源肽标签包含:
26、多个精氨酸残基;
27、多个赖氨酸氨基酸;和/或
28、氨基酸序列tat。
29、实施方式6.如实施方式1所述的组合物,其中所述抑制肽的长度为6至30个氨基酸。
30、实施方式7.如实施方式1-6所述的组合物,其中所述组合物包含多种抑制肽。
31、实施方式8.一种药物组合物,其包含实施方式1-6的肽和药学上可接受的载体,所述药学上可接受的载体包括肽稳定赋形剂。
32、实施方式9.一种复合物,其包含α-突触核蛋白和实施方式1-8中任一项的肽组合物。
33、实施方式10.一种试剂盒,其包含实施方式1-8的肽,所述肽包装在容器中。
34、实施方式11.一种表达载体,其编码实施方式1-8中任一项的抑制肽。
35、实施方式12.一种制备实施方式1-8所述的肽的方法,其包括化学合成所述肽或重组产生所述肽。
36、实施方式13.一种减少或抑制α-突触核蛋白(seq id no:1)聚集的方法,其包括使α-突触核蛋白淀粉样蛋白原纤维与实施方式1-8中任一项的抑制肽以足以减少或抑制α-突触核蛋白聚集的量接触。
37、实施方式14.如实施方式13所述的方法,其中所述α-突触核蛋白淀粉样蛋白原纤维处于体内环境中。
38、实施方式15.一种调节α-突触核蛋白淀粉样蛋白原纤维的尺寸或生长速率,或α-突触核蛋白淀粉样蛋白原纤维扩散速率的方法,其包括:
39、在所述抑制肽与α-突触核蛋白的残基68-78或残基47-56接触的环境中,使所述原纤维与一定量的实施方式1-8中任一项的抑制肽接触;
40、使得所接触的α-突触核蛋白淀粉样蛋白原纤维表现出经调节的尺寸或生长速率。
41、实施方式16.一种观察生物样品中α-突触核蛋白淀粉样蛋白原纤维存在或不存在的方法,其包括:
42、(a)将生物样品与结合α-突触核蛋白的残基68-78的肽组合;
43、(b)使所述肽与所述生物样品中可能存在的α-突触核蛋白淀粉样蛋白原纤维结合;以及
44、监测组合(b)在α-突触核蛋白淀粉样蛋白原纤维与所述肽之间形成的复合物的存在;其中通过mri或pet或其他成像方法,所述复合物的存在表明所述生物样品中存在α-突触核蛋白淀粉样蛋白原纤维。
45、实施方式17.如实施方式16所述的方法,其中使用与所述肽偶联的可检测标记监测在α-突触核蛋白淀粉样蛋白原纤维与所述肽之间形成的复合物的存在。
46、实施方式18.如实施方式17所述的方法,其中所述可检测标记包括异源肽标签。
47、实施方式19.如实施方式16所述的方法,其中所述肽包含以下序列:
48、gavvwgvtavkk(seq id no:3);或
49、ravvtgvtavae(seq id no:4)。
50、实施方式20.如实施方式16所述的方法,其中对从疑似患有帕金森病的个体获得的生物样品进行所述方法。
51、实施方式21.一种经修饰的肽,其包含选自以下的肽:
52、gavvwgvtavkk(seq id no:3);和
53、ravvtgvtavae(seq id no:4);并且
54、其中所述肽中的至少一个氨基酸包含至少一个甲基化氨基酸残基。
55、实施方式22.一种抑制α-突触核蛋白接种的方法,其包括施用实施方式1-6中任一项的组合物。
56、实施方式23.一种减少或抑制突变α-突触核蛋白聚集的方法,其包括使突变α-突触核蛋白与实施方式21的抑制肽以足以减少或抑制突变α-突触核蛋白聚集的量接触。
57、通过以下详细描述,本发明的其他目的、特征和优点对于本领域的技术人员而言将变得显而易见。然而,应该理解,详细描述和具体实例虽然指明了本发明的一些实施方案,但是它们是以说明而非限制的方式给出的。在不脱离本发明的精神的情况下,可以在本发明的范围内进行许多改变和修改,并且本发明包括所有这些修改。
- 还没有人留言评论。精彩留言会获得点赞!