一种细胞膜包被核酸脂质复合物纳米粒及其制备方法和应用与流程
本发明涉及生物医药和药物制剂学领域,具体涉及一种细胞膜包被核酸脂质复合物纳米粒及其制备方法和应用。
背景技术:
1、rna疗法指利用具有治疗疾病功能的核酸从根源上调控致病基因表达的疗法,主要分为mrna、小核酸以及核酸适配体。从2018年首款sirna药物成功获得fda批准,到2020年辉瑞和moderna开发的mrna新冠疫苗先后获得美国fda的“紧急使用授权”,rna疗法逐渐进入成果收获期。
2、核酸药物本身具备诸多优势,包括研发周期短、抗原选择广泛、安全性高、低剂量、稳定表达等特点。然而核酸药物由于分子量较大,分子被攻击破坏的位点较多,因此稳定性差,在体内容易被降解。此外核酸药物的磷酸二酯键骨架使核酸的负电性和亲水性极强,因此不易跨过细胞膜,体内递送效率极低。为了突破诸多的细胞外屏障和细胞内屏障,将核酸药物递送进入细胞和亚细胞器,递送载体是助力核酸药物发挥效果的关键之一。
3、脂质纳米粒(lipid nano particles,lnps)是目前最先进和主流的mrna递送系统,lnp通常含有四种组分即可离子化阳离子脂质、辅助磷脂、胆固醇和peg脂质,其中纳米颗粒外表面的peg脂质在提升纳米颗粒稳定性的同时,这种peg修饰也会使机体产生相应的抗体,从而导致多次给药后,机体自身往往会加快对此类纳米疫苗的清除。利用细胞外囊泡作为核酸的天然递送载体具有很大的潜力,然而生物囊泡往往面临着外源性的核酸药物包封效率低,溶酶体逃逸效率低下,以及难以纯化等挑战。如何进一步提高纳米疫苗在体内的生物相容性,提升长循环并高效实现核酸药物的靶向递送成为了一个亟待解决的问题。
技术实现思路
1、为解决现有技术的不足,本发明的目的在于提供一种细胞膜包被核酸脂质复合物纳米粒及其制备方法和应用,通过核酸与脂质的复合实现高效药物负载以及高效胞浆递送,并通过红细胞膜包被保证该递药系统在机体内具有良好的生物相容性,不易诱导机体产生抗体,实现长循环;解决现有技术的核酸递送药物在体内的生物相容性差、易被清除、核酸负载效率低、靶向递送效率低、胞浆递送效率低的问题。
2、为了实现上述目标,本发明采用如下的技术方案:
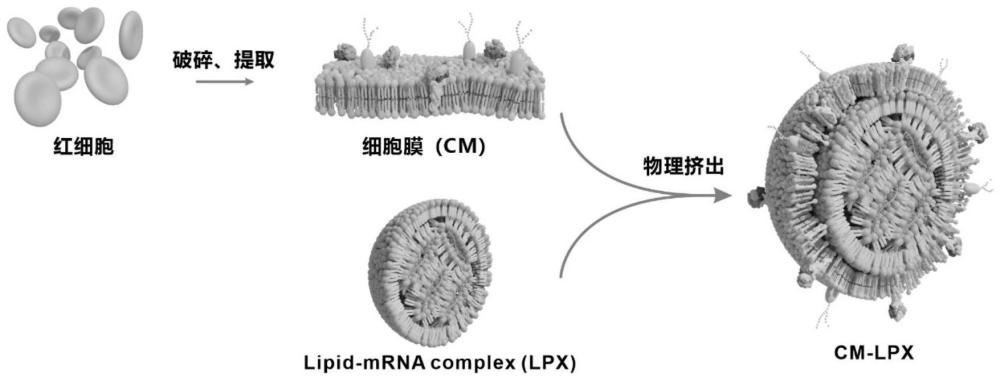
3、一种细胞膜包被核酸脂质复合物纳米粒,包括:位于外层的红细胞壳层,位于中间层并包裹核酸的lpx核层;红细胞壳层与lpx核层的质量比为1:0.1-5;优选为1:0.5-1。
4、前述的一种细胞膜包被核酸脂质复合物纳米粒,红细胞壳层由红细胞膜壳层囊泡组成;lpx核层的脂质组分由可离子化脂质组成。
5、前述的一种细胞膜包被核酸脂质复合物纳米粒,红细胞壳层由红细胞膜壳层囊泡组成;lpx核层的脂质组分按照摩尔比包括:25-75可离子化脂质:25-75辅助磷脂;优选45-55可离子化脂质:45-55辅助磷脂。
6、前述的一种细胞膜包被核酸脂质复合物纳米粒,红细胞壳层由红细胞膜壳层囊泡组成;lpx核层的脂质组分按照摩尔比包括:90-99可离子化脂质:1-10peg脂质;95-99可离子化脂质:1-5peg脂质。
7、前述的一种细胞膜包被核酸脂质复合物纳米粒,红细胞壳层由红细胞膜壳层囊泡组成;lpx核层的脂质组分按照摩尔比包括:25-75可离子化脂质:25-75胆固醇;优选60-70可离子化脂质:30-40胆固醇。
8、前述的一种细胞膜包被核酸脂质复合物纳米粒,红细胞壳层由红细胞膜壳层囊泡组成;lpx核层的脂质组分按照摩尔比包括:40-60可离子化脂质:1-20辅助磷脂:20-59胆固醇;45-55可离子化脂质:1-10辅助磷脂:35-54胆固醇。
9、前述的一种细胞膜包被核酸脂质复合物纳米粒,红细胞壳层由红细胞膜壳层囊泡组成;lpx核层的脂质组分按照摩尔比包括:40-98可离子化脂质:1-55辅助磷脂:1-5peg脂质;优选85-98可离子化脂质:1-10辅助磷脂:1-5peg脂质。
10、前述的一种细胞膜包被核酸脂质复合物纳米粒,红细胞壳层由红细胞膜壳层囊泡组成;lpx核层的脂质组分按照摩尔比包括:50-75可离子化脂质:20-49胆固醇:1-5peg脂质;优选55-69可离子化脂质:30-40胆固醇:1-5peg脂质。
11、前述的任一种细胞膜包被核酸脂质复合物纳米粒,可离子化脂质包括:1,2-二油醇-3-二甲基氨基-丙烷dodma、二油酰丙基氯化三甲铵dotma、(2,3-二油酰基-丙基)-三甲基氯化铵dotap、十二烷基三甲基溴化铵dtab、溴化三甲基十四烷基铵ttab、溴化三甲基十六烷基铵ctab、溴化二甲基双十八烷基铵ddab、n-(2-精胺甲酰基)-n’,n’-双十八烷基甘氨酰胺dogs、1,2-二油酰-3-琥珀酰-sn-甘油胆碱酯dosc、三氟乙酸二甲基-2,3-二油烯氧基丙基-2-(2-精胺甲酰氨基)乙基铵dospa、1-辛基壬基8-[(2-羟乙基)[6-o-6-(十一烷氧基)己基]氨基]-辛酸酯sm-102、((4-羟基丁基)氮杂二烷基)双(己烷-6,1-二基)双(2-己基癸酸酯)alc-0315、4-(n,n-二甲基氨基)丁酸(二亚油基)甲酯dlin-mc3-dma、1,2-二油基-3-二甲氨基丙烷dodap或n,n-二甲基十六烷基胺c16-dma一种或多种。
12、前述的一种细胞膜包被核酸脂质复合物纳米粒,辅助磷脂包括:二硬脂酰磷脂酰胆碱(dspc)、氢化大豆卵磷脂(hspc)、蛋黄卵磷脂(pc)或二油酰基卵磷脂(dopc)中的一种或多种。
13、前述的一种细胞膜包被核酸脂质复合物纳米粒,peg脂质包括:培化二肉豆寇酸甘油酯(dmg-peg2000)。
14、前述的一种细胞膜包被核酸脂质复合物纳米粒,细胞膜包被核酸脂质复合物纳米粒的粒径为50-250nm,优选为80-150nm。
15、前述的一种细胞膜包被核酸脂质复合物纳米粒的制备方法,包括如下步骤:
16、s1,制备红细胞膜壳层囊泡,具体步骤包括:
17、将血液离心清洗,去除血红蛋白,离心得到红细胞膜原料,将得到的红细胞膜原料通过超声、初步破碎之后逐次挤出通过孔径为1000nm和400nm的聚碳酸酯多孔膜,得到均一的红细胞膜壳层囊泡;
18、s2,制备核酸脂质复合物核层lpx,具体步骤包括:
19、使用微流控法按照脂质组分配方合成lpx,获得的lpx用缓冲液稀释,用透析管纯化,换液多次,放置摇床直至透析结束;
20、s3,制备cm-lpx,具体步骤包括:
21、将红细胞膜与lpx以1:0.1-5(w/w)的比例混合均匀,之后用200nm的多孔膜挤出,反复挤出多次,得到cm-lpx,并透析纯化。
22、前述的一种细胞膜包被核酸脂质复合物纳米粒的制备方法,s2,制备核酸脂质复合物核层lpx:
23、将核酸溶于缓冲液中,脂质溶于乙醇中,通过微流控法合成得到悬液,并采用透析的方式进行纯化,得到lpx;
24、脂质组分包括:1a仅含可离子化脂质的单组份脂质,2a含可离子化脂质和辅助磷脂的双组分脂质,2b含可离子化脂质和peg脂质的双组分脂质,2c含可离子化脂质与胆固醇的双组分脂质,3a含可离子化脂质与辅助磷脂及胆固醇的三组分脂质,3b含可离子化脂质与辅助磷脂及peg脂质的三组分脂质,3c含可离子化脂质与胆固醇及peg脂质的三组分脂质中的一种;
25、2a,可离子化脂质和辅助磷脂的双组分脂质的摩尔比例为25-75:25-75,优选为45-55:45-55。
26、2b,可离子化脂质和peg脂质的双组分脂质的摩尔比例为90-99:1-10,优选为95-99:1-5;
27、2c,可离子化脂质与胆固醇的双组分脂质的摩尔比例为25-75:25-75,优选为60-70:30-40;
28、3a,可离子化脂质与辅助磷脂及胆固醇的三组分脂质的摩尔比例为40-60:1-20:20-59,优选为45-55:1-10:35-54;
29、3b,可离子化脂质与辅助磷脂及peg脂质的三组分脂质的摩尔比例为40-98:1-55:1-5,优选为85-98:1-10:1-5;
30、3c,可离子化脂质与胆固醇及peg脂质的三组分脂质的摩尔比例为50-75:20-49:1-5,优选为55-69:30-40:1-5。
31、前述的一种细胞膜包被核酸脂质复合物纳米粒的制备方法,
32、s3,制备cm-lpx:
33、将步骤2得到的lpx加入到步骤1得到的红细胞膜囊泡悬液中混合均匀,红细胞膜囊泡悬液与lpx的混合比例为1:0.1-5(w/w);混合均匀后用孔径为200nm的多孔膜挤出,反复挤出多次,得到cm-lpx,并用透析袋透析纯化。
34、前述的一种细胞膜包被核酸脂质复合物纳米粒的应用,应用于核酸递送药物;核酸包括:mrna、rnai;药物包括:治疗剂、抑制剂或疫苗;mrna优选用于为预防或治疗疾病表达的功能性蛋白、治疗性单克隆抗体、b细胞表位、t细胞表位或肿瘤新抗原肽段的完整mrna分子。
35、术语释义:
36、cm:cell membrane;红细胞膜壳层。
37、lpx:lipid-mrna complex;核酸脂质复合物核层。
38、外周血:外周血是除骨髓之外的血液,临床上常用一些方法把骨髓中的造血干细胞释放到血液中,再从血液中提取分离得到造血干细胞,我们把这样得到的干细胞称为外周血干细胞。
39、核酸包含核苷酸(核苷酸单体)的聚合物。因此,核酸也称为多核苷酸。核酸可为或可包括例如脱氧核糖核酸(dna)、核糖核酸(rna)、苏糖核酸(tna)、乙二醇核酸(gna)、肽核酸(pna)、锁核酸(lna,包括具有β-d-核糖构型的lna、具有α-l-核糖构型的α-lna(lna的非对映异构体)、具有2”-氨基官能化的2”-氨基-lna和具有2”-氨基官能化的2”-氨基-α-lna)、乙烯核酸(ena)、环己烯基核酸(cena)和/或其嵌合体和/或组合。
40、信使rna(mrna)是编码(至少一种)蛋白质(天然存在、非天然存在或经修饰的氨基酸聚合物)的任何rna,并且可经翻译在体外、体内、原位或离体产生所编码的蛋白质。本领域技术人员将了解,除非另有注明,否则本技术中所陈述的核酸序列可在代表性dna序列中列举“t”,但在所述序列代表rna(例如mrna)时,“t”将由“u”取代。因此,由本文中的特定序列识别号公开并识别的任何dna也公开与所述dna互补的相应rna(例如mrna)序列,其中所述dna序列的每个“t”被“u”取代。
41、疫苗可以是单价疫苗、多价疫苗,也可以是组合疫苗。多价疫苗包括编码相同或不同物种的两种或更多种抗原的rna或多种rna。组合疫苗包括:靶向相同毒株/物种的一种或多种抗原或不同毒株/物种的一种或多种抗原的组合疫苗。
42、药物组合物:包括(但不限于)生物相容性媒介物、佐剂、添加剂、赋形剂和稀释剂,以实现可用作剂型的组合物。其他载体的实例包括胶体氧化硅、硬脂酸镁、纤维素和月桂基硫酸钠。
43、赋形剂是指实现以下功能的试剂:(1)增加稳定性;(2)增加细胞转染;(3)允许持续或延迟释放(例如来自储积制剂);(4)改变生物分布(例如靶向至特定组织或细胞类型);(5)增加所编码蛋白质在体内的翻译;和/或(6)改变所编码蛋白质(抗原)在体内的释放曲线。除传统赋形剂如溶剂、分散介质、稀释剂或其他液体媒介物、分散或悬浮助剂、表面活性剂、等渗剂、增稠或乳化剂、防腐剂以外,赋形剂还可包括(但不限于)类脂质、脂质体、脂质纳米颗粒、聚合物、脂质复合物(lipoplex)、核-壳纳米颗粒、肽、蛋白质、经rna转染的细胞(例如用于移植至受试者中)、玻尿酸酶、纳米颗粒模拟物和它们的组合。
44、给药方式:包括但不限于:胃肠道给药、注射给药、呼吸道给药、经皮给药;胃肠道给药包括口服、舌下给药和直肠给药;注射给药包括静脉注射、肌内注射和皮下注射等;呼吸道给药是气体或挥发性药物吸入后,由肺上皮和呼吸道黏膜吸收,比如雾化吸入给药。
45、术语“受试者”是指可用于实验、诊断、预防和/或治疗目的而施用根据本公开的组合物或制剂的任何生物体。典型的受试者包括动物(例如,哺乳动物,如小鼠、大鼠、兔、非人灵长类动物和人)和/或植物。
46、本发明的有益之处在于:
47、本发明相比经常用于核酸递送药物的lnp,采用了完全不同的结构即红细胞膜包覆核酸脂质复合物的策略,提升了纳米疫苗的安全性、生物相容性及长循环;
48、本发明的递药系统相比常见药物递送系统具有较好脾脏器官靶向能力,能够有效地激活免疫细胞,该递药系统的成功实施将为当前核酸药物递送提供一种合理化方式。
49、本发明相较于单一的红细胞囊泡递送载体,采用的核壳结构的cm-lpx提升了核酸的负载效率,同时得益于lpx核采用了可离子化脂质,纳米颗粒在内涵体中可依据质子海绵效应,产生高效的内涵体逃逸,实现核酸的胞浆递送。
50、本发明相较于红细胞囊泡和脂质体膜融合制备的杂化膜囊泡,采用核壳结构的cm-lpx可以更好地保护核酸不被降解,从而提高核酸如mrna在体内的表达效率;
51、本发明能够根据需求调控红细胞膜囊泡以及lpx核的尺寸,使得红细胞膜囊泡具有大于pc膜孔的尺寸,lpx具有小于pc膜孔的尺寸,从而在进行膜挤出操作的时候,cm会因为尺寸大于pc膜而破裂,在这个过程中包覆至lpx外层。
52、本发明使用cm-lpx剂型作为核酸疫苗如mrna疫苗的递送系统,可有效激活抗原特异性t细胞,产生免疫响应,抑制肿瘤的生长。
- 还没有人留言评论。精彩留言会获得点赞!