稳定的局部用非诺多泮组合物的制作方法
本公开涉及一种局部用非诺多泮组合物,例如,物理和化学稳定的局部用非诺多泮组合物,其包含约0.1重量%至约5重量%的非诺多泮或其药学上可接受的盐、至少一种聚丙烯酰胺型胶凝剂、至少一种纤维素型胶凝剂和至少一种溶剂,其中非诺多泮基本上溶解在所述组合物中,并且其中所述组合物在25℃和60%的相对湿度下稳定达至少12个月。
背景技术:
1、银屑病是一种影响全世界许多人的皮肤疾病。除了其皮肤病学表现外,银屑病可能对患者的生活质量产生重大影响。银屑病是一种慢性、免疫介导的炎性皮肤病症,特征在于角质细胞和内皮细胞的表皮过度增殖以及炎性细胞(例如,活化的t细胞)的积聚。慢性斑块型银屑病,称为寻常型银屑病,是该疾病的常见形式,特征在于界限清楚的红斑鳞状斑块,其可累及皮肤的任何部位,但通常累及伸肌表面(如肘部和膝盖)和头皮。
2、银屑病的治疗包括局部用药剂、基于光的疗法、传统全身药物和生物药剂。治疗方法常取决于疾病的严重程度。呈现轻度银屑病的患者可用局部用抗炎皮质类固醇治疗。然而,据报道,长期使用皮质类固醇可能会导致全身或局部严重副作用。患有中度至重度形式的银屑病的患者可进行全身治疗,如甲氨蝶呤或环孢霉素与光疗的组合,而患有最重度形式的银屑病的患者可使用生物疗法治疗。
3、化学上为6-氯-2,3,4,5-四氢-1-(4-羟基苯基)-1h-3-苯并氮杂-7,8-二醇甲磺酸酯的甲磺酸非诺多泮是一种高度选择性的多巴胺d1受体(d1r)激动剂,由于其血管舒张作用,其已通过静脉内施用在临床中使用,主要用在重度高血压的治疗中。具有一定的全身血管舒张作用的非诺多泮最低血液水平在1至10ng/ml之间的范围内(fda clinicalpharmacology&biopharmaceutics review,da 19922,)。
4、本文通过引用公开的pct公开号wo 2018/042352涉及一种通过局部施用治疗上有效量的非诺多泮或其药学上可接受的盐来治疗皮肤病症、优选t-细胞介导的自身免疫性皮肤炎性病症的方法。pct公开号wo 2018/042352中报道的病症包括d1受体介导的皮肤病症,例如银屑病、特应性皮炎、脱发和白癜风。
5、非诺多泮呈现出溶解性和稳定性挑战,尤其是在水性制剂中。甲磺酸非诺多泮仅在水、乙醇和甲醇中微溶,并在丙二醇中可溶。而且,已知制剂的ph会影响其稳定性。
6、用于静脉内注射的在无菌水溶液中含有甲磺酸非诺多泮、柠檬酸、丙二醇、柠檬酸钠二水合物和焦亚硫酸钠。为了使产品在存在水的情况下保持稳定,其ph在2.8-3.8的酸性范围内。而且,稀释后的溶液应在室温下4小时或冷藏条件下24小时后丢弃,这突出反映了非诺多泮在存在水的情况下的稳定性问题。
7、美国专利号6,699,497和6,960,353涉及透皮施用非诺多泮以治疗高血压,公开了非诺多泮的稳定性问题并陈述在使用水性制剂时优选将ph维持在小于约5.5下,更优选约2-4.5之间,以提供稳定的非诺多泮制剂。pct公开号wo 2018/042352以实验方式证实,将ph维持在4以下可保护非诺多泮免于降解。
技术实现思路
1、本公开涉及一种非诺多泮的局部用组合物,其包含约0.1重量%至约5重量%的非诺多泮或其药学上可接受的盐、至少一种聚丙烯酰胺型胶凝剂、至少一种纤维素型胶凝剂和至少一种溶剂,其中非诺多泮基本上溶解在所述组合物中,并且其中所述组合物在25℃和60%的相对湿度下物理和化学稳定达至少一个月。
2、本公开的申请人成功地开发了非诺多泮的局部用组合物,其表现出有效的局部用药物组合物所必需的重要特征。具体而言,为了获得局部有效的组合物,期望将活性药物成分(api)溶解在组合物中以增强向皮肤中的穿透,并且组合物的ph值应在4-6的范围内以避免皮肤刺激。此外,组合物在储存期间应是物理和化学稳定的。出乎意料的是,本公开的申请人能够克服作为活性成分的非诺多泮的溶解性和稳定性挑战并开发出包含治疗上有效量的非诺多泮的局部用组合物,其中具有至少0.1重量%的非诺多泮。
3、本公开的申请人出乎意料地发现,包含治疗上有效量的非诺多泮的局部用组合物的物理和化学稳定性可通过使用至少一种聚丙烯酰胺型胶凝剂和至少一种纤维素型胶凝剂的组合来实现。出乎意料的是,这些胶凝剂的组合不仅改善了组合物的物理稳定性,而且在至少十二个月的时间内改善了非诺多泮的化学稳定性。
4、而且,本公开的申请人出乎意料地发现,组合物中至少一种聚丙烯酰胺型胶凝剂和至少一种纤维素型胶凝剂的组合的存在将保持非诺多泮的物理和化学稳定性以及溶解性,即使在含水组合物中和在等于或高于4的ph值中,这在适合于局部施用的范围内。
5、此外,本公开的局部用组合物使得非诺多泮能够穿透到皮肤中,从而使其在治疗上有效地治疗皮肤病症。
6、根据本公开,局部用非诺多泮组合物包含治疗上有效量的非诺多泮或其盐和以下的组合:(a)至少一种聚丙烯酰胺型胶凝剂;(b)至少一种纤维素型胶凝剂和(c)至少一种溶剂。
7、在一些实施方案中,组合物包含呈其碱形式的非诺多泮。
8、在一些实施方案中,组合物包含非诺多泮盐。在一个优选的实施方案中,非诺多泮盐为甲磺酸非诺多泮。
9、在一些实施方案中,组合物中非诺多泮的治疗上有效量为组合物的约0.1重量%至约5重量%。在一些实施方案中,组合物中非诺多泮的有效量为组合物的约0.5重量%至约4重量%。在一个优选的实施方案中,组合物中非诺多泮的有效量为组合物的约1重量%至约3重量%。
10、根据本公开的一些实施方案,局部用组合物包含至少一种聚丙烯酰胺型胶凝剂。在一些实施方案中,聚丙烯酰胺型胶凝剂选自丙烯酰胺/丙烯酰基二甲基牛磺酸钠共聚物/异十六烷/聚山梨酸酯80混合物(sepineotm p600)、聚丙烯酰胺/c13-14异链烷烃/月桂醇聚醚-7混合物(sepigeltm 305)、丙烯酸羟乙酯/丙烯酰基二甲基牛磺酸钠共聚物混合物(sepinovtm emt 10)和丙烯酸羟乙酯/丙烯酰基二甲基牛磺酸钠共聚物(sepineotm derm)。在一个优选的实施方案中,聚丙烯酰胺型胶凝剂为丙烯酰胺/丙烯酰基二甲基牛磺酸钠共聚物/异十六烷/聚山梨酸酯80混合物(sepineotm p600)。
11、根据本公开的各种实施方案,局部用组合物还包含纤维素型胶凝剂。在一个优选的实施方案中,纤维素型胶凝剂为羟丙基纤维素。在一些实施方案中,纤维素型胶凝剂选自乙基纤维素、甲基纤维素、羟乙基纤维素、羟丙基纤维素(kluceltm)、羟丙基甲基纤维素、羟丁基甲基纤维素、羧甲基纤维素及其组合。
12、根据一个优选的实施方案,局部用组合物包含sepineotm p600与羟丙基纤维素的组合。
13、根据本公开的一些实施方案,组合物中聚丙烯酰胺型胶凝剂的量为组合物的约1重量%至约5重量%。
14、根据本公开的一些实施方案,组合物中纤维素型胶凝剂的量为组合物的约1重量%至约5重量%。
15、根据本公开的一些实施方案,局部用组合物还包含至少一种共溶剂。根据另外的实施方案,组合物包含至少一种溶剂和至少一种共溶剂。在一些实施方案中,溶剂选自丙二醇、二甲基异山梨醇、甘油、乙醇、聚乙二醇、己二醇、二乙二醇单乙基醚及其组合。在一些实施方案中,共溶剂选自丙二醇、二甲基异山梨醇、甘油、乙醇、聚乙二醇、己二醇、二乙二醇单乙基醚及其组合。
16、在另外的实施方案中,局部用组合物还包含至少一种润肤剂。在一些实施方案中,润肤剂选自ppg-15硬脂基醚、ppg-12/sdmi共聚物、异硬脂酸、辛酸鲸蜡硬脂基酯、环甲基硅酮、丙二醇、辛基十二烷醇、甘油、己二酸二异丙酯及其组合。
17、根据本公开,非诺多泮基本上溶解在组合物中。在一些实施方案中,至少约80%的非诺多泮溶解在组合物中。在一些实施方案中,至少约90%的非诺多泮溶解在组合物中。在一些实施方案中,至少约95%的非诺多泮溶解在组合物中。在一些实施方案中,约100%的非诺多泮溶解在组合物中。
18、在一些实施方案中,在25℃和60%的相对湿度下一个月后,组合物中非诺多泮的重量%降低小于约10%。在一些实施方案中,在25℃和60%的相对湿度下6个月后,组合物中非诺多泮的重量%降低小于约10%。在一些实施方案中,在25℃和60%的相对湿度下9个月后,组合物中非诺多泮的重量%降低小于约10%。在一些实施方案中,组合物中非诺多泮的重量百分数在非诺多泮的标示量的90%-110%之间达至少一个月。在一些实施方案中,组合物中非诺多泮的重量百分数在非诺多泮的标示量的90%-110%之间达至少六个月。在一些实施方案中,组合物中非诺多泮的重量百分数在非诺多泮的标示量的90%-110%之间达至少12个月、18个月、24个月、30个月或36个月。
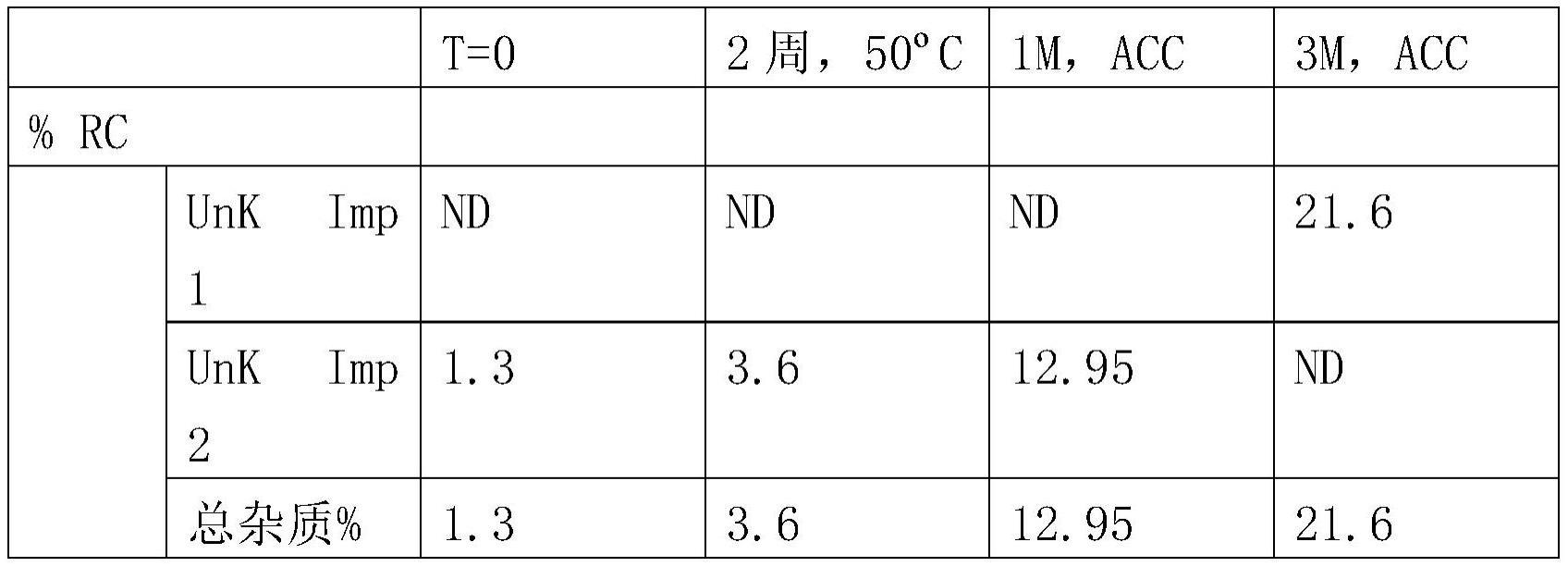
19、在一些实施方案中,组合物在25℃和60%的相对湿度下至少一个月后包含小于约0.2重量%的杂质b。在一些实施方案中,组合物在25℃和60%的相对湿度下至少六个月后包含小于约0.2重量%的杂质b。在一些实施方案中,组合物在25℃和60%的相对湿度下至少九个月、12个月、18个月、24个月、30个月或36个月后包含小于约0.2重量%的杂质b。在一些实施方案中,组合物在25℃和60%的相对湿度下将是均匀的达至少一个月。在一些实施方案中,组合物在25℃和60%的相对湿度下将是均匀的达至少六个月。在一些实施方案中,组合物在25℃和60%的相对湿度下将是均匀的达至少九个月、12个月、18个月、24个月、30个月或36个月。
20、在一些实施方案中,组合物为半固体局部用剂型或液体局部用剂型。在一些实施方案中,剂型为软膏、乳膏、洗剂、凝胶、喷雾剂、泡沫、布、贴片、擦拭物或垫。
21、根据本公开的各种实施方案,局部用非诺多泮组合物可为无水组合物或含水组合物。
22、在一些实施方案中,局部用组合物为无水组合物。根据一个优选的实施方案,无水组合物为无水凝胶。
23、在一些实施方案中,局部用组合物还包含水。根据一个优选的实施方案,含水组合物为o/w乳液。在一些实施方案中,o/w乳液呈乳膏的形式。
24、在一些实施方案中,含水组合物包含至少一种ph调节剂以维持适合于局部施用的ph水平。在一些实施方案中,ph调节剂选自氢氧化钠、三乙醇胺、柠檬酸、柠檬酸盐缓冲液、磷酸盐缓冲液和碳酸盐缓冲液。
25、在一些实施方案中,含水组合物具有约3.5至约6.0、更优选地约4.0至约5.0的ph范围。在一些实施方案中,组合物的ph在25℃和60%的相对湿度下至少一个月后为约4至约5。在一些实施方案中,组合物的ph在25℃和60%的相对湿度下至少六个月后为约4至约5。
26、在一些实施方案中,局部用组合物还包含另外的赋形剂,包括例如防腐剂、渗透增强剂、稳定剂、增粘剂、增稠剂、发泡剂、螯合剂或抗氧化剂。
27、根据本公开,非诺多泮局部用组合物在室温条件(25℃和60%的相对湿度)下将既物理稳定又化学稳定长达12个月。
28、根据本公开,非诺多泮局部用组合物在加速条件(40℃和75%的相对湿度)下将既物理稳定又化学稳定达至少三个月。
29、根据另外的实施方案,当以非诺多泮的重量%表示的药物测定值在整个指定的时间段内减少最多10%并且杂质b的水平在整个时间段内小于约0.2%时,获得组合物的化学稳定性。在一些实施方案中,所述指定的时间段为一个月、三个月、六个月、九个月、12个月、18个月、24个月、30个月或36个月。
30、根据另外的实施方案,当非诺多泮的重量百分数在非诺多泮的标示量的90%-110%之间达特定的时间段时,获得组合物的化学稳定性。在一些实施方案中,所述特定的时间段为一个月、三个月、六个月、九个月、12个月、18个月、24个月、30个月或36个月。
31、根据一些实施方案,通过在至少一个月、三个月、六个月、九个月、12个月、18个月、24个月、30个月或36个月的整个时间段内维持组合物的一致的宏观和微观外观、ph水平和粘度来确定组合物的物理稳定性。
32、根据另外的实施方案,通过实现均匀的外观和不存在相分离达至少一个月、三个月、六个月、九个月、12个月、18个月、24个月、30个月或36个月的时间段来确定组合物的物理稳定性。在又一个实施方案中,通过实现在约4至约5的范围内的稳定ph达至少一个月、三个月、六个月、九个月、12个月、18个月、24个月、30个月或36个月的时间段来确定组合物的稳定性。
33、根据本公开的另外的实施方案,本公开的非诺多泮局部用组合物被用于皮肤病症的治疗。在一些实施方案中,皮肤病症为t-细胞介导的免疫炎性病症。在一些实施方案中,皮肤病症为d1受体介导的皮肤病症。
34、根据另外的实施方案,皮肤病症选自银屑病、特应性皮炎、脱发、痤疮、玫瑰痤疮和白癜风。在一个优选的实施方案中,皮肤病症为银屑病或特应性皮炎。更优选地,皮肤病症为银屑病。
35、在一些实施方案中,本公开涉及一种在有此需要的受试者中治疗dl受体介导的皮肤病症的方法,所述方法包括向受试者的受影响的皮肤区域局部施用所述组合物,其中所述dl受体介导的皮肤病症选自银屑病或特应性皮炎。
- 还没有人留言评论。精彩留言会获得点赞!