一种基于MAVS棕榈酰化修饰的肿瘤免疫治疗组合药物
本发明涉及生物医药,具体涉及一种用于治疗实体肿瘤的免疫治疗组合药物。
背景技术:
1、肿瘤中广泛存在表观基因组异常,在肿瘤的发生发展过程中发挥重要作用。表观遗传调控异常不仅促进肿瘤细胞恶性转化和扩散转移,还可以帮助肿瘤细胞逃避机体免疫监视。肿瘤细胞中编码“非我”抗原、抗原加工与呈递分子及免疫刺激分子的基因通常被表观遗传学机制所沉默,导致机体对肿瘤细胞的免疫忽视[pmid:31548600]。
2、哺乳动物细胞中广泛分布于基因组中的逆转座子(retrotransposableelements),包括内源性逆转录病毒、line和sine等类型,拥有产生具有免疫刺激作用的内源性双链rna分子(dsrna)的潜力。通常情况下,正常体细胞中的逆转座子被dna甲基化为主的染色质机制所沉默,以避免其转录激活对基因组稳定性造成损害。然而,肿瘤细胞中存在的表观遗传调控异常,比如基因组尺度的dna低甲基化现象,会改变部分逆转座子的沉默状态或增强以组蛋白甲基化修饰为主的沉默机制。
3、已有研究报道显示,包括dnmts、lsd1、ezh2、suv39h1、setdb1、kdm5b和mll4等在内的多个表观遗传调控因子参与抑制肿瘤细胞中逆转座子的转录表达,这些表观遗传调控因子的敲除或酶活抑制会导致逆转座子来源的dsrna在细胞内显著富集,细胞质的dsrna被感受器识别后激活肿瘤细胞内的固有免疫应答,进而实现免疫抑制微环境的炎性转变[pmid:26317466,26317465,29937226,33953401,34671158,36323669]。基于这些发现,已有多个临床试验正在积极探索新的联合治疗策略,将表观遗传疗法用于克服低免疫原性肿瘤对免疫治疗的不应答[pmid:32929243]。
4、肿瘤低免疫原性和免疫抑制微环境限制了免疫疗法的治疗效果。表观遗传调节剂特别是小分子抑制剂具有激发肿瘤免疫原性、改善肿瘤免疫抑制微环境的作用,目前已有多个临床试验正在积极探索将表观小分子抑制剂用于提高实体肿瘤对pd1阻断抗体或pd-l1阻断抗体应答的联合治疗策略,然而尚未见临床治疗效果的报道。
5、靶向上述表观遗传调控因子诱导产生的dsrna主要作用之一是通过rig-i/mda5-mavs通路激活效应分子i型干扰素(ifn-i)和下游干扰素刺激应答基因(isg)[pmid:30723290],这表明肿瘤微环境中ifn-i应答的强度和持续时间对联合靶向这些表观遗传调控因子提高肿瘤免疫疗法效果具有重要意义。
6、近年来,越来越多的表观遗传调控因子被发现可以调节内源性dsrna分子的产生,但这些dsrna分子的免疫激活效应强弱和持续时间受到细胞内哪些因素控制,以及这些调控机制如何影响机体抗肿瘤免疫和免疫治疗效果,目前却知之甚少。线粒体抗病毒信号蛋白(mitochondrial antiviral signaling,mavs)作为转导rig-i/mda5信号通路和激活下游ifn-i转录的关键接头蛋白,其功能主要受到包括泛素化在内的蛋白质翻译后修饰的调控[pmid:32536927]。例如,mavs k48连接的多聚泛素化修饰显著上调,导致蛋白酶体介导的降解,致使活化的rig-i/mda5信号通路无法有效维持,从而限制了ifn-i应答的强度和持续时间[pmid:32536927]。
7、因此,如何稳定mavs蛋白水平和提高mavs活化水平,对推动表观遗传药物与免疫疗法相结合用于肿瘤治疗具有重要意义。
技术实现思路
1、本发明的目的在于提供一种基于mavs棕榈酰化修饰的肿瘤免疫治疗组合药物,通过促进mavs棕榈酰化修饰提高表观遗传疗法或者表观遗传药物与免疫疗法联合用药治疗肿瘤的疗效。
2、为实现上述目的,本发明采用如下技术方案:
3、本发明提供了促进线粒体抗病毒信号蛋白(mavs)棕榈酰化修饰的第一药剂和促进内源性双链rna(dsrna)分子产生的第二药剂在制备抗肿瘤药物中的应用。
4、本发明中,所述第一药剂活性成分以mavs蛋白棕榈酰化修饰作为药物作用靶点,通过促进mavs蛋白棕榈酰化修饰可以有效提高mavs蛋白的稳定性和活化水平,充分发挥第二药剂通过促进内源性dsrna分子产生激活下游以i型干扰素激活为特征的固有免疫应答通路的能力,协同促进肿瘤微环境的炎性转变,提高肿瘤免疫原性,从而增强t细胞浸润水平和杀伤肿瘤的作用。
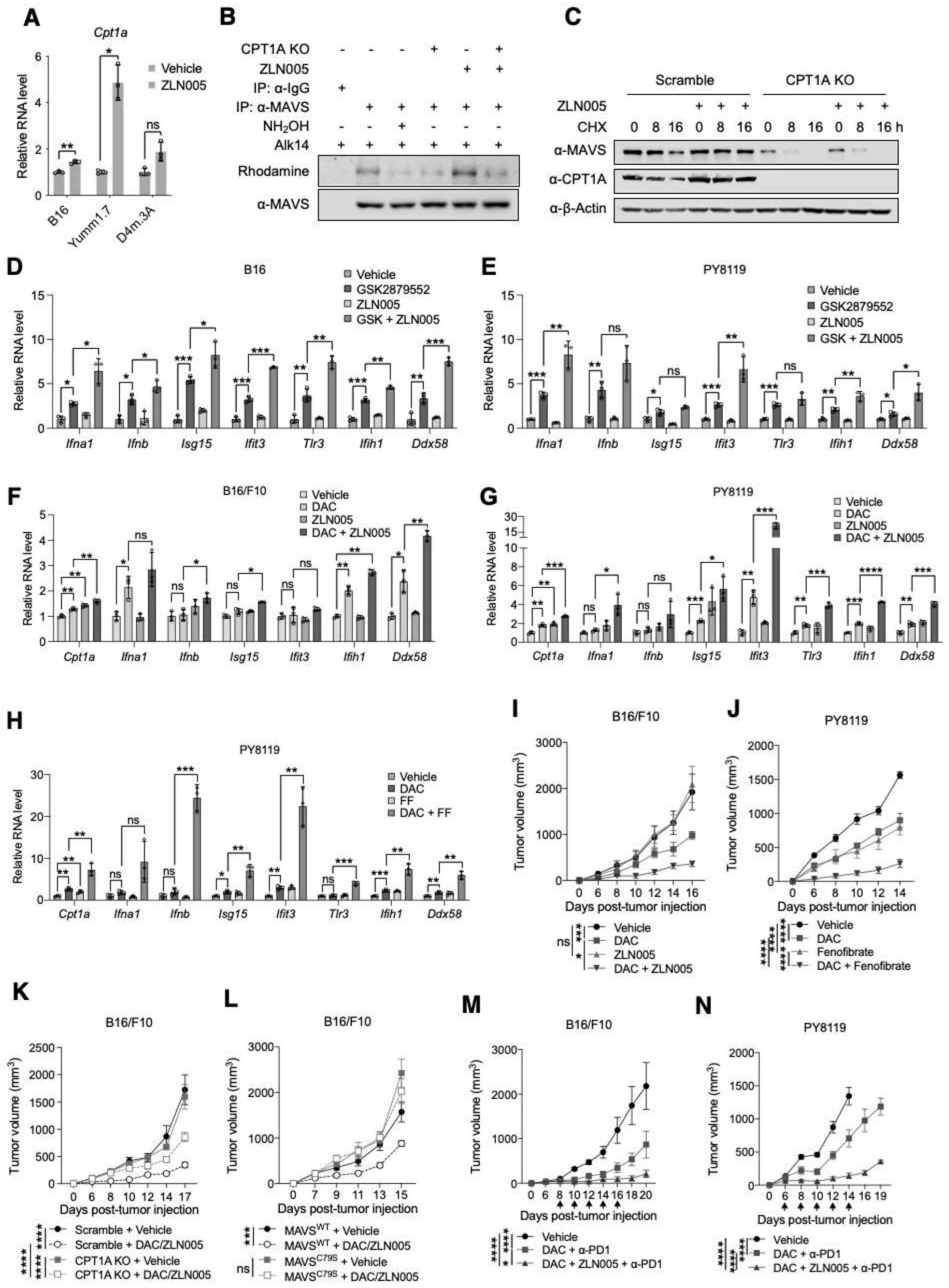
5、进一步的,所述mavs蛋白(ncbi登录号为np_065797.2,氨基酸序列如seq id no.1所示)棕榈酰化修饰为第79位半胱氨酸残基侧链上发生的通过硫脂键共价结合的棕榈酰化修饰。研究表明,zdhhc4(zinc finger dhhc-type palmitoyltransferase 4)是mavs的棕榈酰转移酶,直接催化mavs蛋白第79位半胱氨酸残基的棕榈酰化修饰。该位点上的棕榈酰化修饰对抑制mavs蛋白降解和促进mavs活化是必需的。
6、进一步的,所述第一药剂包括具有上调肉碱棕榈酰转移酶1a(carnitine o-palmitoyltransferase 1,cpt1a)蛋白(ncbi登录号为np_001867.2,氨基酸序列如seq idno.2所示)表达水平作用的分子。本发明研究发现,提高内源性cpt1a转录表达,可以抑制mavs蛋白降解。机理研究表明,线粒体cpt1a通过结合和招募内质网蛋白zdhhc4促进mavs的棕榈酰化修饰。
7、进一步的,所述具有上调cpt1a蛋白表达水平作用的分子选自以下任意一种:
8、(1)具有上调cpt1a蛋白表达水平作用的化合物;
9、(2)具有上调cpt1a蛋白表达水平作用的用于指导crispr转录激活的sgrna;
10、(3)具有上调cpt1a蛋白表达水平作用的cdna;
11、(4)具有上调cpt1a蛋白表达水平作用的营养物质或代谢产物。
12、所述化合物可以为但不限于过氧化物酶体增殖物激活受体γ共激活剂1-α(pgc1α)的激动剂或激活剂;或者过氧化物酶体增殖物激活受体α(pparα)的激动剂或激活剂。
13、优选的,所述化合物为非诺贝特(fenofibrate)、zln005、ac-svvvrt-nh2、罗汉果皂苷vi b(mogroside vi b)、zln005氘代物(zln005-d4)、苯扎贝特(bezafibrate)、氯贝丁酯(clofibrate)、gw7647、苯扎贝特氘代物(bezafibrate-d4)、替格列扎(tesaglitazar)、过氧化物酶体增殖物激活受体激动剂1(ppar agonist 1)、匹立尼酸(pirinixic acid)、gw590735、穆拉格列扎(muraglitazar)中的至少一种。
14、本发明中,利用crispr转录激活技术激活cpt1a/cpt1a基因的转录,提高内源cpt1a的表达。优选的,所述sgrna的核苷酸序列为5’-ctaagtcccgagcttgccaa-3’。
15、本发明中,利用过表达技术提高机体内cpt1a的表达水平。优选的,所述cdna的序列为人源ctp1a蛋白编码序列,其基因登录号为nm_001876.4。
16、本发明中,第二药剂的活性成分用于促进机体内源性dsrna分子产生,dsrna通过rig-i/mda5-mavs通路激活下游的免疫应答通路,以提高肿瘤免疫原性。所述第二药剂活性成分可以为但不限于表观遗传调节剂如组蛋白去乙酰基酶抑制剂或dna甲基转移酶抑制剂等。
17、进一步的,所述第二药剂包括靶向表观遗传调控因子的小分子抑制剂或寡核苷酸,所述表观遗传调控因子参与调节内源性dsrna分子的产生。
18、所述表观遗传调控因子包括但不限于dna甲基转移酶(dnmts)、组蛋白赖氨酸特异性去甲基化酶1(lsd1)、果蝇zeste基因增强子人类同源物2(ezh2)、色斑3-9抑制因子同源物1(suv39h1)、set结构域分支型组蛋白赖氨酸甲基转移酶1(setdb1)、组蛋白赖氨酸去甲基化酶5b(kdm5b)和髓性/淋巴或混合系白血病4(mll4)中任意一种,这些表观遗传调控因子参与抑制肿瘤细胞中逆转座子的转录表达。本发明通过靶向抑制上述表观遗传调控因子可以促进内源性dsrna分子产生。
19、优选的,所述小分子抑制剂为地西他滨(decitabine)、阿扎胞苷(5-azacytidine)、瓜地西他滨(guadecitabine)、5-氟脱氧胞苷(5-fluoro-2'-deoxycytidine)、gsk2879552、cc90011、sp2577、ory1001、ory2001、img-7289、恩替诺特(entinostat)、帕比司他(panobinostat)、他泽司他(tazemetostat)、jq1中的至少一种。
20、本发明中,寡核苷酸可以通过碱基互补配对原则与所述表观遗传调控因子的dna、mrna或者pre-mrna配对,精准地“沉默”所述表观遗传调控因子表达。所述寡核苷酸可以为但不限于向导rna(guide rna)、反义寡核苷酸(antisense oligonucleotides,aso)、sirna(small interfering rna)、microrna和核酸适配体(aptamer)。
21、优选的,所述组蛋白赖氨酸特异性去甲基化酶1(lsd1)反义寡核苷酸的序列为5’-gcctagacattaaactgaata-3’(人源)。
22、优选的,所述lsd1向导rna序列为5’-tggaatagcagagactccgg-3’(人源)或5’-cctgagaggtcattcggtca-3’(鼠源)。
23、进一步的,所述抗肿瘤药物中还包括含有免疫治疗药物的第三药剂。所述第三药剂活性成分用于肿瘤免疫治疗。本发明中,第一药剂和第二药剂协同促进肿瘤微环境的炎性转变,提高肿瘤免疫原性,实现肿瘤对第三药剂免疫疗法的有效应答。
24、进一步的,所述第三药剂包括但不限于免疫检查点阻断剂或细胞治疗药物。
25、优选的,所述免疫检查点阻断剂为pd1阻断剂或pd-l1阻断剂,可以为但不限于单克隆抗体、多肽、寡核苷酸和小分子化合物。具体的,所述单克隆抗体可以为但不限于帕博利珠单抗(keytruda)、纳武利尤单抗(opdivo)、西米普利单抗(libtayo)、卡瑞利珠单抗(艾瑞卡)、信迪利单抗(达泊舒)、特瑞普利单抗(拓益)、替雷利珠单抗(百泽安)、阿替利珠单抗(tecentriq)、阿维鲁单抗(bavencio)和度伐利尤单抗(imfinzi)。
26、优选的,所述细胞治疗药物为回输自体或异体的免疫细胞或工程化改造的免疫细胞,可以为但不限于cd8阳性肿瘤浸润t淋巴细胞(cd8+til)、嵌合抗原受体t细胞(car t)、t细胞受体基因工程改造的t细胞(tcr t)和嵌合抗原受体自然杀伤细胞(car nk)。
27、本发明中,所述肿瘤为实体肿瘤。
28、进一步的,所述实体肿瘤为皮肤黑色素瘤、肾上腺皮质癌、甲状腺癌、膀胱尿路上皮癌、食管癌、乳腺浸润癌、弥漫性大b细胞淋巴瘤、胆管癌、睾丸癌、多形成性胶质细胞瘤、胶质瘤、头颈鳞状细胞癌、肾嫌色细胞癌、肾透明细胞癌、子宫肉瘤、混合肾癌、肾乳头状细胞癌、肝细胞肝癌、前列腺癌、肺腺癌、肺鳞癌、小细胞肺癌、间皮瘤、卵巢浆液性囊腺癌、宫颈鳞癌和腺癌、胰腺癌、结肠癌、直肠腺癌、结直肠癌、嗜铬细胞瘤和副神经节瘤、肉瘤、胃癌、子宫内膜癌、胸腺癌、葡萄膜黑色素瘤中的至少一种。
29、进一步的,所述第一药剂、第二药剂、第三药剂除了上述活性成分,还包括药学上可接受的载体。
30、进一步的,所述药物的给药方式为第一药剂、第二药剂、第三药剂同时给药或贯序给药。
31、本发明还提供了一种用于治疗荷瘤哺乳动物中肿瘤的药物组合物,所述药物组合物包括促进线粒体抗病毒信号蛋白(mavs)棕榈酰化修饰的第一药剂和促进内源性dsrna分子产生的第二药剂;或者所述药物组合物包括促进线粒体抗病毒信号蛋白(mavs)棕榈酰化修饰的第一药剂、促进内源性dsrna分子产生的第二药剂和包括免疫治疗药物的第三药剂。
32、所述药物组合物的给药方式可以为本领域常用的模式,包括口服、局部、吸入和注射。
33、进一步的,所述第一药剂以过氧化物酶体增殖物激活受体γ共激活剂1-α的激动剂或激活剂和过氧化物酶体增殖物激活受体α的激动剂或激活剂计,使用剂量为1~500毫克每千克体重,每0.5~7天给药一次。
34、进一步的,所述第二药剂以小分子抑制剂为地西他滨(decitabine)、阿扎胞苷(5-azacytidine)、瓜地西他滨(guadecitabine)、5-氟脱氧胞苷(5-fluoro-2'-deoxycytidine)、gsk2879552、cc90011、sp2577、ory1001、ory2001、img-7289、恩替诺特(entinostat)、帕比司他(panobinostat)、他泽司他(tazemetostat)、jq1计,使用剂量为0.1~50毫克每千克体重,每0.5~7天给药一次。
35、进一步的,所述第三药剂以pd1阻断剂或pd-l1阻断剂计,使用剂量为1~20毫克每千克体重,每1~8周给药一次。
36、本发明具备的有益效果:
37、本发明将用于提高mavs棕榈酰化修饰水平的调节剂应用于制备肿瘤免疫治疗药物中,在表观遗传药物疗法或者在表观遗传与免疫疗法联合用药治疗肿瘤策略中增加mavs棕榈酰化修饰调节,利用mavs棕榈酰化修饰调节剂促进mavs棕榈酰化修饰有效提高mavs的蛋白稳定性和活化水平,能够充分发挥表观遗传药物激活的免疫应答通路,协同促进肿瘤微环境的炎性转变,提高肿瘤免疫原性,从而增强t细胞浸润水平和杀伤肿瘤的作用,实现肿瘤对免疫疗法的有效应答。
- 还没有人留言评论。精彩留言会获得点赞!