二氢卟吩修饰的金属氧化物纳米酶诊疗系统及其制备方法与应用
本发明属于生物与医学纳米材料及,具体涉及一种二氢卟吩修饰的金属氧化物纳米酶诊疗系统的制备方法及应用。
背景技术:
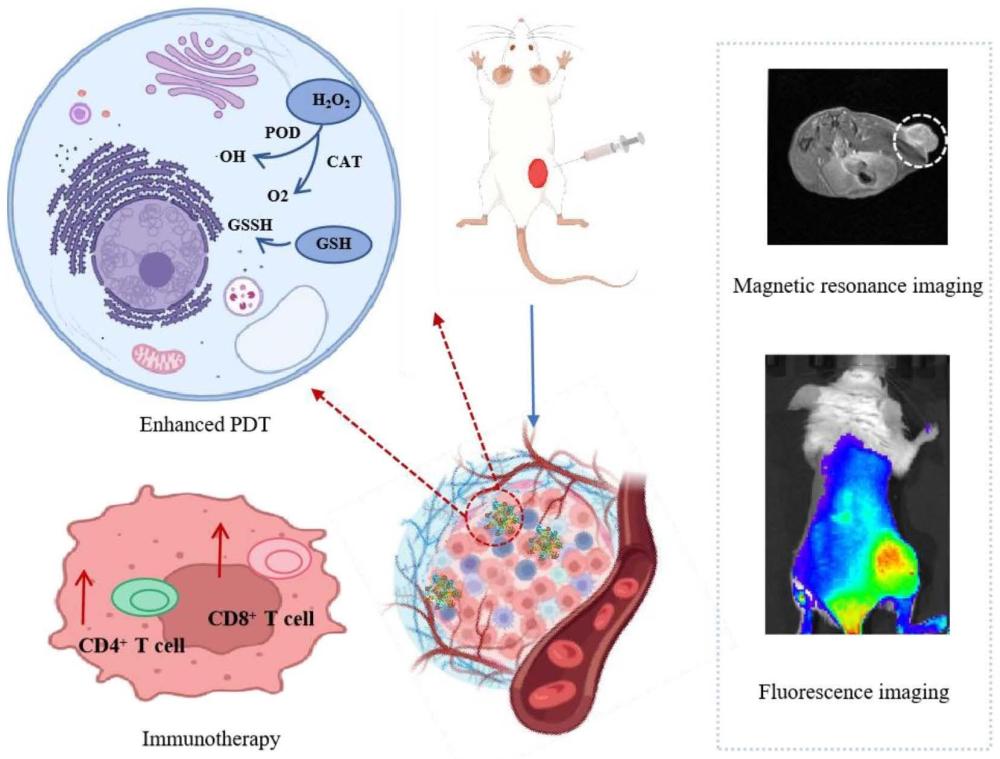
1、光动力治疗(photodynamic therapy,pdt)作为一种非侵入性治疗手段,对人体毒副作用较小,是近年来迅速发展起来的肿瘤治疗手段。其利用富集在肿瘤部位的光敏剂,经特定波长激光照射后将周围的氧气(o2)转变为具有细胞毒性的活性氧(reactive oxygenspecies,ros),从而杀灭肿瘤细胞。尽管pdt在肿瘤治疗领域取得了许多重大进展,但缺氧的肿瘤微环境(tumor microenvironment,tme)仍是pdt临床应用中难以突破的瓶颈。o2是光动力治疗中不可缺少的物质,但是肿瘤细胞的恶性增殖,瘤内血管的无规则增长,造成的瘤内供血不畅,血管阻塞,都会引起肿瘤微环境的缺氧,从而严重影响光动力治疗实际应用效果。因此,为提高pdt疗效,肿瘤微环境缺氧问题亟须解决。
2、目前已经开发出许多缓解肿瘤微环境缺氧的方法,其中利用纳米颗粒运输或产生o2,是一种比较好的策略。一方面,纳米颗粒可以利用自身的类酶活性,原位生成光动力治疗所需的o2,从而增加光动力治疗效果。另一方面,纳米颗粒可以通过高通透性和滞留效应(enhanced permeability and retention effect,epr)靶向到达肿瘤部位,保证o2的高效运输。近年来,金属氧化物纳米酶在生物领域的应用得到快速研究和发展。由于其独特的类酶活性,可以通过其类过氧化氢酶(catalase,cat)活性将肿瘤组织中较高含量的h2o2催化成o2,增强pdt的疗效,或者通过类过氧化物酶(peroxidase,pod)活性和超氧化物歧化酶(superoxide dismutase,sod)活性将h2o2和o2催化产生ros,诱导肿瘤细胞凋亡。与此同时,纳米酶也可以促进肿瘤相关巨噬细胞的转变,改善肿瘤微环境的免疫抑制,从而增强免疫治疗作用。
3、因此,为了解决肿瘤微环境缺氧问题、增强pdt疗效和免疫杀伤作用,本实验提出一种基于四氧化三铁/二氧化锰复合纳米酶(fe3o4/mno2)为核心的纳米酶诊疗系统(magnetic nano-platform,mnpt)的构建方案。mnpt由牛血清白蛋白(bovine albumin,bsa)修饰的二氧化锰(mno2)和多巴胺(dopamine,dpa)修饰的四氧化三铁(fe3o4)纳米颗粒以及光敏剂二氢卟吩e6(chlorin e6,ce6)构成。mnpt作为纳米材料可以通过实体瘤的高通透性和滞留效应被动靶向到肿瘤部位。然后通过其类过氧化氢酶活性产生o2,通过芬顿反应产生羟基自由基(·oh),从而缓解肿瘤微环境缺氧问题,增强pdt的疗效,同时增强肿瘤细胞免疫原性死亡。此外,mnpt的超顺磁性使其可以作为磁共振成像的造影剂,从而提供荧光-磁共振双模态成像,实时跟踪并反馈治疗效果。
技术实现思路
1、本发明的目的是缓解缺氧的肿瘤微环境限制光动力治疗疗效的问题。利用纳米技术设计出一种二氢卟吩修饰的金属氧化物纳米酶诊疗系统,用于缓解肿瘤微环境缺氧问题、增强光动力治疗疗效和免疫杀伤作用。
2、本发明通过以下技术方案予以实现:
3、一种二氢卟吩修饰的金属氧化物纳米酶诊疗系统的制备方法,包括以下制备步骤:
4、采用高温热解法制备油相的纳米颗粒oam@fe3o4;
5、利用所述纳米颗粒oam@fe3o4采用配体交换法制备水溶性磁性纳米颗粒dpa@fe3o4;
6、制备磁性纳米颗粒bsa@mno2;
7、利用所述纳米颗粒oam@fe3o4和所述磁性纳米颗粒bsa@mno2制备纳米酶诊疗系统mnpt。
8、作为本发明的一个优选的方面,所述采用高温热解法制备油相的纳米颗粒oam@fe3o4包括:
9、称取5.25g(15mmol)乙酰丙酮铁(fe(acac)3)粉末于500ml三口烧瓶中,然后加入40ml(210mmol)二苄醚和60ml(165mmol)油胺,混合均匀,反应物在氮气保护及冷凝管回流状态下进行程序升温反应,在反应开始前,往反应容器中先通入氮气以确保除去装置中的氧气;氮气流速为50ml/min,持续时间约5min;
10、然后,将调节控温装置中各个连接口用封口膜包封,将调节控温装置设置成两个阶段的程序升温过程:第一阶段为从室温升至220℃后温度恒定维持1h,升温速度为3.3℃/min;第二阶段为从220℃继续升温至290℃后维持恒定温度5min,升温速度为3.3℃/min;调节控温装置可采用德国优莱博(julabo)公司所生产的可编程控温仪lc6。
11、在反应结束后,快速撤去加热装置使反应体系中的溶液温度骤降至室温,即可获得粒径为5nm的oam@fe3o4。
12、作为本发明的一个优选的方面,所述利用所述纳米颗粒oam@fe3o4采用配体交换法制备水溶性磁性纳米颗粒dpa@fe3o4包括:
13、称取400mg盐酸多巴胺于250ml的三口烧瓶中,加入40ml无水二甲基亚砜(dmso)和40ml氯仿混合液将其溶解,混合均匀;
14、然后,将搅拌器转速调至1000rpm/min,在70℃水浴超声条件下逐滴加入20ml浓度为10mg fe/ml的oam@fe3o4;反应2h后将反应物取出置于超速离心管中并加入20ml氯仿,转速为5000rpm/min,离心5min,去除上清液,用氮气将沉淀物吹干,然后加入40ml超纯水超声溶解,调节溶液ph至4.0,即可得到多巴胺包裹的水溶性超小超顺磁性fe3o4纳米颗粒(dpa@fe3o4)。
15、作为本发明的一个优选的方面,所述利用所述纳米颗粒oam@fe3o4和所述磁性纳米颗粒bsa@mno2制备纳米酶诊疗系统mnpt包括:
16、称取31.6mg高锰酸钾溶于3ml超纯水中备用,将250mg牛血清蛋白溶于7ml超纯水后,逐滴滴入高锰酸钾溶液中,并在37℃下磁力搅拌2h,即可得到bsa@mno2。
17、所述制备纳米酶诊疗系统mnpt包括:
18、取0.5ml的bsa@mno2,1.3ml的超纯水和50μl二氢卟吩e6混合均匀,然后加入浓度为2.5mg/ml的edc 200μl,在37℃度摇床中放置4h后储存在4℃,静置过夜;于次日边涡旋边加入100μl dpa@fe3o4,即可获得纳米酶诊疗系统mnpt。
19、一种基于上述制备的二氢卟吩修饰的金属氧化物纳米酶诊疗系统,该纳米酶诊疗系统主要由牛血清白蛋白修饰的二氧化锰纳米颗粒、多巴胺修饰的四氧化三铁纳米颗粒和光敏剂二氢卟吩e6构成。
20、作为本发明的一个优选的方面,所述牛血清白蛋白修饰的二氧化锰纳米颗粒、多巴胺修饰的四氧化三铁纳米颗粒和光敏剂二氢卟吩e6的质量比为3:1:1。
21、作为本发明的一个优选的方面,金属氧化物纳米酶诊疗系统的核心为四氧化三铁/二氧化锰复合纳米酶;该纳米酶诊疗系统在水溶液中稳定存在,水动力尺寸约为25.79±3.45nm。
22、作为本发明的一个优选的方面,该金属氧化物纳米酶诊疗系统通过光敏剂自身的荧光进行荧光成像,或者,该金属氧化物纳米酶诊疗系统通过磁性纳米颗粒进行磁共振成像。
23、作为本发明的一个优选的方面,该金属氧化物纳米酶诊疗系统通过高通透性和滞留效应被动靶向到肿瘤部位。
24、与现有技术相比,本发明具有如下有益效果
25、本发明中的纳米酶诊疗系统可以缓解肿瘤微环境缺氧问题,从而提高光动力治疗效果,同时提高免疫疗效。一方面,偶联在该纳米酶诊疗系统的光敏剂可以通过高渗透性和滞留效应被动靶向到肿瘤部位,增强其在肿瘤部位的滞留时间。另一方面,纳米酶诊疗系统由金属氧化物纳米酶构成,可以发挥类过氧化氢酶和类过氧化物酶活性,从而产生氧气和羟基自由基,缓解肿瘤光动力治疗缺氧问题,提高对肿瘤的杀伤效果。同时纳米酶诊疗系统还可以提供荧光-磁共振双模态成像,实时监控并反馈效果。
26、参照后文的说明和附图,详细公开了本发明的特定实施方式,指明了本发明的原理可以被采用的方式。应该理解,本发明的实施方式在范围上并不因而受到限制。
27、针对一种实施方式描述和/或示出的特征可以以相同或类似的方式在一个或更多个其它实施方式中使用,与其它实施方式中的特征相组合,或替代其它实施方式中的特征。
28、应该强调,术语“包括/包含”在本文使用时指特征、整件、步骤或组件的存在,但并不排除一个或更多个其它特征、整件、步骤或组件的存在或附加。
- 还没有人留言评论。精彩留言会获得点赞!