一种吡啶酮衍生物的应用的制作方法
本发明涉及生物医药,具体涉及吡啶酮衍生物在制备治疗纤维化的药物中的应用。
背景技术:
1、纤维化(fibrosis)是一种系统性疾病,可以影响任何器官,更常见于心脏、肺、肾、肝和皮肤,是多种类型组织损伤尤其是在慢性炎症性疾病过程中,组织修复反应失调的结局,不同的纤维增生性疾病中的纤维化有各自的独特机制。据报道,在工业化世界中,因纤维化引起的死亡人数占总死亡人数比例的45%。
2、肠纤维化的主要驱动因素是可溶性分子(例如细胞因子和生长因子)、g蛋白偶联受体、上皮间质转化、内皮间质转化以及肠道微生物群等。免疫抑制剂和抗炎生物制剂虽然可以缓解炎症并改善相关临床症状,但其均无直接的抗纤维化效果,并不能减轻已发生的肠道纤维化或阻止后续的纤维化进程。因此,目前尚无针对肠纤维化治疗药物获批,肠纤维化引起的肠道狭窄治疗方案仍以手术和内镜下治疗为主(d'alessio s et al,nat revgastroenterol hepatol.2022mar;19(3):169-184.;胡帆等,中国医学前沿杂志(电子版).2021年第13卷第7期:14-21页)。
3、非酒精性肝纤维化是指除酒精外的其他致病因素引起的肝脏内结缔组织异常增生。
4、长期以来,人们一直认为纤维化不可逆,但临床前模型和临床试验均表明,它是一个高度动态变化的过程。吡非尼酮最初被批准用于特发性肺纤维化(ipf),后续研究表明其在其他纤维化模型中也显示有治疗纤维化疾病的作用。但吡非尼酮药效较差且毒副作用较强,寻找新的抗纤维化药物迫在眉睫。
技术实现思路
1、本发明要解决的技术问题是现有治疗肠纤维化或非酒精性肝纤维化的药物用量大。本发明提供了一种吡啶酮衍生物的应用,使用较少的该类化合物就能够治疗和/或预防肠纤维化和非酒精性肝纤维化。
2、本发明提供了一种物质a在制备药物中的应用,所述物质a为如式ⅰ所示化合物或其药学上可接受的盐;所述药物为治疗和/或预防肠纤维化或非酒精性肝纤维化的药物;
3、
4、所述应用中,所述肠纤维化优选为炎症性肠病引起的肠纤维化。
5、所述应用中,所述肠纤维化更优选为克罗恩病肠纤维化。
6、所述应用中,所述药物的施用频率可为1次/日、2次/日或3次/日;优选为2次/日。
7、所述应用中,所述药物的单位剂量可根据受试者/患者的起效量来确定;所述物质a的单位剂量可为25-900mg,优选为50-600mg,更优选为200-400mg。
8、所述应用中,每次施用所述药物时,所述药物的单次剂量可根据受试者/患者的实际治疗效果来确定;较佳地,所述药物的单次剂量为所述物质a与受试者/患者的质量比,所述质量比可为3-40mg/kg,优选为3mg/kg、6mg/kg、10mg/kg、15mg/kg、30mg/kg或40mg/kg。
9、所述应用中,当所述药物为治疗和/或预防肠纤维化的药物时,所述药物的单次剂量可为所述物质a与受试者/患者的质量比,所述质量比可为3-40mg/kg,优选为3mg/kg、6mg/kg、10mg/kg、15mg/kg、30mg/kg或40mg/kg。
10、所述应用中,当所述药物为治疗和/或预防非酒精性肝纤维化的药物时,所述药物的单次剂量可为所述物质a与受试者/患者的质量比,所述质量比可为3-40mg/kg,优选为3mg/kg、6mg/kg、10mg/kg、15mg/kg、30mg/kg或40mg/kg。
11、所述应用中,每次施用所述药物时,所述药物的日用剂量可根据受试者/患者的实际治疗效果来确定;较佳地,所述药物的日用剂量为所述物质a与受试者/患者的质量比,所述质量比可为3-80mg/kg,优选为3mg/kg、6mg/kg、12mg/kg、15mg/kg、30mg/kg、40mg/kg、60mg/kg或80mg/kg。
12、所述应用中,当所述药物为治疗和/或预防肠纤维化的药物时,所述药物的日用剂量可为所述物质a与受试者/患者的质量比,所述质量比可为3-80mg/kg,优选为3mg/kg、6mg/kg、12mg/kg、15mg/kg、30mg/kg、40mg/kg、60mg/kg或80mg/kg。
13、所述应用中,当所述药物为治疗和/或预防非酒精性肝纤维化的药物时,所述药物的日用剂量可为所述物质a与受试者/患者的质量比,所述质量比为3-80mg/kg,优选为3mg/kg、6mg/kg、12mg/kg、15mg/kg、30mg/kg、40mg/kg、60mg/kg或80mg/kg。
14、所述应用中,所述药物中如式ⅰ所示化合物在药物中的浓度可为0.3-3mg/ml;优选为0.3mg/ml、0.6mg/ml、1mg/ml、1.5mg/ml或3mg/ml。
15、所述应用中,所述药物可包含物质a和其药学上可接受的载体。
16、所述应用中,所述药学上可接受的载体可为本领域常规载体。
17、所述应用中,所述药物可经胃肠道给药,优选口服。
18、所述应用中,所述药物的剂型可为本领域常规剂型,所述药物的剂型可为固体制剂。
19、所述应用中,所述如式ⅰ所示化合物占所述药物的质量分数为3%-50%,优选10-20%。
20、本发明还提供一种药物组合物,包括物质a和其药学上可接受的载体;所述物质a为如式ⅰ所示化合物或其药学上可接受的盐;
21、
22、所述药物组合物中,所述如式ⅰ所示化合物的质量分数为3%-50%。
23、所述药物组合物中,所述如式ⅰ所示化合物的质量分数可为10%-20%。
24、本发明还提供一种药物组合物在制备治疗和/或预防肠纤维化或非酒精性肝纤维化药物中的应用。
25、所述应用中,所述肠纤维化优选为炎症性肠病引起的肠纤维化;更优选为克罗恩肠纤维化。
26、本发明还提供了一种治疗和/或预防肠纤维化或非酒精性肝纤维化的方法,所述方法包括:向受试者/患者施用治疗有效量物质a或药物,所述药物包含物质a和其药学上可接受的载体;所述物质a为如式ⅰ所示化合物或其药学上可接受的盐;
27、
28、所述方法中,所述药学上可接受的载体为本领域常规载体。
29、所述方法中,所述肠纤维化优选为炎症性肠病引起的肠纤维化;更优选为克罗恩肠纤维化。
30、所述方法中,所述药物的施用频率可为1次/日、2次/日或3次/日,优选为2次/日。
31、所述方法中,所述药物的单位剂量可根据受试者/患者的起效量来确定;优选地,所述物质a的单位剂量可为25-900mg,优选为50-600mg,更优选为200-400mg。
32、所述方法中,每次施用所述药物时,所述药物的单次剂量可根据受试者/患者的实际治疗效果来确定;较佳地,所述药物的单次剂量可为所述物质a与受试者/患者的质量比,所述质量比可为3-40mg/kg,优选为3mg/kg、6mg/kg、10mg/kg、15mg/kg、30mg/kg或40mg/kg。
33、所述方法中,当所述药物为治疗和/或预防肠纤维化的药物时,所述药物的单次剂量可为所述物质a与受试者/患者的质量比,所述质量比可为3-40mg/kg,优选为3mg/kg、6mg/kg、10mg/kg、15mg/kg、30mg/kg或40mg/kg。
34、所述方法中,当所述药物为治疗和/或预防非酒精性肝纤维化的药物时,所述药物的单次剂量可为所述物质a与受试者/患者的质量比,所述质量比可为3-40mg/kg,优选为3mg/kg、6mg/kg、10mg/kg、15mg/kg、30mg/kg或40mg/kg。
35、所述方法中,每次施用所述药物时,所述药物的日用剂量可根据受试者/患者的实际治疗效果来确定;较佳地,所述药物的日用剂量可为所述物质a与受试者/患者的质量比,所述质量比可为3-80mg/kg,优选为3mg/kg、6mg/kg、12mg/kg、15mg/kg、30mg/kg、40mg/kg、60mg/kg或80mg/kg。
36、所述方法中,当所述药物为治疗和/或预防肠纤维化的药物时,所述药物的日用剂量可为所述物质a与受试者/患者的质量比,所述质量比可为3-80mg/kg,优选为3mg/kg、6mg/kg、12mg/kg、15mg/kg、30mg/kg、40mg/kg、60mg/kg或80mg/kg。
37、所述方法中,当所述药物为治疗和/或预防非酒精性肝纤维化的药物时,所述药物的日用剂量可为所述物质a与受试者/患者的质量比,所述质量比可为3-80mg/kg,优选为3mg/kg、6mg/kg、12mg/kg、15mg/kg、30mg/kg、40mg/kg、60mg/kg或80mg/kg。
38、所述方法中,所述药物中如式ⅰ所示化合物在药物中的浓度可为0.3-3mg/ml;优选为0.3mg/ml、0.6mg/ml、1mg/ml、1.5mg/ml或3mg/ml。
39、所述方法中,所述药物可经胃肠道给药;优选口服。
40、所述方法中,所述药物的剂型可为本领域常规剂型,所述药物的剂型可为固体制剂。
41、除非另有说明,本文所用的下列术语和短语旨在具有下列含义。一个特定的术语或短语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照普通的含义去理解。当本文中出现商品名时,意在指代其对应的商品或其活性成分。
42、这里所采用的术语“药学上可接受的”,是针对那些化合物、材料、组合物和/或剂型而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
43、术语“药学上可接受的载体”是指能够递送本发明有效量活性物质、不干扰活性物质的生物活性并且对宿主或者患者无毒副作用的任何制剂或载体介质代表性的载体包括水、油、蔬菜和矿物质、膏基、洗剂基质、软膏基质等。这些基质包括悬浮剂、增粘剂、透皮促进剂等。它们的制剂为化妆品领域或局部药物领域的技术人员所周知。关于载体的其他信息,可以参考remington:the science and practice of pharmacy,21st ed.,lippincott,williams&wilkins(2005),该文献的内容通过引用的方式并入本文。
44、术语“治疗”指治疗性疗法。涉及具体病症时,治疗指:(1)缓解疾病或者病症的一种或多种生物学表现,(2)干扰(a)导致或引起病症的生物级联中的一个或多个点或(b)病症的一种或多种生物学表现,(3)改善与病症相关的一种或多种症状、影响或副作用,或者与病症或其治疗相关的一种或多种症状、影响或副作用,或(4)减缓病症或者病症的一种或多种生物学表现发展。
45、术语“预防”是指获得或发生疾病或障碍的风险降低。
46、术语“治疗有效量”是指在给予患者时足以有效治疗本文所述疾病或病症的化合物的量。“治疗有效量”将根据化合物、病症及其严重度、以及欲治疗患者的年龄而变化,但可由本领域技术人员根据需要进行调整。
47、术语“患者”是指根据本发明的实施例,即将或已经接受了该化合物给药的任何动物,哺乳动物为优,人类最优。术语“哺乳动物”包括任何哺乳动物。哺乳动物的实例包括但不限于牛、马、羊、猪、猫、狗、小鼠、大鼠、家兔、豚鼠、猴、人等,以人类为最优。
48、在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
49、本发明所用试剂和原料均市售可得。
50、本发明的积极进步效果在于:
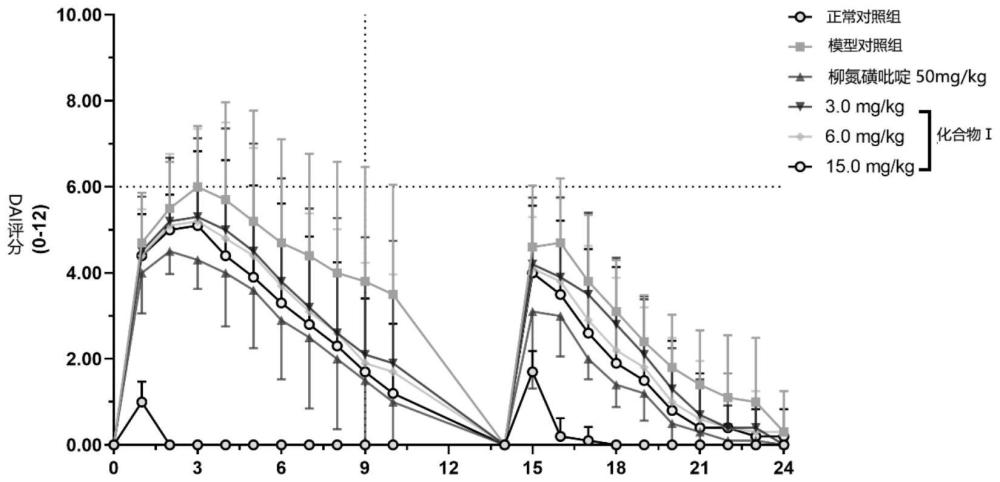
51、本发明如式ⅰ所示化合物治疗/或预防肠纤维化和非酒精性肝纤维化较小剂量即可达到很好的药效。进一步,本发明如式ⅰ所示化合物在治疗/或预防肠纤维化和非酒精性肝纤维化起改善效应的起效剂量为3.0mg/kg。
- 还没有人留言评论。精彩留言会获得点赞!