一种基于近红外二区光的无线神经抑制性调控技术及其应用
本发明涉及光调控,具体地,涉及一种基于近红外二区光的无线神经抑制性调控技术及其应用。
背景技术:
1、脑科学已成为全球科技与健康领域最为关注的热点研究。世界各国竞相推出“脑计划”,以增强人类对大脑的认知,深入探索大脑运行机制,并寻找脑疾病(神经及精神类疾病)的治疗方法。神经元是大脑最重要的组成单元,不同种类的神经元形成的神经元集群构成了大脑的各个脑区,调控机体的一切行为活动(包括认知、情绪、记忆、运动、睡眠等),并且相关脑区神经元病理性变化是诱导脑疾病发生发展的关键因素。神经调控技术通过侵入或非侵入大脑的方法,兴奋或抑制神经元电活动,解析各个脑区对机体行为活动的调控机制。神经调控技术也通过刺激病理脑区电活动,缓解脑疾病引起的机体行为活动障碍,为脑疾病提供了潜在可行的治疗方法,所以对神经调控技术的探索一直是脑科学研究的前沿领域之一。
2、目前电刺激、磁刺激、超声刺激、化学刺激等神经调控技术展现出良好的神经调控能力,但这些神经调控技术作用于全脑或大面积脑区,并且作用靶点不明确,也无法同时兼备较高的时空分辨率。而基于光学的神经调控技术通过将光敏离子通道导入目的神经元,通过光响应激活或抑制神经元兴奋性,实现神经调控的高效时空分辨率(毫秒级的时间分辨率与亚细胞级的空间分辨率),所以光遗传学神经调控技术是目前神经调控领域的常用技术手段。
3、光遗传学技术对神经调控依赖于光敏感离子通道,而其响应的光波长均处于可见光波段(400nm-700nm),由于可见光较强的组织吸收与散射,其组织穿透能力较弱(<1mm),所以对深部脑区的神经调控采用光纤植入的方式。但光纤植入不仅对其覆盖的头皮、颅骨及接触的脑组织造成永久性损伤,也会在光纤v组织界面诱发免疫反应,造成小胶质细胞增生,影响神经元信号的正常采集,并且发育、社交行为等神经调控无法在有线的光纤植入下开展,这也限制了其在临床上向脑疾病治疗领域的拓展。
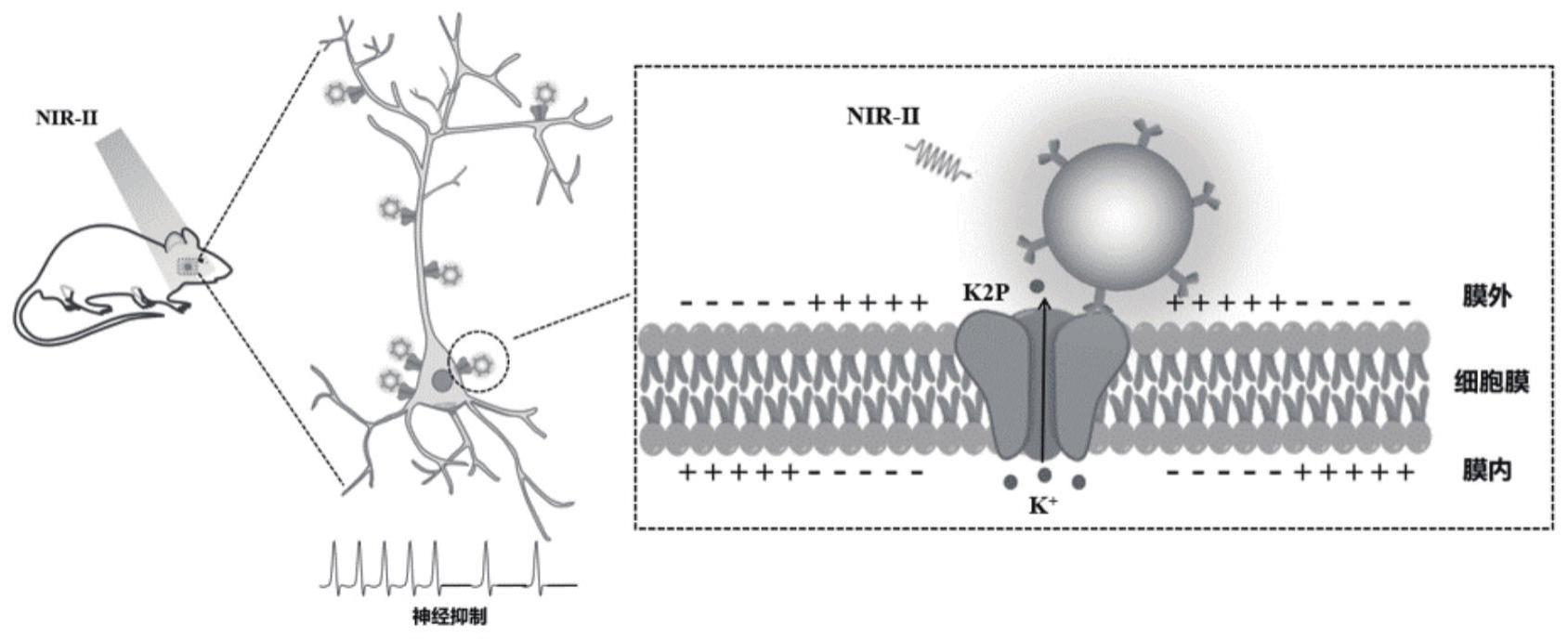
4、近红外二区光(900nm-1700nm)的组织吸收与散射较弱,穿透能力较强(~cm),这为无线深部脑区神经调控提供了理想的工具。但由于尚未发现能够对nir-ii区光显著响应的离子通道等神经调控蛋白,所以nir-ii区光对深部脑区的神经调控需要借助具有特殊功能的调控元件。近期研究发现,一些具有特殊功能的光转换纳米材料(nir-ii上转换纳米材料、nir-ii光热转换纳米材料、nir-ii光声转换纳米材料)可以将nir-ii区光转换为可见光、热、声(振动)等,激活可见光响应、温控及机械门控的离子通道,实现对神经元的无线调控。
5、目前nir-ii区无线神经调控主要通过于目的脑区注射高浓度nir-ii区光转换材料,经nir-ii区光照射后改变脑内局部环境变化(光、声、热),引起相应离子通道响应,进行神经调控。目前神经调控虽然实现了活体水平的无线神经兴奋性调控,但尚未在活体水平实现无线神经抑制性调控。
6、k2p通道是一类由kcnk基因家族编码的,具有四次跨膜和两个孔道(4tm/2p)结构的离子通道。在静息状态下,k2p通道能够形成背景电流或漏电流,从而维持细胞的静息膜电位水平。目前在哺乳动物中已克隆15个k2p通道,按照在不同条件刺激下产生多种反应功能可被分为6类:trek-1、trek-2和traak通道;task-1、task-3和task-5通道;talk-1、talk-2、task2通道;tresk通道;kcnk7、twik-1和twik-2通道;thik-1和thik-2通道。k2p通道结构组成具有一定的共同性,它们都形成功能性的二聚体结构,每个亚单位含有四个跨膜结构(tm1-tm4)和两个孔道结构域(p1,p2)。通道的氨基端n端和羧基端c端位于胞内,胞外侧m1与p1之间有一段独特的α螺旋结构(m1p1loop),在孔道上方形成特殊的“帽子”(cap)结构。k2p是一个多调式的双孔钾离子通道,通道活性除了受机械力调控外,还可以受温度、胞内外ph、脂质、挥发性麻醉药等刺激因素的调控。
7、综上所述,鉴于k2p离子通道的温控特性,采用光热转换机制,借助nir-ii区光强的组织穿透能力,利用nir-ii区光热转换材料,靶向调控k2p离子通道的开放,实现无线神经抑制性调控。
技术实现思路
1、针对现有技术存在的技术问题,本发明的目的在于提供,一种基于近红外二区光的无线神经抑制性调控技术,解决现有技术光遗传领域中存在的有创、侵入性等技术问题,建立活体无线神经抑制调控新技术,实现神经无线抑制性光调控。
2、为实现上述目的,本发明提供了以下技术方案,一种基于近红外二区光的无线神经抑制性调控技术,k2p离子通道作为调控靶点,利用k2p离子通道的温控特性,合成外表面偶联k2p抗体,能够高效靶向k2p的nir-ii区光热转换材料,以nir-ii区光作为刺激媒介,实现神经细胞的高时空分辨率操控,从而建立一种活体无线神经抑制调控新技术,实现神经无线抑制性光调控。具体地,在神经调控过程中,不需要对动物进行手术植入侵入性的光纤,使用具有高组织穿透性的nir-ii区光激发生物体内的光热转换材料,通过光热转换打开k2p通道,抑制神经元兴奋性,实现无线神经抑制性调控。
3、优选地,所述nir-ii区光热转换材料采用具有nir-ii区光热转换效率的光热转换材料偶联k2p抗体制备得到。
4、优选地,基于所述nir-ii区光热转换材料对k2p的靶向性的基础上,在体外细胞水平实现nir-ii区光对神经元的抑制性调控。
5、具体地,所述无线神经抑制性调控的步骤包括:
6、s1.选用目前具有良好nir-ii区光热转换效率的所述nir-ii区光热转换材料偶联k2p抗体,制备具有靶向性nir-ii区光热转换材料;
7、s2.检测nir-ii区光热转换材料对k2p的靶向性;
8、s3.在靶向的基础上,于体外细胞水平实现nir-ii区光对神经元的抑制性调控;
9、s4.通过活体动物实验,在相关联的脑区通过腺病毒注射导入k2p离子通道,并注射nir-ii区光热转换材料,实现在nir-ii区光照射下对活体相关脑区的所述无线神经抑制性调控。
10、优选地,s1中,所述nir-ii区光热转换材料包括空心氧化硅纳米颗粒(h-sioxnps),金等离子黑体(aupbs)、大分子近红外纳米传感器(minds)、有机半导体多聚物(spns)中的任一种。
11、优选地,所述nir-ii区光热转换材料通过对材料外表面进行羧基或氨基化修饰,将k2p抗体偶联于所述nir-ii区光热转换材料上。
12、优选地,s2中,检测nir-ii区光热转换材料靶向k2p离子通道,通过对nir-ii区光热转换材料通过荧光修饰与k2p进行免疫荧光共定位,检测nir-ii区光热转换材料对k2p的靶向性。
13、优选地,所述荧光修饰包括连接荧光分子cy5.5或fitc。
14、优选地,s3中,利用原代神经元,表达k2p蛋白,运用nir-ii区光热转换材料靶向k2p离子通道,通过膜片钳技术,记录体外实验的不同功率在nir-ii区的光照射下原代神经元电活动的变化。
15、优选地,所述功率0~1.0w/cm2;光照射时间为<40s。
16、优选地,所述原代神经元电活动包括膜电位、动作电位和突触传递。
17、优选地,s4中,通过立体定位小鼠大脑皮层区注射腺相关病毒aav5-esyn-k2p-p2a-mcherry,4周后,继续于相同脑区注射所述nir-ii区光热转换材料,2~3天后,记录在nir-ii区的光照射前后,小鼠大脑皮层区的电活动变化;通过冰冻切片,免疫荧光染色实验检测nir-ii区光热转换材料对k2p的靶向情况;光照的功率为0~1.0w/cm2,照射时间为<5min。
18、优选地,所述全细胞膜片钳技术包括用微电极拉制仪将毛细玻璃管拉制成记录电极。在倒置显微镜下操纵微电极操纵仪将记录电极接触到细胞上,给予负压抽吸,形成gω封接,封接电阻≥1gω。形成gω封接后进行快速电容补偿,然后继续给予负压,吸破细胞膜,形成全细胞记录模式,进行电压钳记录。记录不同功率条件的光刺激下各实验组目标细胞的膜电位值变化情况,分析研究目标细胞抑制情况,证实本发明这种基于nir-ii区光通过光热转换无线神经抑制性调控的技术可在体外实现。
19、上述基于近红外二区光的无线神经抑制性调控技术能够应用于在抑制神经元系统中,如神经功能网络的研究,需要说明的是,本发明的技术方案不包括治疗方法。
20、本发明技术方案的技术效果:
21、1.本发明公开了一种nir-ii区光热转换材料在无线神经调控方面的应用。该发明实际操作性高,可以通过脑定位注射将病毒载体与光热转换材料注射在目的脑区进行操作。并以nir-ii区光作为刺激媒介,可实现神经细胞的高时空分辨率操控。此方案对实验动物的创伤远远小于传统方法,不需要光纤植入来局部激活细胞,也不必穿戴任何光学器件,仅通过设计的弥散光大范围刺激目标即可完成对特定细胞的光控抑制过程。
22、2.采用本发明的技术方案,nir-ii区光的使用相较于可见光激发可以减少生物组织对光的散射、吸收,大幅提高生物组织的穿透能力。而光热转换材料由于本身的高光热转换效率,可以高效的完成对目标细胞的光控过程,达到对神经元细胞兴奋性的控制。
23、3.采用本发明的技术方案,k2p离子通道属于一种抑制性通道,其开放会抑制神经元兴奋性,本发明利用k2p离子通道的温控特性,结合光热转换纳米材料,实现光远程调控离子通道的开放程度。
- 还没有人留言评论。精彩留言会获得点赞!