一种负载药物的MOF纳米粒子及其制备方法和应用
本发明涉及纳米生物材料领域,具体涉及一种负载药物的金属有机框架(metal-organic frameworks,mof)纳米粒子及其制备方法和应用。
背景技术:
1、在21世纪飞速发展的今天,癌症已然成为全球最致命的疾病之一,严重威胁人类的生命健康。现目前,手术疗法、放射疗法、化学疗法以及高强度聚焦超声疗法已在临床中被广泛使用,在抑制肿瘤增殖和延长患者生命方面已经取得了巨大成功。然而,由于肿瘤的多样性、复杂性和异质性,目前的临床治疗手段和方法非常有限,只能取得部分成功,因此,在癌症治疗的道路上,仍需继续开发有效治疗癌症的新策略。
2、虽然肿瘤微环境中的h2o2水平相对高于正常细胞,但其仍不足以支持产生足够的活性氧(reactive oxygen species,ros)诱导肿瘤细胞凋亡;且产生的ros被肿瘤细胞内gsh清除而使治疗效果大打折扣,因此,肿瘤微环境中低水平的h2o2和过表达的gsh仍是芬顿反应的最大限制。研究表明,金属过氧化物如过氧化钙(cao2)、过氧化镁、过氧化锌、过氧化钡等能在肿瘤微环境中不受外界刺激自行提供h2o2而广泛应用于肿瘤治疗。其中,cao2与水反应后快速释放大量的游离ca2+和h2o2,并通过钙超载诱导肿瘤细胞钙化和增强氧化应激促进肿瘤细胞死亡成为倍受青睐的h2o2供体。同时,常用化疗药物阿霉素(doxorubicin,dox)也被证实可以通过激活烟酰胺腺嘌呤二核苷酸磷酸氧化酶而上调细胞内h2o2水平。这二者不仅自身拥有杀伤肿瘤细胞的能力,还是加强化学动力疗法(chemodynamic therapy,cdt)治疗效果的理想佐剂。
3、然而,由于人体的代谢,如若直接使用化疗药物,极有可能在药物还未到达病灶之前,就直接导致药物被代谢出人体,药物利用率极低,从而影响其治疗效果。想要实现良好的药效,必然会加大药物剂量进行使用,但是会引起副作用的产生,不利于人体健康。因此,在现有技术中,通常会借助载体材料对药物进行包载,进行有效的控制释放,实现最佳治疗效果。
4、近年来,一部分现有技术采用脂质体、聚合物纳米粒子、蛋白质纳米颗粒、聚合物微球等作为载体,直接对药物进行包载后使用,虽然一定程度上能够提高药物的靶向性和利用率,然而,仍然存在载药率低、药物易泄露、潜在的毒性和生物相容性等问题。为防止包载的药物在人体运输中从载体泄露出来,一些现有技术会选择聚乙烯醇、磷脂、蛋白质、聚合物、透明质酸等对载体进行修饰、包覆,可以一定程度上降低药物泄露的概率。然而,药物在到达病灶之前,由于包覆的不稳定性,选用的包覆药物会在运输过程中脱落或裂解,导致药物提前进行释放,不能达到良好的药效。此外,由于人体的体液一直处于流动状态,进行包覆后的药物在达到病灶时,停留时间过短导致药物释药率低。基于此,急需设计一种新型纳米粒以解决包覆不稳定、药物释药率低的问题,实现肿瘤治疗效果最大化。
技术实现思路
1、本发明所要解决的技术问题在于提供一种负载药物的mof纳米粒子,以解决包覆不稳定、药物释药率低的问题,进一步提升过氧化钙和阿霉素的药效。
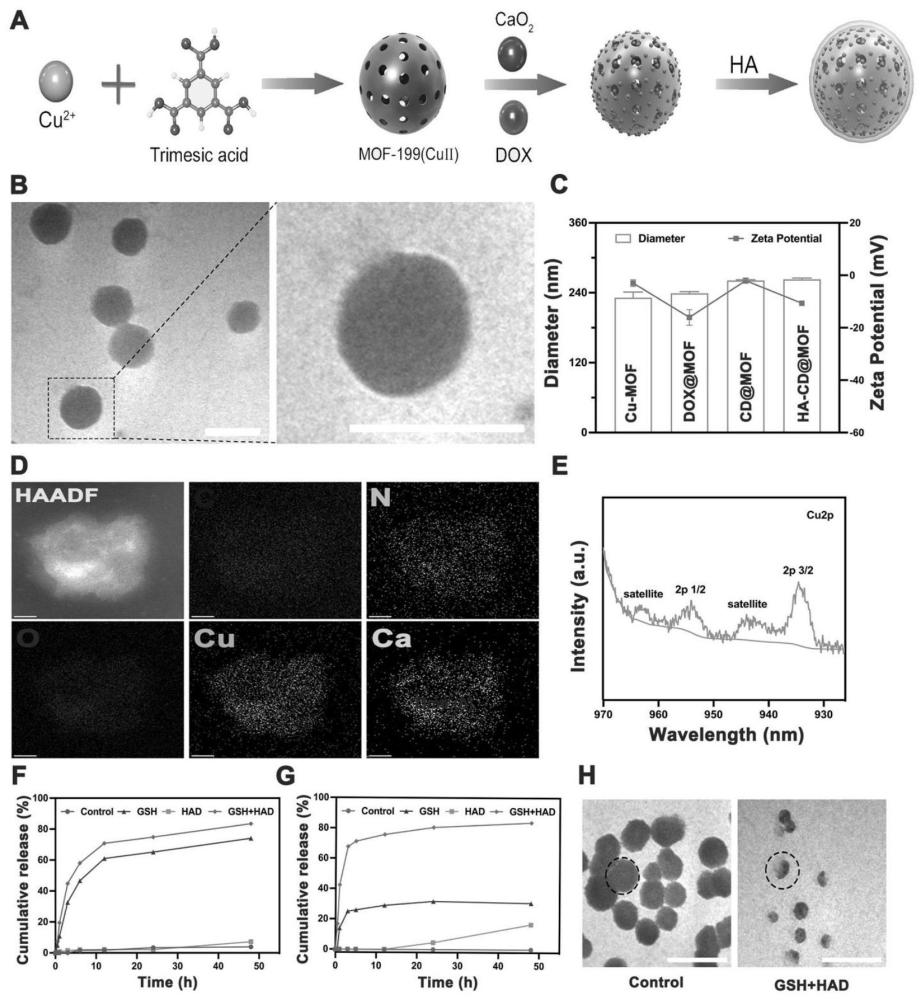
2、本发明提供的基础方案为:一种负载药物的mof纳米粒子,所述纳米粒子包括透明质酸和mof载体,所述透明质酸包覆于mof载体外层表面,mof载体上负载有阿霉素和过氧化钙。本发明最终制备出的产品为ha-cd@mof,其中ha是透明质酸的英文缩写,透明质酸的英文全称是hyaluronic acid,cd分别指代的是cao2和dox。
3、本发明的工作原理在于:
4、受肿瘤微环境中h2o2和谷胱甘肽(glutathione,gsh)敏感响应,可以放大cdt,由于透明质酸与肿瘤细胞表面的cd44蛋白的特异性识别,ha-cd@mof可以在肿瘤部位大量积聚。随后,大量的ca2+、cu2+和h2o2在gsh和透明质酸酶(hyaluronidase,had)过度表达的肿瘤微环境中迅速释放。cu2+可通过fenton-like反应催化自供h2o2,产生大量的
5、•oh,同时通过氧化还原反应消耗过表达的gsh,进一步提高ros的治疗效率。同时,cu2+的过量积聚还可以通过干扰三羧酸(tricarboxylic acid,tca)循环而诱导细胞铜死亡。此外,cu2+还可以使ha-cd@mof具有光声成像(photoacoustic imaging,pai)和t1加权磁共振成像(t1- weighted magnetic resonance imaging,mri)能力,进一步实现对治疗过程的实时评估。由cao2释放的ca2+会造成钙超载,导致线粒体损伤,引起肿瘤钙化,从而进一步增强肿瘤细胞的氧化应激并加速肿瘤的死亡。同时,阿霉素协同氧化应激加强的ca2+超载可以有效地激起icd相关的免疫反应,抑制肿瘤的转移。
6、本发明的优点在于:
7、现目前,为了提升过氧化钙和阿霉素的生物利用度和药效,常规选择均是选择脂质体、聚合物纳米粒子、蛋白质纳米颗粒、聚合物微球作为载体对药物进行负载,但仍然存在药物泄露的问题。为进一步提升载药量,另外一部分现有技术会选择其他药物对载体进行包覆,虽然一定程度上可以提升载药量,但对于包覆不稳定、药物释药率低的问题,仍然是一个巨大的挑战。为解决前面所述的难题,本技术的发明人经历了漫长的探索,通过对载体和包覆物的不断选择和调整,以及对大量的实验数据进行结果分析,在不断地摸索中,最终制备出了效果极好的ha-cd@mof纳米粒子。
8、在ha-cd@mof纳米粒子中,由于阿霉素属于脂溶性药物且cao2极易与水反应,一般会选择无水乙醇等溶液溶解上述两种药物。同时,为了避免包覆物质不能溶解于无水乙醇等溶液,因此,现有技术的常规选择一般会选择脂溶性物质对药物进行包覆。然而,本技术的发明人却打破了常规思路,选择透明质酸这种水溶性物质对药物进行包覆。透明质酸在有机溶剂中容易析出沉淀,为了保障药物的有效反应,发明人通过漫长的探索和分析,发现同时采用水与无水乙醇这两种溶剂进行溶解,并调控水与无水乙醇的体积用量比例,就能保证上述几种药物的溶解性稳定性以及搅拌过后的有效装载包覆性。
9、同时,本技术的透明质酸粘附性更强,大幅度改善了透明质酸对于载体包覆不稳定的问题,透明质酸不易脱落,可以进一步增加过氧化钙和阿霉素的稳定性,降低药物在未达到病灶之前进行提前释放的风险,能够更加有效地保护药物免受生物环境的影响,进一步提升过氧化钙和阿霉素的药效。同时,透明质酸的结构使其在肿瘤细胞周围形成“透明质酸壳”,透明质酸的包覆更稳定,可以增加药物在肿瘤细胞内部的积累,进一步提高药物的靶向性。
10、此外,人体体液一直处于流动状态,进行包覆后的药物在达到肿瘤部位时,停留时间过短导致药物释药率低。本发明的ha-cd@mof纳米粒子,可以进一步增加ha-cd@mof在肿瘤部位的积聚,大幅度延长ha-cd@mof在肿瘤部位的停留时间,可以为过氧化钙和阿霉素的释放提供更加充足的释放时间,最大限度使药物进行释放,提升药物释药率,从而提高药物使用率。同时,现有技术想要达到相同的药效,但由于其释药率低,因此会加大药物剂量进行使用,然而,大部分药物会被人体代谢,人体会产生各类副作用,并且增加对正常细胞的损害。与现有技术相比,本发明由于ha-cd@mof释药率高,能够使用更低剂量的药物达到相同的药效,能够最大限度降低药物对正常细胞的损害,从而减少对人体的伤害。
11、另外,本发明ha-cd@mof纳米粒子中的过氧化钙和阿霉素不仅可以作为芬顿反应的h2o2供体,其本身也具有杀伤肿瘤细胞的效应而进一步增强纳米粒的治疗效果。同时,cu2+和ca2+同时发挥治疗及成像作用,这种协同作用的金属离子干扰疗法对肿瘤能够达到良好的抑制。
12、本发明还提供了负载药物的mof纳米粒子的制备方法,包括cu-mof的制备和ha-cd@mof的制备,其中ha-cd@mof的制备包括下述步骤:
13、(1)将cu-mof和阿霉素进行溶解,再进行搅拌,然后再将cao2添加到溶液中,进行搅拌;
14、(2)将透明质酸进行溶解,然后将其混合液加入到上述步骤(1)的混合液中,于室温下继续进行搅拌,通过离心收集产物,再进行洗涤,最后制得产物ha-cd@mof,将产物收集进行储存。
15、进一步,所述ha-cd@mof的制备步骤(1)中的第一次搅拌时长为16-24 h。
16、进一步,所述ha-cd@mof的制备步骤(2)中的搅拌时长为24-28 h。
17、本方案中,发明人通过对搅拌时间的控制和调整,最终验证了搅拌时长为24-28h,透明质酸的粘附性极强,能够更进一步地改善透明质酸对于载体包覆不稳定的问题,降低药物泄露的概率。
18、进一步,所述ha-cd@mof的制备步骤(1)中cu-mof的添加量为2-3 mg。
19、进一步,所述ha-cd@mof的制备步骤(1)中过氧化钙的添加量为2-2.5 mg。
20、进一步,所述ha-cd@mof的制备步骤(1)中阿霉素的添加量为2-2.5 mg。
21、进一步,所述ha-cd@mof的制备步骤(1)中用于溶解阿霉素和cao2的溶剂为无水乙醇;步骤(2)中用于溶解透明质酸的溶剂为水。
22、本发明所述的任一一种负载药物的mof纳米粒子作为制备治疗肿瘤药物的应用。
23、进一步,所述肿瘤为乳腺癌。
- 还没有人留言评论。精彩留言会获得点赞!