多重相互作用调节的超分子纳米放大器的构建及其应用
本发明属于生物制药,具体涉及多重相互作用调节的超分子纳米放大器的构建及其应用。
背景技术:
1、结直肠癌(colorectal cancer,crc)已成为世界范围第三大恶性肿瘤,发病率仅次于肺癌和女性乳腺癌,在2020年已成为导致癌症相关死亡的第二大原因,在我国也呈逐年上升的趋势。
2、目前,临床治疗结直肠癌的方法以肿瘤的完全切除为主。然而,晚期结直肠癌患者在术后易发生复发和转移,这导致晚期结直肠癌患者的5年生存率小于10%。因此,传统的放疗和化疗依然是晚期结直肠癌的主要治疗方法,即便目前的靶向治疗,免疫治疗由于其抗肿瘤作用机制,这些治疗方法依然会给患者带来不可耐受的副作用。光动力疗法(photodynamic therapy,pdt)因其微创、可控、高效、不良反应低等优势而广受关注。pdt是利用光敏剂激发产生的单线态氧和自由基等活性氧(ros)毒性物质,产生细胞毒性,从而导致肿瘤细胞受损乃至死亡的一种治疗方法。尽管pdt具有许多优势,但它尚未广泛应用在临床医疗保健中,主要原因是光敏剂分子具有靶向性差、溶解度低、疏水性高等多种内在特性,导致实际发挥肿瘤治疗作用的光敏剂数量严重不足。
3、化学动力治疗、声动力治疗、放射治疗和pdt是通过促进癌细胞内产生有毒的ros引起细胞氧化应激的有效抗癌策略。不幸的是,引起氧化应激的ros水平被上调的抗氧化系统抵消了。为了防止过度氧化应激引起的损伤,肿瘤细胞适时调节各种抗氧化剂来控制ros的产生,从而限制ros的积累,对ros治疗产生抗性。ros和抗氧化剂水平之间的微妙平衡对于维持肿瘤细胞内氧化还原稳态至关重要。细胞内抗氧化剂分为酶促性和非酶促性两类。酶抗氧化剂包括过氧化氢酶、超氧化物歧化酶和过氧化物酶家族成员,而非酶抗氧化剂主要是还原性谷胱甘肽(gsh)、生育酚和抗坏血酸。还原性gsh被认为是细胞中最丰富的抗氧化剂,也是清除ros不可或缺的物质。因此谷胱甘肽消耗可以避免ros的清除,导致ros积累增加。导致肿瘤内氧化还原稳态的改变使肿瘤生长更容易受到氧化应激的影响,提高了基于ros的肿瘤治疗的疗效。因此,需要制定一种有效的策略,以便在肿瘤的特定部位或靶向区域递送光敏剂分子,实现谷胱甘肽的消耗。
技术实现思路
1、鉴于现有技术存在的缺陷,本发明提供了一种多重相互作用调节的超分子纳米放大器,以打破肿瘤内氧化还原稳态,从而增强pdt介导的抗肿瘤疗效。tapp与具有吞噬gsh能力的mno2联合使用,协同增加肿瘤细胞ros的产生,打破细胞内氧化还原稳态,使肿瘤生长更容易受到氧化应激的影响,从而提高结肠癌细胞的治疗效果。
2、为实现上述发明目的,本发明采用的技术方案如下。
3、本发明提供了一种多重相互作用调节的超分子纳米放大器,其特征在于,所述超分子纳米放大器为pαla@tapp-mno2。
4、进一步地,由以下方法制备:
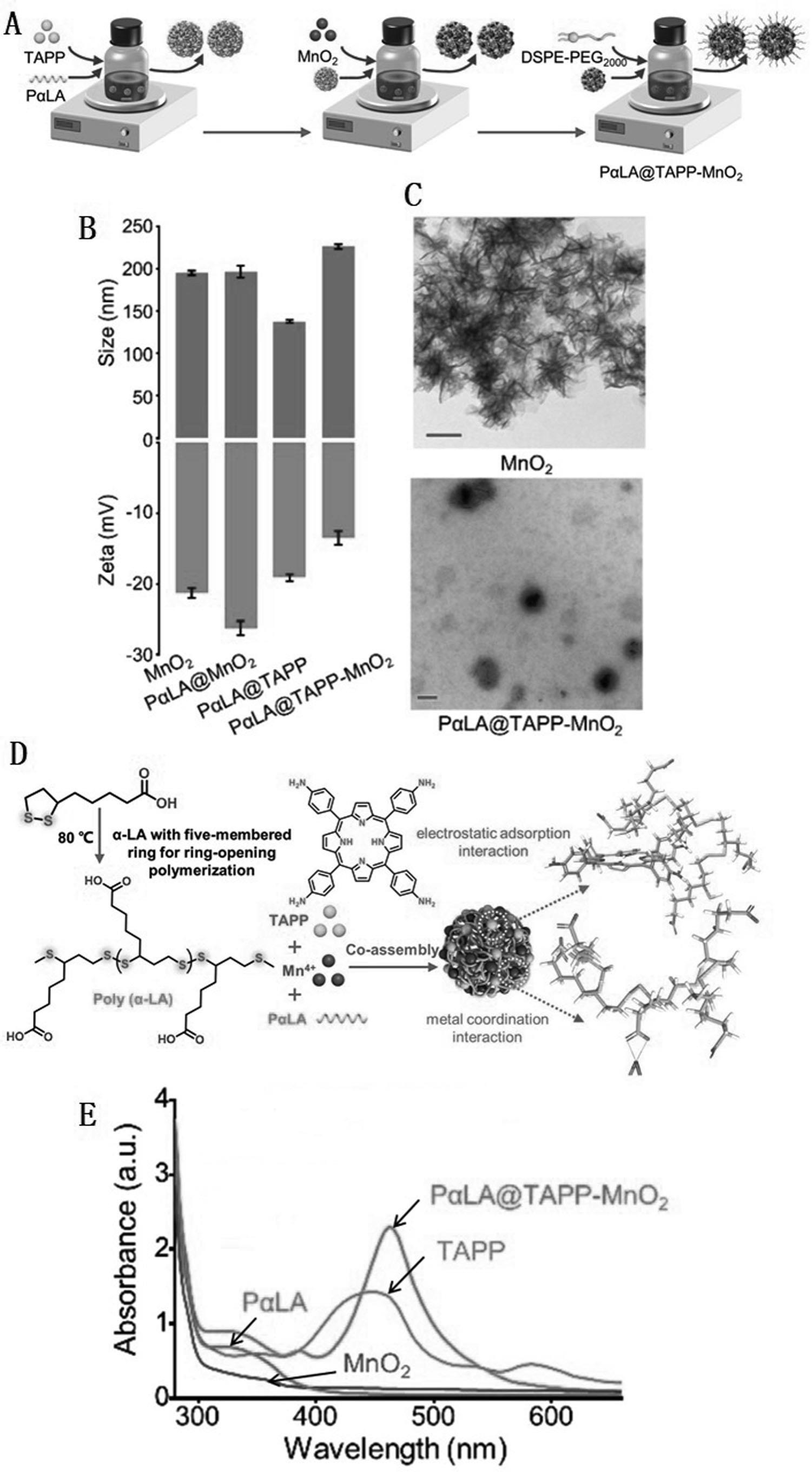
5、将5,10,15,20-四(4-氨基苯基)卟啉光敏剂(tapp)和二氧化锰纳米酶(mno2)包封在含二硫键的聚α硫辛酸(pαla)中,构建得到超分子纳米放大器pαla@tapp-mno2。
6、进一步地,具体包括以下步骤:
7、s1、聚α硫辛酸(pαla)的制备:将αla添加至干燥烧瓶中,在氮气气流保护下并在80℃搅拌2h;随后将得到的pαla溶解于n,n-二甲基甲酰胺(dmf)中,得到pαla溶液;
8、s2、mno2纳米酶的制备:将高锰酸钾加入水中,搅拌30min得到溶液;然后向溶液中加入油酸形成稳定的乳液;乳液在室温下进一步搅拌,最后出现了棕黑块,即合成了mno2纳米酶;将所得mno2纳米酶用酒精离心洗涤三次,去除剩余的反应物,后通过真空冷冻干燥得到了干燥的mno2纳米酶;
9、s3、tapp溶液制备:将tapp,加入dmf,超声溶解,制得tapp溶液;
10、s4、超分子纳米放大器的制备:
11、(1)称取s2中制得的mno2纳米酶,用超声破碎法使mno2充分分散至dmf中,制得mno2混悬液;
12、(2)取s1制备的pαla溶液和s3制得的tapp溶液混合加入至干燥西林瓶中,在黑暗环境下室温磁力搅拌2h混悬液a;随后向混悬液a中加入(1)制备的mno2混悬液,继续室温搅拌2h制得混悬液b;将dspe-peg 2000(20 wt %)加入混悬液b中继续搅拌5min,得混悬液c;
13、(3)取(2)制得的混合液c至另一干燥西林瓶在磁力搅拌下缓慢滴入去离子水中,室温下搅拌5min;利用超速离心法去除dmf,制得超分子纳米放大器(pαla@tapp-mno2)。
14、进一步地,上述任一项所述的多重相互作用调节的超分子纳米放大器在制备肿瘤靶向递药系统中的应用。
15、进一步地,上述任一项所述的多重相互作用调节的超分子纳米放大器在制备抗肿瘤纳米药物中的应用。
16、进一步地,上述任一项所述的多重相互作用调节的超分子纳米放大器在制备响应肿瘤细胞内高gsh环境的药物载体中的应用。
17、本发明还提供了一种光动力疗法抗肿瘤纳米药物,其特征在于,所述药物为权利要求1所述的pαla@tapp-mno2。
18、进一步地,所述肿瘤的光动力治疗的激光波长为660nm。
19、进一步地,所述肿瘤为肠癌。
20、本发明相对现有技术,具有如下的优点及有益效果。
21、(1)本发明以简单的制备工艺,采用“一步纳米沉淀法”使带正电氨基的tapp对聚合物侧链上带负电的羧基进行静电相互作用修饰,同时使用二氧化锰纳米酶(mno2)与羧基进行金属配位,制备了超分子纳米放大器pαla@tapp-mno2,简单易实现。
22、(2)pαla@tapp-mno2在模拟生理条件(10% fbs+ph7.4的pbs缓冲液)的具有较好的稳定性和在模拟肿瘤高gsh环境(10% fbs+ph7.4+10mm dtt的pbs缓冲液)表现出对高gsh良好的响应性,在还原条件下被有效裂解。
23、(3)pαla@tapp-mno2能够被细胞有效的摄取,是其发挥抗肿瘤效益的前提。tapp和mno2共同组装成纳米放大器具有更强的体外协同抗肿瘤能力,主要体现在:pαla@tapp-mno2通过类fenton反应和光动力诱导细胞产生更多的ros;具有更强的细胞毒性;诱导更多的细胞死亡;能够显著的诱导细胞凋亡。pαla载体对细胞无毒性作用,具有良好的生物相容性。
24、(4)与dir溶液剂相比,pαla@tapp-mno2在肿瘤部位的蓄积和滞留有着明显的增强。且在给药后12h在肿瘤内蓄积最强。这些结果保证了制备的纳米放大器在体内的治疗效果。
25、(5)纳米放大器pαla@tapp-mno2在皮下瘤药效中具有最高效的协同抗肿瘤效果。pαla@tapp-mno2不会引起全身的毒副作用,符合理想的抗肿瘤药物的标准,即高效低毒。
- 还没有人留言评论。精彩留言会获得点赞!