一种蛋白药物递送载体及应用的制作方法
本发明属于生物医药,涉及蛋白药物递送载体,尤其涉及一种基于苦瓜的i型核糖体失活蛋白以及内吞体逃逸助剂促进下能高效递送抗肿瘤蛋白药物入胞发挥活性的蛋白药物递送载体及应用。
背景技术:
1、抗肿瘤蛋白药物,除了部分具有靶向细胞膜表面受体功能的一些生物分子以外,许多抗肿瘤药物的靶点在细胞的胞质内或在细胞核内,本身却并不具有跨膜进入细胞的能力。比如来自鸡贫血病毒的凋亡蛋白apoptin,被认为能够诱导70多种人类肿瘤细胞发生凋亡,且不会诱导人肝细胞、造血干细胞等正常细胞发生凋亡。apoptin在正常细胞内存在于胞质中;在肿瘤细胞中则会被cdk2磷酸化进而发生核转位,在细胞核内形成多聚体与dna结合并与几个核靶点发生作用,使肿瘤细胞停滞在g2/m期或诱导肿瘤细胞发生凋亡。这样的蛋白在被开发成为抗肿瘤蛋白药物时,面临着无法被内吞进入胞内的问题,使其无法发挥自身抗肿瘤的功能。同时,即使一些抗肿瘤蛋白药物具有一定被内吞进入细胞的能力,也往往是借由内吞体的转运途径被转运入细胞内的,最终的结果并不一定能高效在细胞内发挥抗肿瘤效果。内吞体会充当细胞内转运的分选中心,一部分蛋白药物经过转胞吞作用被重新运出细胞,一部分会被内吞体转运到溶酶体降解,使得蛋白药物无法在胞内发挥预期的功效。只有药物蛋白在一些协助下实现内吞体逃逸,从内吞体囊泡内被释放进入胞质才可能进一步靶向到达其他亚细胞结构,发挥其药理活性作用。
2、这样的大分子抗肿瘤蛋白药物由于自身并没有跨过细胞膜进入细胞的能力或被内吞后无法逃脱被内吞体运往溶酶体降解的命运,常常无法到达细胞中发挥自身功效的位置,有效发挥出抗肿瘤的效果。为了解决这个问题,许多递送抗肿瘤蛋白药物进入细胞的方法被开发出来。比如shih-heng tseng等人通过高碘酸氧化法将抗表皮生长因子受体(egfr)的单抗西妥昔与葡聚糖包被的超顺磁性氧化铁纳米粒(spions)偶联,制备了cet-peg-dexspions纳米颗粒,可以抑制a431细胞表皮生长因子诱导的egfr磷酸化、促进egfr的内化和降解,并使表达egfr的肿瘤细胞的凋亡率显著增加。除了纳米载体以外,细胞穿膜肽也同样可以运载蛋白药物进入细胞。christoph allolio在2018年的文献中通过对细胞穿膜肽r9的研究中发现,富含精氨酸的细胞穿膜肽能诱导发生膜多层,随后通过形成融合孔进入细胞。也有文献中报道,hiv病毒来源的穿膜肽tat携载大分子货物cre重组酶在诱发细胞表面相互作用后,tat-融合蛋白会通过脂筏依赖的大胞饮迅速内化。
3、核糖体失活蛋白(rip)是一类结构稳定且具有n糖苷酶活性的毒性蛋白。它们主要来源于高等植物,也存在于某些微生物中。这类蛋白能够通过特异性地水解真核核糖体的28s rrna中α-sarcin/ricin环内gaga发夹上保守存在的特定腺嘌呤,使得核糖体翻译过程中所需要的延伸因子无法正常被募集,导致核糖体活性的丧失。rip主要被分为i型和ii型两类,其中苦瓜抗人类免疫缺陷病毒蛋白map30(momordica anti-hiv protein 30 kda)是一种从苦瓜种子中提取出的i型rip。除了切割rrna上特定位点腺嘌呤的n糖苷酶活性外,还被认为具有抗菌、抗真菌、抗病毒、抗肿瘤等多种活性。文献报导map30可以对包括人胶质瘤细胞u87和u251、人膀胱癌细胞t24、人肺癌细胞a549、人肝癌细胞hepg2等的多种肿瘤细胞产生毒性效应。bin liu等人通过zdock软件分子对接分析发现,与i型核糖体失活蛋白α-mmc类似,天然的map30可以通过与细胞表面的多功能细胞表面跨膜蛋白lrp1(low-densitylipoprotein receptor related protein 1)受体结合从而实现内吞。分子对接的结果表明,lrp1配体结合结构域ii上的cr56亚基以及配体结合结构域iii上的cr17亚基是map30的主要的结合位点。空间结构分析显示map30主要通过第58-102位上的氨基酸残基e58、r77、d78、k84、n92、r99和t102,与lrp1受体上的配体结合结构域ii上的cr56亚基以及配体结合结构域iii上的cr17亚基通过形成氢键发生相互作用。
4、map30能够在一些同样是植物来源的三萜皂苷的协同作用下,通过在递送过程中协助map30从内吞体逃逸到胞质中,实现map30蛋白高效在一些肿瘤细胞内发挥生物学活性。如quillaja bark saponin被证明能够抑制内吞蛋白与溶酶体的共定位;raddeanin a(ra, an oleanane-type triterpenoid saponin)不仅可以通过促进内吞体逃逸,还能改变map30的内吞途径,增强map30的抗肿瘤活性;platycodin d(桔梗素d)除了能促进蛋白药物的内吞体逃逸外,还通过akt和mapk信号通路与核糖体失活蛋白协同诱导肝癌细胞凋亡。
5、通过与其他rip的同源性分析表明,map30作为i型核糖体失活蛋白所具有的对核糖体rna的n-糖苷酶活性位点主要与y70、y109、e158和r161这几个氨基酸残基有关。它们处于一个在溶液中具有明确形状,且能容纳螺旋外腺嘌呤碱基的深袋中。除了对核糖体rna的n-糖苷酶活性外,map30还被认为能够切割并且不可逆地使超螺旋dna解旋。有研究分析发现map30中r120-e158-r161的排列与t4核酸内切酶v(一种dgal,dna糖化酶/嘌呤裂解酶)中活性位点三联体r22-e23-r26的排列相似。有文献认为抗癌的特性可能也与其作为dna糖基酶和/或dna脱嘌呤活性相关。
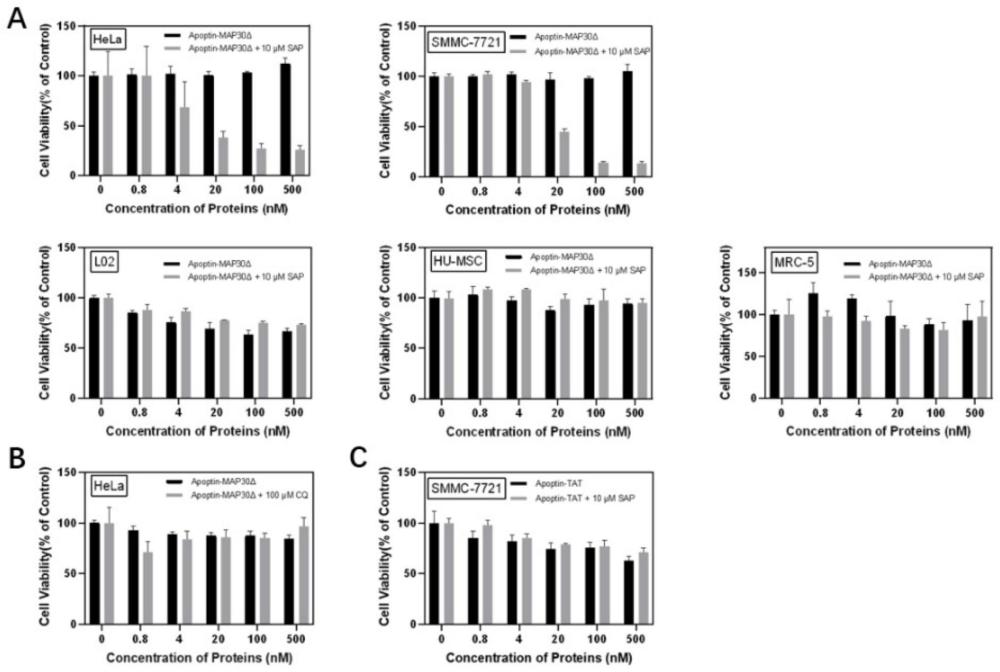
6、为了利用map30和皂素之间的高效协同性,本发明将map30相关酶活位点进行了一系列突变失活,将其本身原有酶活性彻底失活,转化成为一种新型蛋白药物的递送载体,通过与三萜皂苷quillaja bark saponin(sap)的协同作用,能够高效促进被递送的蛋白药物进入胞内并从内吞体释放,使药物蛋白发挥其药理作用。在本发明中,成功利用这种新抗肿瘤蛋白药物载体与内吞体逃逸助剂sap联用之高效入胞递送与内吞体逃逸效果,将apoptin高效递送进入肿瘤细胞,发挥其自身选择性诱导肿瘤细胞凋亡的抗肿瘤活性。
技术实现思路
1、为了解决现有技术的不足,本发明提供了一种蛋白药物递送载体及应用,本发明的蛋白药物递送载体通过与三萜皂苷quillaja bark saponin(sap)的协同作用,能够促进蛋白药物在胞内从内吞体释放,并且本发明中成功利用这种新抗肿瘤蛋白药物载体与内吞体逃逸助剂sap联用的高效入胞递送与内吞体逃逸效果,将apoptin高效递送进入肿瘤细胞,并发挥其自身选择性诱导肿瘤细胞凋亡的抗肿瘤活性。
2、为了实现上述目的,本发明采用以下技术方案:
3、本发明先提供了一种蛋白药物递送载体,所述蛋白药物递送载体包括苦瓜抗人类免疫缺陷病毒蛋白,所述苦瓜抗人类免疫缺陷病毒蛋白的n端结构域中的酶活位点进行单点突变失活改造或双突变失活改造。
4、作为本发明的一种优选方案,所述酶活位点包括y70、y109、e158和r161。
5、作为本发明的一种优选方案,所述酶活位点为y70和/或y109。
6、作为本发明的一种优选方案,所述蛋白药物递送载体还包括内吞体逃逸助剂。
7、作为本发明的一种优选方案,所述内吞体逃逸助剂为齐墩烷型三萜皂苷。
8、作为本发明的一种优选方案,所述齐墩烷型三萜皂苷包括quillaja barksaponin、raddeanin a或platycodin d。
9、本发明中,实现协同作用所用的齐墩烷型三萜皂苷包括但不仅限于quillajabark saponin,其它诸如raddeanin a,platycodin d都有与sap类似的功效,sap只是其中的一个示例。
10、作为本发明的一种优选方案,所述蛋白药物递送载体为经过酶活位点y70和y109双突变失活改造的苦瓜抗人类免疫缺陷病毒蛋白与三萜皂苷的联用体系。
11、本发明还提供了一种药物递送系统,包含上述的蛋白药物递送载体与抗肿瘤药物。
12、本发明最后提供了上述的蛋白药物递送载体在制备药物递送系统中的应用。
13、与现有技术相比,本发明具有以下有益效果:
14、1)本发明提供的蛋白药物递送载体通过与三萜皂苷quillaja bark saponin(sap)的协同作用,能够促进被递送蛋白药物在胞内从内吞体释放。
15、2)本发明中成功利用这种新抗肿瘤蛋白药物载体与内吞体逃逸助剂sap联用的高效入胞递送与内吞体逃逸效果,将apoptin高效递送进入肿瘤细胞,并发挥其自身选择性诱导肿瘤细胞凋亡的抗肿瘤活性。
16、3)本发明的蛋白药物递送载体递送效率被证明远高于传统穿膜肽tat;并且内吞逃逸助剂sap对map30δ的高效协同促进作用被证明不能被同为内吞逃逸助剂的溶酶体胺氯喹(cq)替代。
- 还没有人留言评论。精彩留言会获得点赞!