基于牛奶细胞外囊泡的靶向肿瘤载体及其制备方法、应用与流程
本发明属于靶向肿瘤的药用载体,具体涉及一种基于牛奶细胞外囊泡的靶向肿瘤载体及其制备方法、应用。
背景技术:
1、乳腺癌(breast cancer)是一种常见的恶性肿瘤,严重危害女性健康。乳腺癌的治疗方法与其他肿瘤的治疗方法类似,有手术治疗、放射疗法和化学药物治疗。目前,这些方法仍然存在很大的局限性和不良反应,因此有必要寻找一种新的有效的治疗方法,以提高肿瘤治疗的安全性以及治疗效果。
2、crispr/cas系统目前已被发现存在六种不同类型,其中ⅱ类是现阶段研究最多的crispr/cas9系统。crispr/cas9作为新型的基因编辑技术,是一种来源于细菌和古细菌的天然抗病毒免疫系统,能够将传染性入侵病毒及外源dna作为目标,利用rna介导的核酸酶对遗传物质进行切割。与传统基因编辑技术如talens或zfns技术相比,crispr/cas9系统具有操作简单、脱靶效率低、基因编辑效率高的优点。并且,crispr/cas9直接作用于dna,对基因的编辑干扰作用是永久的,这也使得crispr/cas9在肿瘤的基因治疗领域具有很大的优势,成为癌症诊断和治疗的潜在方法。
3、多项现有研究证实,mir-3064在胰腺癌细胞中过表达,利用crispr/cas9技术敲除mir-3064后,可以减弱胰腺癌细胞的增殖和侵袭能力,对胰腺癌具有显著的抑制作用。使用crispr/cas9系统靶向切割雄激素阳性前列腺癌细胞中的ar基因,能够抑制雄激素敏感型前列腺癌体外生长。使用crispr/cas9系统敲除结肠癌细胞中cd33基因后,癌症干细胞的特性被降低,能够有效的治疗cd33+的结肠癌。针对抑癌基因的失活,通过使用crispr/cas9系统可以来修复失活的肿瘤抑制基因,从而发挥肿瘤治疗作用。使用crispr系统激活pten表达,提高了黑色素瘤和tnbc细胞系中pten的表达水平,明显抑制了下游致癌途径。除此以外,还有针对其他肿瘤相关基因以及相关肿瘤免疫的研究,使用crispr/cas9技术靶向插入递送到特定位置的car基因来构建更有效的car-t细胞,显著增强了其安全性和准确性,增加了t细胞的有效性。使用crispr/cas9敲除hpv细胞中的e6和e7基因,恢复肿瘤抑制因子p53和视网膜母细胞瘤(rb)蛋白水平,促使细胞发生凋亡,达到治疗hpv的作用。可见,crispr/cas9基因编辑技术可以有针对性的对肿瘤相关基因进行敲除、敲入、基因修饰等,以达到治疗肿瘤的目的。针对致癌基因,使用crispr/cas9系统可以抑制和干扰癌基因的活性。因此,crispr/cas9在肿瘤治疗领域展现出广阔的应用前景。
4、然而,crispr/cas9在现阶段的实际应用时,面临的最大问题是如何安全有效的将其递送到肿瘤靶向部位。目前,crispr/cas9的递送载体仍然是以病毒载体为主,但是,病毒载体存在毒性较大、免疫原性高、靶向性差等问题,难以有效应用于临床。
5、因此,选择安全性更高、肿瘤靶向性更强的载体,以使之满足crispr/cas9的靶向肿瘤递送以及乳腺癌的临床治疗和应用需求,是目前亟需解决的问题。
技术实现思路
1、本发明的目的之一在于提供一种基于牛奶细胞外囊泡的靶向肿瘤载体,其稳定性和安全性高,对于乳腺癌细胞有良好的靶向性,能够有效进行基因药物crispr/cas9的装载和递送。
2、本发明的目的之二在于提供一种基于牛奶细胞外囊泡的靶向肿瘤载体的制备方法,采用化学偶联方法制备靶向性囊泡,偶联过程不会对囊泡的形态和结构产生影响,偶联成功率高。
3、本发明的目的之三在于提供一种基于牛奶细胞外囊泡的靶向肿瘤载体的应用。
4、本发明的目的之一采用如下技术方案实现:
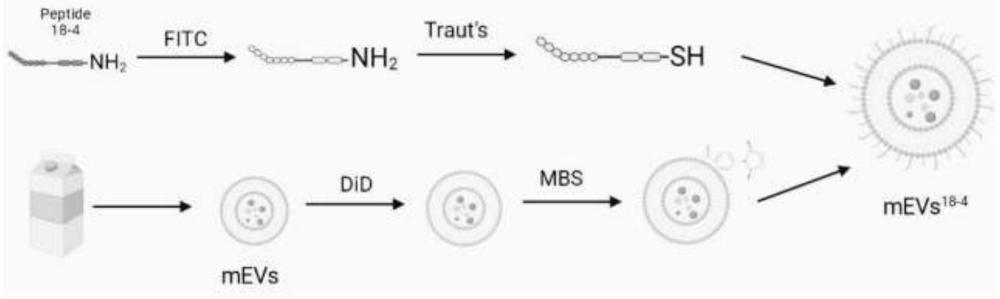
5、一种基于牛奶细胞外囊泡的靶向肿瘤载体,包括牛奶细胞外囊泡以及在所述牛奶细胞外囊泡表面化学偶联连接的多肽18-4。
6、本发明提供的牛奶细胞外囊泡的靶向肿瘤载体,采用牛奶细胞外囊泡(mevs)作为载体,在其表面偶联靶向多肽18-4。其中,mevs载体来源于牛奶,牛奶来源广泛,且价格低廉,可以大批量生产,且mevs与其他种类的细胞囊泡一样,易穿透生物膜、免疫原性低、生物相容性良好、能够携带生物活性物质传递信息,具有良好的生物安全性,因此牛奶细胞外囊泡有望成为一种新型的药物递送系统。然而,实际应用时发现,mevs虽然具有良好的生物相容性以及一定的载药能力,但是其靶向性较差,且靶向给药的效果较低。
7、多肽18-4是基于p160肽作为先导肽设计开发的一种新型多肽,具体结构如下所示。现有研究证实多肽18-4能够靶向乳腺癌中高表达的角蛋白1(krt1)受体。然而,目前现有技术中尚未有将多肽18-4用于牛奶细胞外囊泡修饰以制备靶向载体的相关报道,也未涉及针对基因药物进行装载并基于牛奶细胞外囊泡载体的载药体系的相关研究。
8、
9、本发明中,首次采用多肽18-4与mevs进行化学偶联,成功实现了mevs的靶向修饰,构建得到了一种能够靶向乳腺癌的载体体系。靶向性试验证实,本发明通过偶联多肽18-4能够有效增加mevs对乳腺癌细胞的靶向性,有利于将药物递送到细胞中发挥作用。并且包封率和稳定性试验证实,化学偶联后的牛奶细胞外囊泡mevs18-4,能够有效实现crispr/cas9质粒的装载,且mevs18-4对crispr/cas9质粒具有保护作用,进入体内后能够有效阻止体内dnaseⅰ酶对质粒的水解,防止药物到达靶点部位前被降解清除,更有利于药物药效的发挥。
10、优选地,所述牛奶细胞外囊泡是以脱脂牛奶为原料,依次经酸处理法和差速离心法提取纯化得到;所述牛奶细胞外囊泡的平均直径为80~110nm,水合粒径为120~130nm。本发明对牛奶进行酸处理,沉淀蛋白后,采用差速离心的方法提取mevs,通过该方法提取得到的mevs体积小,粒径分布均匀,且产率高,杂蛋白含量大大降低,具有更好的生物安全性。
11、本发明的目的之二采用如下技术方案实现:
12、基于牛奶细胞外囊泡的靶向肿瘤载体的制备方法,包括以下步骤:
13、(1)将牛奶细胞外囊泡与3-马来酰亚胺基苯甲酸琥珀酰亚胺酯混合,孵育,得到混合液a;另将多肽18-4与traut’s试剂混合,孵育,得到混合液b;
14、(2)将步骤(1)所得混合液a、混合液b进行共孵育,然后离心,即得基于牛奶细胞外囊泡的靶向肿瘤载体,记为mevs18-4。
15、本发明的基于牛奶细胞外囊泡的靶向肿瘤载体的制备方法,利用traut's试剂在多肽18-4上生成巯基(-sh),并利用交联剂3-马来酰亚胺基苯甲酸琥珀酰亚胺酯(mbs)在mevs表面上生成马来酰亚胺基团,然后将两者进行共孵育,从而使mevs表面的马来酰亚胺基团与多肽18-4上的巯基反应,生成稳定的硫醚键,以成功将多肽18-4连接到mevs,得到结构稳定性良好的靶向肿瘤载体mevs18-4。
16、本发明的上述靶向肿瘤载体的制备方法,相较于其他偶联方式(如将traut's试剂先与mevs反应生产巯基(-sh),并利用交联剂mbs在多肽18-4表面上生成马来酰亚胺基团,再使多肽18-4表面的马来酰亚胺基团与mevs上的巯基反应生成稳定的硫醚键的方法),能够有效避免制备所得靶向载体的聚集现象,提高偶联成功率并改善mevs的靶向乳腺癌的效果。
17、此外,本发明采用上述化学偶联方法制备靶向性囊泡,偶联过程不会对囊泡的形态和结构产生影响,因此不会影响囊泡的功能。并且,偶联后所得载体mevs18-4对于乳腺癌细胞有良好的靶向性,能够有效进行基因药物crispr/cas9的装载和递送。细胞摄取和转染试验均证明,本发明采用上述方法制备得到的靶向载体mevs18-4的摄取率和转染效率最高,表明靶向多肽的偶联显著增加了mevs对乳腺癌的靶向性,有利于将药物递送到细胞中发挥作用。
18、优选地,步骤(1)中,所述3-马来酰亚胺基苯甲酸琥珀酰亚胺酯为浓度为8~12mg/ml的3-马来酰亚胺基苯甲酸琥珀酰亚胺酯溶液,3-马来酰亚胺基苯甲酸琥珀酰亚胺酯的浓度更优选为10mg/ml,溶液中采用的溶剂优选为二甲基亚砜。
19、所述traut’s试剂中2-亚氨基硫烷盐酸盐的浓度为1.5~2.5mg/ml,更优选为2mg/ml。
20、基于提高化学偶联成功率以及偶联效率的考虑,进一步地,步骤(1)中,牛奶细胞外囊泡与3-马来酰亚胺基苯甲酸琥珀酰亚胺酯溶液的质量比为1∶(8~12),两者孵育的时间为20~40min;所述多肽18-4与traut’s试剂的质量比为1∶(8~12),两者孵育的时间为50~80min;步骤(1)中,所述孵育在室温下进行。
21、进一步优选地,步骤(2)中,所述共孵育的时间为20~40min,共孵育在室温下进行;所述离心的转速为100000×g~150000×g,离心时间为1~2h。
22、本发明的目的之三采用如下技术方案实现:
23、本发明的基于牛奶细胞外囊泡的靶向肿瘤载体的应用,具体是在制备装载crispr/cas9质粒的靶向肿瘤药物递送系统中的应用;或者,在制备同时装载crispr/cas9质粒和化疗药物的靶向肿瘤药物递送系统中的应用。
24、crispr/cas9属于基因药物,其能够直接对dna进行永久性编辑,具有脱靶效率低、操作简单、编辑效率高的特点,但是目前由于缺乏合适的递送载体,极大的限制了crispr/cas9在临床上的应用。源自牛奶的细胞外囊泡mevs是一种非常有潜力的载体系统。本发明通过针对性设计,有效构建了一种靶向肿瘤的载体系统mevs18-4,其能够有效实现crispr/cas9质粒的装载,并且还能同时装载化疗药物,从而有效构建得到一种新型的靶向药物递送系统。
25、更进一步地,所述肿瘤为乳腺癌。
26、优选地,所述装载采用电穿孔技术。试验证实,采用电穿孔技术,不仅不会破坏crispr/cas9的结构,并且靶向多肽仍然与囊泡相连,所得载药系统的稳定性更高。
27、本发明的mevs18-4载体能够实现不同种类化疗药物的装载,因此本发明对于可装载的化疗药物不作特别限定,本领域技术人员可以进行常规选择。优选地,所述化疗药物为多烯紫杉醇、阿霉素、甲氨蝶呤、顺铂、长春新碱中的一种或多种。进一步优选地,所述化疗药物为多烯紫杉醇。
28、进一步地,所述crispr/cas9质粒具有基因编辑功能。
29、进一步优选地,所述基因编辑功能为针对目的基因cd24的敲除功能。cd24蛋白是一种由27个氨基酸分子组成的高度糖基化的磷脂酰肌醇锚定的小分子表面蛋白。cd24作为乳腺癌和卵巢癌的主要免疫检查点,cd24在肿瘤中往往高表达,阻断cd24的表达可以抑制肿瘤生长,促进肿瘤免疫治疗,提高巨噬细胞吞噬肿瘤的能力,因此在肿瘤治疗方面具有良好的应用前景。本发明通过设计具有cd24敲除功能的crispr/cas9质粒,作为基因药用于肿瘤治疗后表现出良好的使用效果。
30、细胞试验表明,mevs18-4通过装载crispr/cas9(或同时装载crispr/cas9和化疗药物)构建得到的靶向肿瘤药物递送系统,能够有效的将crispr/cas9递送到肿瘤细胞中从而有效诱导肿瘤细胞凋亡,显著抑制肿瘤细胞的迁移和侵袭,发挥显著的抗肿瘤治疗作用。活体成像结果表明,靶向载体mevs18-4能够浓集于肿瘤部位,具有良好的肿瘤靶向性。且根据小鼠的体重变化、血常规和肝肾功能指标以及组织切片表明mevs18-4装载crispr/cas9所得靶向肿瘤药物递送系统具有良好的生物安全性。
31、综上可知,本发明的靶向肿瘤载体,具有良好的生物安全性,并且能够有效主动靶向肿瘤部位递送crispr/cas9(或同时递送crispr/cas9和化疗药物),实现基因药物治疗肿瘤,降低对人体的毒性和副作用,更好的发挥肿瘤治疗作用。因此,本发明能够为crispr/cas9的递送提供新的研究方向,并为基因药物与化疗药物联合使用以提高疗效、降低药物的毒副作用提供新的思路。
- 还没有人留言评论。精彩留言会获得点赞!