用于诱导体内系统性免疫耐受的多囊泡脂质纳米颗粒耐受性疫苗的制作方法
本发明一般涉及生物分子的可控封装和递送,这些生物分子可表征为小分子药物、核苷酸和生物制剂,至免疫细胞以诱导体内和体外的免疫耐受状态。具体而言,本发明涉及在基因的递送、摄取和刺激响应表达方面所做的改进,用于对免疫细胞的细胞重编程,以治疗和预防自身免疫性疾病、过敏和食物敏感性。
背景技术:
1、脊椎动物已经进化出复杂的免疫系统来保护它们免受病原体、寄生虫和有害环境物质的侵害。在正常情况下,这些免疫系统可以区分这些威胁和它们自身身体的细胞和组织(以及其他无害物质)。免疫系统确定为“自身”的细胞和组织被称为“耐受的”。这种自身耐受性始于生物体早期发育阶段(中枢耐受性),并在整个生命过程中通过多种细胞和分子机制(例如调节性t细胞(treg)的作用)维持(外周耐受性)。当这些机制失效,细胞或组织的组成部分不再被识别为“自身”时,它就会变成自身抗原,从而可以导致自身免疫和自身免疫疾病。同样,外周耐受机制可以训练免疫系统将常见的环境物质(例如室内尘土和花粉)识别为无害,因此免疫系统可以耐受它们。当这个过程失效时,就会导致过敏和食物敏感。在某些情况下,使用“过敏针”等粗糙方法可以恢复对常见过敏原的耐受性,即用少量过敏原反复刺激患者的免疫系统。最近,这种方法已经正式化并取得了成功,例如在努力通过反复喂食少量花生来减少儿童花生过敏的过程中。然而,这种方法对许多过敏原并不可行,没有任何针对性,也不能诱导足够强的致耐受性作用来治疗或预防自身免疫性疾病。要实现这一点,真正的致耐受性疫苗是必不可少的。标准疫苗激活免疫系统的细胞并向其展示应该攻击的病原体的实例,而致耐受性疫苗则使免疫系统的某些细胞进入耐受性状态,并向其给出应该耐受的自身抗原的实例。开发广泛适用的致耐受性疫苗技术来诱导对任何自身抗原或过敏原的全身抗原特异性免疫耐受是这一创新的驱动因素。
2、脂质体和脂质纳米颗粒系统是基于软材料的纳米颗粒,已被用作细胞外环境中的载体,如天然存在的细胞外囊泡(ev)或由磷脂制剂合成配制的囊泡。已知天然存在的外泌体可以包裹和递送微小rna和蛋白质,以向其他细胞发出相对健康或氧化应激的信号。最近的创新利用脂质体载体将细胞毒性药物递送至患病状态的组织和细胞。人们对核苷酸和其他基因编辑工具(如crispr/cas9)的递送的兴趣推动了脂质体系统作为仿生载体的固有潜力,这些载体将被健康和/或患病状态的细胞和组织自然地内吞。对用于最终递送的囊泡包装生物分子的封装和稳定性的至关重要的改进是这一创新的驱动因素。目前的脂质纳米颗粒疫苗在室温下不稳定,严重阻碍了其发展,需要复杂而昂贵的物流链,包括在零下温度下储存。一旦解冻,目前的脂质纳米颗粒疫苗必须冷藏并在几天内使用,否则就会浪费。这项创新的一个关键特征是其极端的稳定性,脂质纳米颗粒在高环境温度下稳定数月,而不是在冰箱中稳定数天。
3、该方面的现有技术是使用细胞和分子方法在体内诱导免疫耐受。从根本上讲,所有这些方法都相似,因为它们都试图在耐受性环境中将蛋白质/肽自身抗原(或编码该自身抗原的核酸)递送至免疫细胞。这些技术的目的是通过耐受性免疫细胞(例如耐受性树突状细胞(toldc))诱导自身抗原的抗原呈递。然后,toldc通过各种机制(例如诱导调节性t细胞(treg))介导对这些自身抗原的外周免疫耐受。已试验的无细胞方法包括将编码自身抗原的核酸直接作为质粒dna疫苗递送至体内,或间接通过病毒载体或纳米颗粒递送至体内。或者,可以将自身抗原本身的蛋白质结构直接递送至体内,可以是整个自身抗原蛋白质或其较小片段(肽疫苗)。这些无细胞方法的优点是制造和管理相对简单,但也存在不足,因为它们不一定能以正确的方式将有效载荷递送到正确的免疫细胞类型以引发治疗性耐受性反应。此外,目前的无细胞方法通常只能递送单一类别的有效载荷(例如,自身抗原蛋白或编码自身抗原蛋白的mrna),是严重的限制,阻碍了同时用几种不同类型的有效载荷设计免疫细胞以优化耐受性免疫反应(例如,在同一纳米颗粒中同时递送编码自身抗原和细胞因子蛋白的mrna)。已经试验过的基于细胞的方法包括体外工程和扩增treg或toldc,然后将它们重新输注到患者体内。这些方法的优点是可以可靠地产生正确的耐受性细胞类型,但每个治疗都是针对特定患者的,而且成本高昂且难以制造。目前,尚无用于在体内将t细胞或树突状细胞改造成具有治疗相关的treg或toldc的物质的组合物或方法用于递送多种有效载荷。
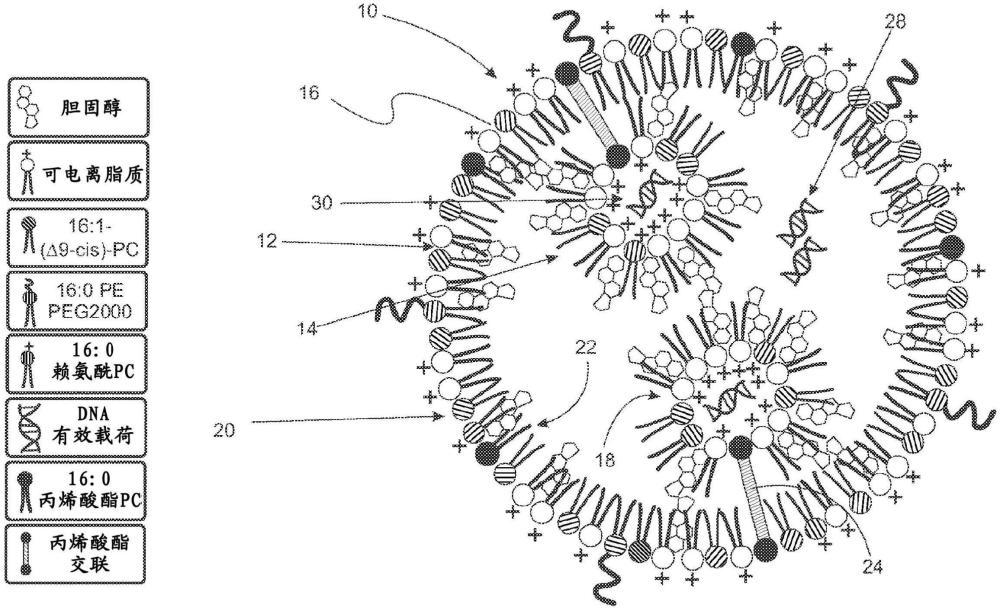
4、在结构上,脂质纳米颗粒载体由多层的磷脂和其他脂质形成。磷脂头部基团定向暴露于水环境,使其成为理想的功能化小分子成分以改善整体细胞摄取。磷脂和其他脂质通过范德华相互作用在双分子层中弱结合。由于脂质结合较弱,脂质纳米颗粒在完全循环之前消散是一个主要缺陷。天然存在的微囊泡(mv)被称为多囊泡脂质体(mvl),是大型(>1μm)单双分子层脂质体,已知可包裹多个较小的囊泡(200nm),形成非同心腔。这些腔体包含生物分子,例如核苷酸、小分子、代谢物和蛋白质。合成配制的mvl已被证明可以封装和递送抗癌药物和其他小分子化疗药物。1,2现有技术的关键在于,生物活性治疗剂的释放由较小囊泡隔室和较大封装囊泡之间的盐浓度差异控制。其他基于软材料的纳米颗粒为聚合物、肽和蛋白质的材料。
技术实现思路
1、在至少一个方面,多囊泡脂质纳米颗粒组合物包括多个多囊泡脂质纳米颗粒。每个多囊泡脂质纳米颗粒包括载体脂质纳米颗粒,该载体脂质纳米颗粒包括载体胶束。载体胶束由选自磷脂、不含磷的脂质及其组合所组成的组的载体脂质组成,载体脂质纳米颗粒的平均直径小于1微米。多囊泡脂质纳米颗粒组合物还包括至少一个子室脂质纳米颗粒,该子室脂质纳米颗粒包括子室反胶束。子室反胶束由选自磷脂、不含磷的脂质及其组合所组成的组的子室脂质组成。特征在于,至少一个子室脂质纳米颗粒的平均直径小于100nm,载体脂质纳米颗粒封装至少一个子室脂质纳米颗粒。
2、在另一方面,提供了一种包括多个多囊泡脂质纳米颗粒的多囊泡脂质纳米颗粒组合物。每个多囊泡脂质纳米颗粒包括载体胶束脂质纳米颗粒,载体胶束脂质纳米颗粒包括载体磷脂层,载体磷脂层包括载体磷脂,且平均直径小于1微米;以及至少一个子室反胶束脂质纳米颗粒,子室反胶束脂质纳米颗粒包括子室磷脂层,子室磷脂层包括子室磷脂,且平均直径等于或小于约100nm。载体脂质纳米颗粒胶束封装至少一个子室反胶束纳米颗粒。对于该创新至关重要的是一些载体胶束磷脂尾部与一些子室反胶束磷脂尾部的物理交联,与缺乏这些稳定交联的类似技术相比,这极大地改善了本发明的稳定性和释放动力学。这种多囊泡脂质纳米颗粒组合物在此称为snipr(子纳米颗粒细胞内有效载荷释放,sub-nanoparticle intracellular payload release)。
3、在另一方面,提供了一种形成上述多囊泡脂质纳米颗粒组合物的方法。该方法包括形成多个脂质纳米颗粒的步骤,其中,多个载体胶束脂质纳米颗粒的平均纳米颗粒直径小于约1微米,多个反胶束子室脂质纳米颗粒的平均直径小于100nm。多个脂质纳米颗粒由脂质纳米颗粒形成的组合物形成,该组合物包括被封装在载体胶束或子室反胶束内的一个或多个有效载荷,取决于有效载荷的物理化学性质。然后,对多个脂质纳米颗粒进行稳定交联过程,该交联过程将载体胶束脂质纳米颗粒中的某些磷脂的尾部基团共价连接到反胶束子室脂质纳米颗粒中的某些磷脂的尾部基团。
4、在另一方面,提供了一种形成包括多个多囊泡脂质的多囊泡脂质组合物的方法。每个多囊泡脂质纳米颗粒包括载体磷脂胶束,载体磷脂胶束包括载体磷脂层,载体磷脂层包括载体磷脂,且平均直径小于1微米,以及至少一个子室磷脂反胶束,子室磷脂反胶束包括子室磷脂层,子室磷脂层包括子室磷脂,且平均直径小于100nm。载体磷脂胶束封装至少一个子室磷脂反胶束。该方法包括以下步骤:
5、a)将溶解载体磷脂、子室磷脂和可选的疏水性治疗/诊断有效载荷的有机溶剂与溶解亲水性治疗/诊断有效载荷的水性溶剂混合;以及
6、b)形成多个子室磷脂反胶束,多个子室磷脂反胶束的平均纳米颗粒直径小于100nm,多个子室磷脂反胶束由包括亲水性治疗/诊断有效载荷的第一mvl形成组合物形成;以及
7、c)形成多个载体磷脂胶束,平均纳米颗粒直径小于1微米,多个载体磷脂胶束由包括多个子室磷脂反胶束的第二mvl形成组合物形成,使得子室磷脂反胶束被载体磷脂胶束封装(应当理解,步骤b和c可以同时发生,尤其是在混合过程中);以及
8、d)通过施加光化辐射催化的化学反应共价连接多个载体磷脂胶束和多个子室磷脂反胶束的磷脂尾部基团。
9、在另一方面,共轭尾部基团共价键将子室磷脂反胶束附着到载体脂质磷脂胶束的内表面上。
10、在另一方面,提供了一种多囊泡脂质纳米颗粒组合物,多囊泡脂质纳米颗粒组合物递送旨在诱导抗原特异性免疫耐受的有效载荷。每个耐受性多囊泡脂质纳米颗粒包括载体胶束脂质纳米颗粒,载体胶束脂质纳米颗粒包括载体磷脂层,载体磷脂层包括载体磷脂和任选的不含磷的其他脂质。载体磷脂层的平均直径小于1微米;以及至少一个子室反胶束脂质纳米颗粒,子室反胶束脂质纳米颗粒包括子室磷脂双分子层,子室磷脂双分子层包括子室磷脂,并且平均直径等于或小于约100nm。载体脂质纳米颗粒胶束封装至少一个子室反胶束纳米颗粒。在一种变体中,子室反胶束纳米颗粒封装有一种或多种设计用于诱导通过摄取脂质纳米颗粒组合物的抗原呈递细胞来呈递自身抗原表位的亲水性有效载荷(例如,核酸、蛋白质或肽)。在另一种变体中,子室反胶束纳米颗粒封装有一种或多种亲水性有效载荷(例如,核酸、蛋白质或肽),该亲水性有效载荷设计用于诱导通过摄取脂质纳米颗粒组合物的抗原呈递细胞来呈递自身抗原表位,并且脂质纳米颗粒组合物还封装有一种或多种有效载荷(例如,核酸、蛋白质、肽或小分子药物),该有效载荷在摄取脂质纳米颗粒组合物的抗原呈递细胞中诱导耐受表型。在这种变体中,诱导耐受表型的亲水性有效载荷被封装在子室反胶束中,而诱导耐受表型的疏水性有效载荷被封装在具有至少一个子室反胶束的载体胶束脂质纳米颗粒内。含有以这种方式设计用于诱导抗原特异性耐受的有效载荷的snipr纳米颗粒在此称为xavinetm纳米颗粒。
- 还没有人留言评论。精彩留言会获得点赞!