包含二苯基二唑衍生物的药物组合物及其使用方法与流程
发明领域本文提供了包含至少一种具有通式(a)或(a*)的化合物的药物组合物及使用其用于治疗神经退行性疾病、特别是α-突触核蛋白病的方法。
背景技术:
0、背景
1、已知大量神经和神经退行性疾病,其中许多目前是无法治愈的。神经退行性疾病包括亨廷顿氏病(hd)、哈勒沃登-斯帕茨氏病(hallervorden-spatz disease)、阿尔茨海默病(ad)、老年性痴呆、克雅病(cjd)、动脉硬化性痴呆、帕金森病(pd)、脑血栓闭塞性脉管炎(伯格氏病)和许多其他疾病。
2、一类神经退行性疾病,即α-突触核蛋白病,通过主要包含α-突触核蛋白的蛋白质聚集体、寡聚物、原纤丝(protofibril)和纤丝的细胞内积聚来表征。α-突触核蛋白病的实例是帕金森病(pd)、路易体痴呆(dlb)和多系统萎缩(msa)。
3、疾病表型取决于病理变化的定位,病理变化可以主要影响自主神经系统、黑质-纹状体系统、脑桥-小脑系统和皮质系统。msa患者表现为自主神经功能障碍合并主导性的帕金森综合征(msa-p)或小脑共济失调(msa-c)(gilman, 2008)。pd患者主要表现为运动功能减退-僵硬表型(berg, 2018),而患有dlb的患者表现为认知障碍和运动障碍的混合(mckeith, 2017)。没有减缓疾病进展的有效疗法(levin, 2016)。抑制α-突触核蛋白聚集是针对α-突触核蛋白病的关键病理生理过程的合理治疗干预(wong, 2017;meissner,2019)。
4、据信,α-突触核蛋白病对神经细胞的病理影响是由α-突触核蛋白(寡聚物)的小聚集体的形成和随后的膜孔形成诱导的。α-突触核蛋白寡聚物已经被显示是最相关的神经毒性物质,并且被国际专利申请号pct/ep2009/004144中公开的化合物所靶向。一种特定的化合物anle138b,一种小分子化合物,在α-突触核蛋白病的动物模型中显示出强烈的疾病改善作用。在那些研究中,anle138b显示出高口服生物利用度和血脑屏障渗透,导致脑中anle138b的水平比血浆中高5倍(wagner, 2013)。在一系列不同的小鼠模型中,anle138b在体内强烈抑制寡聚物积累、神经元变性和疾病进展(wagner, 2013;martinez hernandez,2018;wagner, 2015; brendel, 2019;levin, 2014;heras-garvin, 2019;wegrzynowicz,2019)。
5、anle138b是一种高度亲脂性分子,这可以解释其穿过血脑屏障并进入靶细胞的能力,然而这是制剂开发的挑战。具有低进食/禁食效应的可用于人类施用的口服药物组合物将是有益的。
技术实现思路
0、发明概述
1、本文提供了一种药物组合物,包含:
2、至少一种具有通式(a)或(a*)的化合物
3、,
4、(a) (a*)
5、或其立体异构体、外消旋体、水合物或溶剂化物,
6、其中
7、r选自氢;c1–4烷基;和-c1–4亚烷基-卤素;
8、hal选自f、cl、br和i;并且
9、re7和re8独立地是h或f;
10、和药学上可接受的赋形剂,其中所述赋形剂包含脂肪酸和聚乙二醇的至少一种单酯和/或脂肪酸和聚乙二醇的至少一种二酯,
11、其中
12、脂肪酸独立地选自c8-c22脂肪酸;并且
13、聚乙二醇独立地选自包含约20个至约40个氧化乙烯单元的聚乙二醇。在一些实施方案中,peg包含约32个氧化乙烯单元。在一些实施方案中,脂肪酸独立地选自c8-c18脂肪酸。
14、在特定实施方案中,药物组合物包含化合物,其中r、re7和re8中的每一个是h并且hal是br,所述化合物具有通式(b)、(b*)
15、
16、(b) (b*)
17、或其混合物。
18、赋形剂还可以包含脂肪酸的甘油单酯、脂肪酸的甘油二酯和/或脂肪酸的甘油三酯,其中脂肪酸独立地选自c8-c22脂肪酸。赋形剂还可以包含聚乙二醇(peg),其包含约20个至约40个氧化乙烯单元,并且在具体实施方案中包含约32个氧化乙烯单元。在一些实施方案中,脂肪酸独立地选自c8-c18脂肪酸。
19、在一些实施方案中,赋形剂包含脂肪酸和聚乙二醇的单酯和/或脂肪酸和聚乙二醇的二酯的混合物,其中脂肪酸可以衍生自天然来源,例如包括椰子油和/或氢化椰子油的植物来源。在特定实施方案中,赋形剂包含脂肪酸和聚乙二醇的单酯和/或脂肪酸和聚乙二醇的二酯的混合物,其中脂肪酸包含高达15wt%的辛酸(c8)、高达12wt%的癸酸(c10)、30wt%至50wt%的月桂酸(c12)、5wt%至25wt%的肉豆蔻酸(c14)、4wt%至25wt%的棕榈酸(c16)和5wt%至35wt%的硬脂酸(c18)。
20、在一些实施方案中,赋形剂包含约50wt%至约80wt%、优选地约60wt%至约75wt%、更优选地约72wt%的脂肪酸和聚乙二醇的至少一种单酯和/或脂肪酸和聚乙二醇的至少一种二酯。在一些实施方案中,赋形剂还包含约10wt%至约30wt%、优选地约15wt%至约25wt%、更优选地约20wt%的脂肪酸的甘油单酯、脂肪酸的甘油二酯和/或脂肪酸的甘油三酯。在一些实施方案中,赋形剂还包含约5wt%至约20wt%、优选地约5wt%至约10wt%、更优选地约8wt%的包含约20个至约40个氧化乙烯单元或约32个氧化乙烯单元的聚乙二醇。
21、赋形剂可以具有在约33℃至约64℃、优选地约35℃至约55℃、更优选地约42.5℃至约47.5℃、甚至更优选地约44℃的范围内的熔融范围。在一些实施方案中,赋形剂具有约1至约16、优选地从约7至约14、约11或约14的亲水亲脂平衡(hlb)。
22、获得赋形剂的工艺不受限制。赋形剂可以通过例如聚乙二醇和脂肪酸的甘油三酯之间的醇解反应或通过氢化植物油(例如氢化椰子油)与peg或棕榈仁油与peg(例如peg-32)的聚乙二醇解(polyglycolysis)获得。
23、在一些实施方案中,药物组合物包含基于100wt%的总药物组合物约3wt%至约5wt%的具有通式(a)或(a*)的化合物或其混合物和约95wt%至约97wt%的赋形剂。在特定实施方案中,药物组合物包含基于100wt%的总药物组合物约3wt%至约5wt%的具有通式(b)或(b*)的化合物或其混合物和约95wt%至约97wt%的赋形剂。
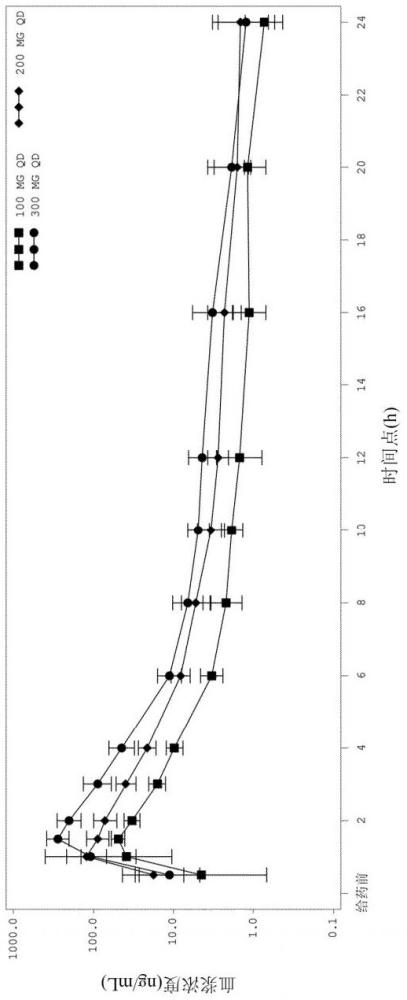
24、还提供了包含本文所描述的药物的口服剂型。口服剂型可以呈胶囊的形式,所述胶囊例如hpmc胶囊或明胶胶囊。在一些实施方案中,口服剂型包含从约1mg至约100mg的化合物,即式(a)、式(a*)或其混合物或式(b)、式(b*)或其混合物的化合物,从约5mg至约50mg的化合物,或从约10mg至约30mg的化合物。
25、本文还提供了治疗或预防与蛋白质聚集相关的疾病和/或神经退行性疾病例如α-突触核蛋白病的方法,其中将治疗有效量的本文公开的药物组合物或口服剂型施用于有相应需要的患者。还提供了用于治疗或预防与蛋白质聚集相关的疾病和/或神经退行性疾病、例如用于治疗或预防α-突触核蛋白病的药物组合物或口服剂型。此外,提供了选自式(a)、式(a*)或其混合物或式(b)、式(b*)或其混合物的化合物,以及包含脂肪酸和聚乙二醇的至少一种单酯和/或脂肪酸和聚乙二醇的至少一种二酯的药学上可接受的赋形剂,
26、其中脂肪酸独立地选自c8-c22脂肪酸;并且
27、聚乙二醇独立地选自包含约20个至约40个氧化乙烯单元的聚乙二醇,
28、用于制备用于治疗或预防与蛋白质聚集相关的疾病和/或神经退行性疾病的药物,例如用于治疗或预防α-突触核蛋白病的药物。α-突触核蛋白病可以选自多系统萎缩(msa)、帕金森病(pd)或路易体痴呆(dlb),优选地多系统萎缩(msa)。药物组合物或药物可以口服施用,并且在不考虑食物摄入的情况下被施用于受试者。
29、还提供了根据以下条款中任一项的药物组合物、单位剂型和方法:
30、1. 一种药物组合物,包含式(a)、式(a*)的化合物或其混合物以及赋形剂,所述赋形剂包含月桂酰基聚氧基-32甘油酯,所述月桂酰基聚氧基-32甘油酯包含甘油单酯、甘油二酯和甘油三酯、peg脂肪酸单酯和/或peg脂肪酸二酯以及游离peg的混合物。
31、2. 根据条款1所述的药物组合物,包含式(b)、式(b*)的化合物或其混合物以及赋形剂,所述赋形剂包含月桂酰基聚氧基-32甘油酯,所述月桂酰基聚氧基-32甘油酯包含甘油单酯、甘油二酯和甘油三酯、peg脂肪酸单酯和/或peg脂肪酸二酯以及游离peg的混合物。
32、3. 根据条款2所述的药物组合物,包含约50mg至约300mg的式(b)、式(b*)的化合物或其混合物。
33、4. 一种口服剂型,包含根据条款1-3,特别是根据条款2或3中任一项所述的药物组合物。
34、5. 根据条款4所述的口服剂型,其中在单剂量施用于禁食健康受试者时,包含50mg化合物的口服剂型提供约54.3 ng/ml的anle138b的几何平均血浆cmax,包含100mg化合物的口服剂型提供约156ng/ml的anle138b的几何平均血浆cmax,包含200mg化合物的口服剂型提供约458ng/ml的anle138b的几何平均血浆cmax,或包含300mg化合物的口服剂型提供约704ng/ml的anle138b的几何平均血浆cmax。
35、6. 根据条款4或条款5所述的口服剂型,其中在单剂量施用于禁食健康受试者时,包含50mg化合物的口服剂型提供约113ng*h/ml的anle138b的几何平均血浆auc(0-24),包含100mg化合物的口服剂型提供约366ng*h/ml的anle138b的几何平均血浆auc(0-24),包含200mg化合物的口服剂型提供约1090ng*h/ml的anle138b的几何平均血浆auc(0-24),或包含300mg化合物的口服剂型提供约1650ng*h/ml的anle138b的几何平均血浆auc(0-24)。
36、7. 根据条款4-6中任一项所述的口服剂型,其中在单剂量施用于禁食健康受试者时,包含50mg化合物的口服剂型提供约3.94小时的anle138b的几何平均血浆t½,包含100mg口服剂型的组合物提供约10.79小时的anle138b的几何平均血浆t½,包含200mg化合物的口服剂型提供约12.76小时的anle138b的几何平均血浆t½,或包含300mg化合物的口服剂型提供约16.22小时的anle138b的几何平均血浆t½。
37、8. 根据条款4所述的口服剂型,其中在持续至少7天每天一次施用于禁食健康受试者时,包含100mg化合物的口服剂型在第1天提供约135ng/ml的anle138b的几何平均血浆cmax,并且在第7天提供约70.9 ng/ml的anle138b的几何平均血浆cmax,包含200mg化合物的口服剂型在第1天提供约447ng/ml的anle138b的几何平均血浆cmax,并且在第7天提供约128ng/ml的anle138b的几何平均血浆cmax,或包含300mg化合物的口服剂型在第1天提供约910ng/ml的anle138b的几何平均血浆cmax,并且在第7天提供约307ng/ml的anle138b的几何平均血浆cmax。
38、9. 根据条款4或条款8所述的口服剂型,其中在持续至少7天每天一次施用于禁食健康受试者后,包含100mg化合物的口服剂型在第1天提供约261ng*h/ml的anle138b的几何平均血浆auc(0-tau),并且在第7天提供约141ng*h/ml的anle138b的几何平均血浆auc(0-tau),包含200mg化合物的口服剂型在第1天提供约905ng*h/ml的anle138b的几何平均血浆auc(0-tau),并且在第7天提供约308ng*h/ml的anle138b的几何平均血浆auc(0-tau),或包含300mg化合物的口服剂型在第1天提供约2210ng*h/ml的anle138b的几何平均血浆auc(0-tau),并且在第7天提供约633ng*h/ml的anle138b的几何平均血浆auc(0-tau)。
39、10. 根据条款4或条款8-9中任一项所述的口服剂型,其中在持续至少7天每天一次施用于禁食健康受试者后,包含100mg化合物的口服剂型在第7天提供约4.23小时的anle138b的几何平均血浆t½,包含200mg化合物的口服剂型在第7天提供约9.48小时的anle138b的几何平均血浆t½,或包含300mg化合物的口服剂型在第7天提供约6.07小时的anle138b的几何平均血浆t½。
40、11. 根据条款4所述的口服剂型,其中在禁食条件下单剂量施用于健康受试者后,包含150mg化合物的口服剂型提供约442ng/ml的anle138b的几何平均血浆cmax和/或约896ng*h/ml的anle138b的几何平均血浆auc(0-24)和/或约11.3小时的anle138b的几何平均血浆t½。
41、12. 根据条款4所述的口服剂型,其中在进食条件下单剂量施用于健康受试者后,包含150mg化合物的口服剂型提供约196ng/ml的anle138b的几何平均血浆cmax和/或约641ng*h/ml的anle138b的几何平均血浆auc(0-24)和/或约15.22小时的anle138b的几何平均血浆t½。
42、13. 根据条款4所述的口服剂型,其中在进食条件下持续连续7天每天一次向患者施用包含150mg化合物的组合物后,在第1天提供约462ng/ml的anle138b的几何平均血浆cmax和/或约1040ng*h/ml的anle138b的auc(0-24)。
43、14. 根据条款4所述的口服剂型,其中在进食条件下持续连续7天每天一次向患者施用包含150mg化合物的口服剂型后,在第7天提供约160ng/ml的anle138b的几何平均血浆cmax和/或约388ng*h/ml的anle138b的auc(0-24)和/或约11.7 h的anle138b的t½。
44、15. 根据条款4所述的口服剂型,其中在进食条件下持续连续7天每天一次向患者施用包含300mg化合物的组合物后,在第1天提供约933ng/ml的anle138b的几何平均血浆cmax和/或约2500ng*h/ml的anle138b的auc(0-24)。
45、16. 根据条款4所述的口服剂型,其中在进食条件下持续连续7天每天一次向患者施用包含300mg化合物的组合物后,在第7天提供约365ng/ml的anle138b的几何平均血浆cmax和/或约722ng*h/ml的anle138b的auc(0-24)和/或约12.1 h的anle138b的t½。
46、17. 根据条款4所述的口服剂型,其中在禁食条件下持续连续7天每天两次向患者施用包含150mg化合物的组合物后,在第1天提供约546ng/ml的anle138b的几何平均血浆cmax和/或约993ng*h/ml的anle138b的auc(0-24)。
47、18. 根据条款4所述的口服剂型,其中在禁食条件下持续连续7天每天两次向患者施用包含150mg化合物的组合物后,在第7天提供约182ng/ml的anle138b的几何平均血浆cmax和/或约297ng*h/ml的anle138b的auc(0-24)和/或约14.2小时的anle138b的t½。
48、19. 根据条款1-3中任一项所述的药物组合物或根据条款4-18中任一项所述的口服剂型,用于治疗或预防与蛋白质聚集相关的疾病和/或神经退行性疾病。
49、20. 根据条款19所述的用于使用的药物组合物或用于使用的口服剂型,其中所述疾病是α-突触核蛋白病,例如其中所述突触核蛋白病是多系统萎缩(msa)、帕金森病(pd)或路易体痴呆(dlb),优选地多系统萎缩(msa)。
50、21. 一种治疗或预防与蛋白质聚集相关的疾病和/或神经退行性疾病的方法,所述方法包括向有相应需要的受试者施用治疗有效量的根据条款1-3中任一项所述的药物组合物或根据条款4-18中任一项所述的口服剂型。
51、22. 根据条款21所述的方法,其中所述疾病是α-突触核蛋白病,例如其中所述突触核蛋白病是多系统萎缩(msa)、帕金森病(pd)或路易体痴呆(dlb),优选地多系统萎缩(msa)。
52、口服剂型可以以一个或更多个单位施用,其中每个单位包含约10mg至约50mg、或约10mg、或30mg的式(b)、式(b*)的化合物或其混合物。
- 还没有人留言评论。精彩留言会获得点赞!
- N-烯基苯并三唑类氮氧衍生物及其制备方法和应用
- 含有噻二唑衍生物、纳米铜和石墨烯的添加剂,添加剂制备方法,含该有该添加剂的润滑油的制作方法
- 一种具有抗菌活性的手性螺1,2,3-噻二唑衍生物及其合成方法和应用
- 含有噻二唑衍生物和纳米铜的润滑油添加剂,添加剂的制备方法,及含有该添加剂的润滑油的制作方法
- 作为免疫调节剂的1,3,4-*二唑和1,3,4-噻二唑衍生物的制作方法
- 含有噻二唑衍生物和石墨烯的润滑油添加剂,添加剂的制备方法,及含有该添加剂的润滑油的制作方法
- 一类1,3,4-噻二唑衍生物、制备方法及应用
- 一类1,3,4-噻二唑衍生物、合成方法及其应用
- 一种双磷酸酯唑类衍生物的制备方法
- 一种用于rv减速器的锂基润滑脂及其制备方法