用CGRP受体拮抗剂治疗内感受障碍的制作方法
本发明涉及用于治疗内感受障碍的药物领域。
背景技术:
1、内感受是个体了解其自身身体状态的机制。内感受使得每个个体都能不断收集内部器官的功能的信息,从而在功能障碍时,可启动特定响应以恢复体内稳态。通过这样做,内感受可让个体分辨器官和功能(健康状况)的正常和功能紊乱,例如胃肠道、呼吸器官、食欲和饱腹感、情绪状态、情感、动机以及疼痛的存在。从这个角度出发,不适感源于发出负面健康状况信号的内感受信息。因此,内感受与调节身体在环境中的意识的外感受相反。
2、从神经生理学的观点来看,由内感受信号传导定义的健康状况是由属于感觉神经系统(机械、热、伤害性感受)和自主神经系统的神经元传入介导的。这些外周神经首先投射到脑干核团(主要是旁臂核),然后被重新定向到下丘脑、杏仁核、丘脑,内感受信息从这些脑区到达顶叶、额叶和岛叶皮层,在这些部位对健康状况的意识和情感成分进行解码。
3、众所周知,在接收到负面的内感受信息(不适信号)个体中,最常见的稳态响应之一是食欲不振,也称为厌食症。尽管这种响应看似自相矛盾,但是实际上是动物的关键先祖响应,目的在于通过阻止个体摄入可能导致疾病的食物来保护自身。当然,当厌食响应延长时,就会变成对健康状况有害的事件,导入热量摄入过度降低、体重减轻、虚弱以及机体防御能力普遍紊乱。已知许多肝脏、肾脏、胃肠道、免疫、感染和疼痛病症都与食欲不振和厌食症相关。同样,中毒或药物治疗也可以引发类似的厌食反应。在后者中,抗癌化疗经常与厌食症有关。不幸的是,这种类型的厌食症经常会达到严重的强度,严重降低患者的热量摄入。这反过来又会导致治疗中断,不可避免地导致化疗失败和肿瘤不受限制地生长。还值得注意的是,肿瘤患者还面临另一种体重减轻/厌食症的风险,即肿瘤恶病质,这是一种严重的临床病症,其中食欲不振伴随着由肿瘤来源的信号触发的脂肪和肌肉组织的损失。
4、鉴于与负面内感受信号传导相关的饮食失调发生率较高,以及随之而来的严重临床状况,已经付出了巨大努力来鉴定能够恢复这些个体营养稳态的药物。
5、因此,要解决的问题是确定能够在不同类型的病症期间抵消内感受信号传导的药物。
6、尽管内感受的神经化学在很大程度上仍未解开,但在临床前水平上已经确定了调节感觉传入的中枢处理和信号紊乱的特异性神经肽。神经肽是小的(10至40个氨基酸)的蛋白质分子,其在中枢神经系统和外周神经系统中发挥多种神经元和神经内分泌功能。值得注意的是,神经肽以囊泡依赖性方式释放,但是与诸如谷氨酸、血清素或去甲肾上腺素不同,神经肽可促进持久的突触后信号传导,通常达到距离释放部分很远的神经元,从而维持所称的“容积传递”。
7、在许多神经肽中,降钙素基因相关肽(cgrp)是具有中枢和外周作用的37个氨基酸的分子。尽管已经对cgrp的外周血管舒张作用进行了深入的研究和表征,但是大部分神经肽的中枢作用仍待确定。众所周知,这种知识的缺乏必须主要归因于外周作用的cgrp受体激动剂和拮抗剂无法穿过血脑屏障。诸如不渗透性的特性不可避免地阻碍了使用这些工具调节cgrp神经传递,并理解其在神经生理病理学中作用的可能性(nat rev neurol.2018;14:338-35)。为了避免这一技术问题,科学家通过脑内注射调节神经肽受体的药物或表达调节cgrp神经传递的蛋白质的病毒来调节cgrp神经传递。值得注意的是,这种技术并不适用于临床且无法利用。
8、通过这些侵入性实验方法,已经显现出来cgrp在调节情绪功能(例如对应激和厌恶刺激的反应)中的关键作用。就厌恶刺激而言,现在已知cgrp是内感受信息的关键参与者,其到达旁臂核,然后重定向至杏仁核。这一信号传导通路似乎在整合携带内感受信息的感觉传入和自主神经传入发挥重要作用,从而通常促进对不同类型的应激、疼痛和不适产生特定的稳态反应(trends neurosci.2018;41:280-293)。在此基础上,理论上可通过调节中枢神经系统内的cgrp神经传递来调节内感受。不幸的是,迄今为止尚未发现任何药物能够通过采用临床适用且可利用的方法在外周施用,能够到达大脑并调节中枢神经系统内的cgrp依赖性内感受信号传导。
9、cgrp受体的拮抗剂(通常称为“吉泮类”)已被开发用于对症治疗偏头痛。第一种吉泮类(例如奥泽吉泮(olcegepant)和替卡吉泮(telcagepant))被证明是有效的抗偏头痛药物,但由于出现肝毒性而停止了开发。最近,已经开发了新的、非肝毒性的吉泮类,例如乌布吉泮(ubrogepant)、瑞美吉泮(rimegepan)、阿托吉泮(atogepant)、和扎维吉泮(zavegepant)用于偏头痛的对症治疗。已知由于吉泮类无法穿透血脑屏障,因此他们无法渗透到大脑中(j.pharmacol.exp.ther.2013,347:478-86)。事实上,已知吉泮类在脑膜内的三叉神经血管传入神经水平上发挥抗偏头痛作用(nat.rev.neurol.2018;14:338-350;cephalalgia.2020;40:924-934)。
10、因此,本领域专家在现有技术中没有发现任何线索表明吉泮类在中枢神经系统中发挥作用。同样,本领域专家在现有技术中也没有发现任何线索表明吉泮类调节内感受,以及大脑处理内感受信息引起的稳态反应。
11、因此,要解决的技术问题是鉴定能够抑制脑内cgrp的作用的药物,以调节cgrp依赖性内感受信息和由内感受信号引起的响应,这种响应会导致不适并对个人的健康状况产生负面影响。
技术实现思路
1、出乎意料的是,我们现在已经在许多人类病症的实验模型中,发现口服(即外周)施用吉泮类例如瑞美吉泮、乌布吉泮、阿托吉泮和扎维吉泮能够调节大脑对内感受信息(即不适)的处理。
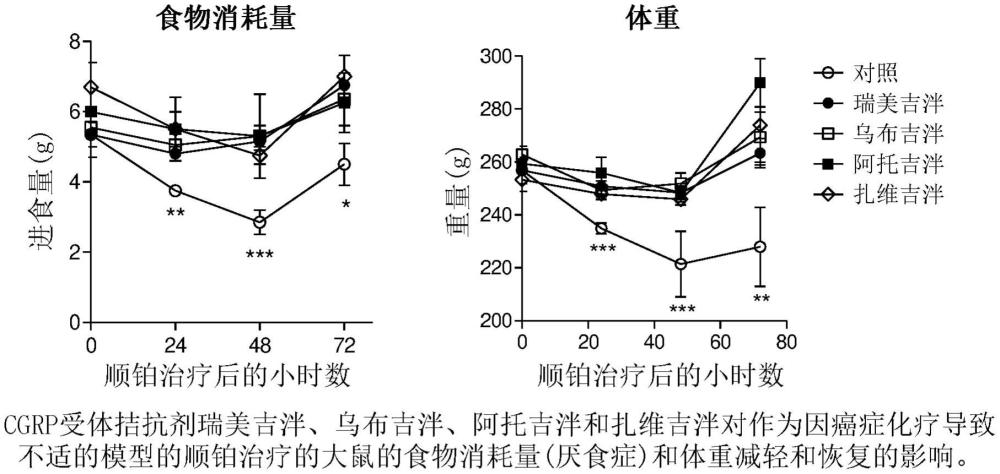
2、具体地,我们意外地发现,在作为因抗肿瘤化疗导致不适的实验模型中,在接受化疗药物顺铂(6mg/kg,腹膜内)的大鼠中,口服施用瑞美吉泮、乌布吉泮、阿托吉泮和扎维吉泮降低厌食/厌食症,体重减轻并加速体重恢复(图1)。
3、此外,我们意外地发现,在作为因慢性疼痛导致不适的实验模型中,在因注射弗氏佐剂而患有慢性关节炎的小鼠中,口服施用瑞美吉泮、乌布吉泮、阿托吉泮和扎维吉泮降低厌食/厌食症,体重减轻并增加了自发运动性(图2)。
4、与这些发现一致,我们意外地发现,在作为因腹部手术导致不适的实验模型中,在接受剖腹手术和肠道操作的大鼠中,口服施用瑞美吉泮、乌布吉泮、阿托吉泮和扎维吉泮完全防止体重减轻,甚至部分防止厌食/厌食症(图3)。
5、此外,我们已经在肝病模型中测试了吉泮类,这种疾病通常会导致虚弱、体重减轻和快感缺乏。我们意外地发现,在作为因肝病导致不适的模型中,在用四氯化碳治疗的大鼠中,口服施用瑞美吉泮、乌布吉泮、阿托吉泮和扎维吉泮降低体重减轻,导致淡水(sweetwater)消耗量增加(后者是动机行为的指标,与快感缺乏相关)(图4)。
6、此外,我们意外地发现,在作为胰腺炎的实验模型中,在注射了雨蛙素(cerulein)的大鼠中,口服施用瑞美吉泮、乌布吉泮、阿托吉泮和扎维吉泮防止体重减轻和自发运动减少(图5)。
7、此外,我们已经在作为肾功能不全的实验模型中,在含有0.75%腺嘌呤的饮食治疗的大鼠中测试了吉泮类。我们意外地发现,口服施用瑞美吉泮、乌布吉泮、阿托吉泮和扎维吉泮减少了动物的体重减轻并减少了食物消耗量/厌食症(图6)。
8、此外,我们意外地发现,在作为哮喘或慢性阻塞性肺病的模型中,在用卵清蛋白致敏和再激发的小鼠中口服施用瑞美吉泮、乌布吉泮、阿托吉泮和扎维吉泮降低了不适的参数,例如自发运动,体重减轻和和淡水消耗量降低(图7)。
9、在作为由于内感受信息导致的不适的其它模型中,我们采用了肿瘤恶病质和脓毒症的模型。图8示出了在作为因肿瘤恶病质导致不适的经典模型中,在注射吉田肝癌的大鼠中,口服施用瑞美吉泮、乌布吉泮、阿托吉泮和扎维吉泮在体重减轻、抵消肌肉质量损失和食物消耗量减少/厌食症具有意想不到的能力。
10、类似地,我们意外地发现,在作为因脓毒症/全身免疫激活导致不适的经典模型中,在腹腔注射鼠伤寒沙门氏菌(salmonella typhimurium)脂多糖的大鼠中,口服施用瑞美吉泮、乌布吉泮、阿托吉泮和扎维吉泮降低体重减轻,降低食物消耗量/厌食症(图9)。
11、根据本发明,可通过口服、静脉内、动脉内、肌内、鼻内、透皮和皮下途径配制和施用吉泮类来治疗内感知失调。施用的吉泮类的量是这类药物通常采用的剂量,例如每天、每周或每月施用10mg至3000mg。
- 还没有人留言评论。精彩留言会获得点赞!