一种红细胞膜仿生修饰的“核-壳”型纳米复合材料的制备方法及其应用
本发明属于抗肿瘤药物制备,具体涉及一种红细胞膜仿生修饰的“核-壳”型纳米复合材料的制备方法及其应用。
背景技术:
1、癌症一直以来是危害人类健康的大敌。虽然化疗是临床上最重要和最有效的癌症治疗方法之一,但化疗药物对正常细胞的高毒性仍然是最具挑战性的问题。因此,设计并开发出一些新型的、安全可控、且更加精准的治疗手段用于辅助或替代传统的化疗显得尤为重要。伴随着纳米科技的迅猛发展,许多新型的治疗方式和纳米材料系统应运而生,大大改善了传统治疗的缺陷。
2、纳米材料具有结构稳定、表面积大、独特的物理化学性质等优点,可作为药物递送系统,用于延长药物在体内的血液循环性能、赋予药物富集在肿瘤部位以及光照或超声引发光热治疗(ptt),光动力治疗(pdt)或声动力治疗(sdt)等。由于光疗和超声治疗具有时空选择性、高时空分辨率和微创性等特性,能够在很大程度上提高癌症治疗效果并减轻患者的疼痛感,近年来在生物医用领域展现出巨大的潜力。在众多的纳米材料中,二氧化钛(tio2)纳米材料作为一种典型的n型半导体,在癌症治疗研究应用中,外源刺激包括紫外光(uv)激发和超声辐射(us)下表现出很高的响应。然而,传统的tio2纳米载体禁带宽度比较宽(带隙能量为3.0-3.2ev),光吸收阈值主要在紫外区,严重降低了光利用率。而且,紫外线对生物组织极其有限的穿透能力限制了其在抗肿瘤光疗中的应用。此外,被光照/超声激活的tio2纳米材料中容易出现电子和空穴的快速复合,进而也影响了其催化活性。因此提高tio2的近红外光(nir)吸收能力和增加晶体结构中的缺陷物种,对提高材料整体的抗癌治疗应用具有重大意义。
3、此外,介孔二氧化硅(msn)纳米材料具有比表面积大、独特的介孔孔道结构、孔径和孔体积可调控及良好的生物相容性等优势,在构建药物递送体系方面具有很大的潜力。然而,msn有限的降解性能和体内代谢依然是材料研究者在构建药物递送体系过程中需要重点考虑和亟需解决的问题。可生物降解的二硫键桥接介孔有机硅无机纳米材料应运而生,其良好的生物可降解性不仅可以加快纳米材料在体内的清除速率,提高其生物相容性,还有助于调控药物的释放行为,进而提高治疗效果并降低药物对人体的毒副作用,赋予了硅基纳米材料广阔的设计空间。
技术实现思路
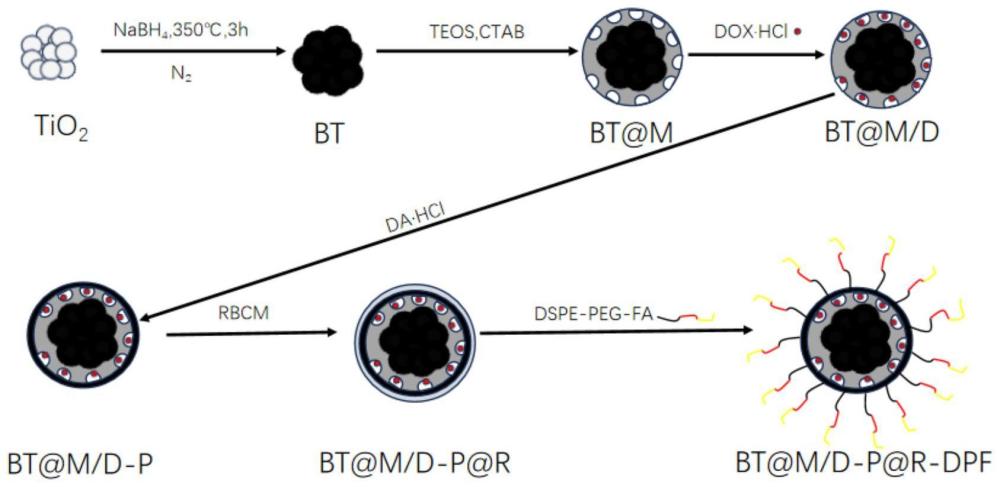
1、本发明公开了一种具有良好光热效果及载药能力的可降解介孔硅包覆的黑色tio2(bt@m)的合成及用于负载抗癌药物盐酸阿霉素(dox·hcl),包覆具有ph响应性的聚多巴胺(pda)涂层作为门控分子,最终包覆叶酸(fa)靶向的红细胞膜(rbcm)延长纳米粒子(nps)在体内的循环时间,实现肿瘤靶向性化疗-光热联合治疗。
2、一种红细胞膜仿生修饰的“核-壳”型纳米复合材料的制备方法,首先利用氢化还原法使白色tio2转化为氢化的黑色tio2;其次,在黑色tio2表面通过原位反应合成含有-s-s-键可被还原型谷胱甘肽降解的介孔有机二氧化硅外壳,然后将抗癌药物负载至介孔孔道中,并进一步包覆具有ph响应性的聚多巴胺涂层;接着,采用静电吸附法在其表面包覆红细胞膜;最后,进行靶向叶酸修饰,得到红细胞膜仿生修饰的“核-壳”型纳米复合材料;
3、所述黑色二氧化钛b-tio2由以下方法制备得到:
4、将白色tio2与nabh4研磨混匀后密封,放入管式炉中,以氮气为保护气,升温至300-400℃反应2-5h(优选为以5℃/min升温至350℃反应3h),自然冷却至室温,洗涤以除去未反应的nabh4,洗涤后的固体于真空干燥(优选干燥温度为60℃)得到黑色二氧化钛b-tio2。
5、进一步的,上述制备方法包括以下步骤:
6、(1)b-tio2@mon的制备:
7、将黑色b-tio2均匀分散于水中后,向其中加入表面活性剂,搅拌至反应完全(优选反应时间为10-16h,更优选为12h),然后再加入无水乙醇与naoh溶液(优选为2mol/l的naoh水溶液),加完后,在氮气保护下加热至30-80℃(优选为70℃),再逐滴加入正硅酸乙酯teos和双-[3-(三乙氧基硅)丙基]-二硫化物的混合物(两者的体积比优选为1:1.6),加完后,在30-80℃(优选为70℃)下搅拌反应10-20h(优选为反应12h),反应完成后洗涤、真空干燥,然后去除其中的表面活性剂得到b-tio2@mon;
8、(2)药物@b-tio2@mon-pda纳米粒子的制备:
9、称取上述b-tio2@mon超声分散于tris溶液中(优选为10mm ph=8.5的tris溶液),再向其中加入抗癌药物并超声使其溶解,然后避光搅拌12-36h(优选为24h)后得混合溶液,然后称取盐酸多巴胺da·hcl加入上述混合溶液中,继续避光搅拌3-8h(优选为5h),离心,洗涤,室温下真空干燥得药物@b-tio2@mon-pda纳米粒子;
10、(3)红细胞膜仿生修饰的“核-壳”型纳米复合材料的制备
11、①称取药物@b-tio2@mon-pda纳米粒子的分散液,再加入红细胞膜rbc m的分散液,避光搅拌10-20h(优选为12h),洗涤,将洗涤后的纳米粒子重新分散在缓冲液中得到药物@b-tio2@mon-pda@rbcm的分散液,避光存放于4℃冰箱待用,本步骤中各物质均分散于磷酸盐缓冲液中;
12、②向药物@b-tio2@mon-pda@rbcm的分散液中加入磷脂-聚乙二醇-叶酸dspe-peg-fa,室温下避光搅拌过夜,离心、洗涤,重新分散于pbs缓冲液中,得到红细胞膜仿生修饰的“核-壳”型纳米复合材料的分散液。
13、进一步的,上述步骤②的产物红细胞膜仿生修饰的“核-壳”型纳米复合材料可以以行业内常规方法干燥后保存。
14、进一步的,所述表面活性剂为cn1h2n1+1(ch3)3nbr或非离子型双子胺表面活性剂cn2h2n2+1nh(ch2)2nh2或者非离子表面活性剂聚乙烯醚-聚丙烯醚-聚乙烯醚三嵌段高分子共聚物p123,其中,n1=8、10、12、14、16或18,n2=10、12或14,优选为十六烷基三甲基溴化铵ctab。
15、进一步的,所述步骤(1)中去除表面活性剂的具体操作为:将干燥后的b-tio2@mon分散于含有硝酸铵的无水乙醇溶液(优选的,所述溶液中硝酸铵的浓度为6mg/ml)中,在60℃条件下搅拌反应4h,反应结束后,固液分离,再次重复一次上述过程,以确保完全除去表面活性剂,反应完成后,用水与无水乙醇以11000rpm、10min的条件交替离心洗涤各三次,洗涤后的固体于60℃下真空干燥得到b-tio2@mon。
16、更进一步的,所述白色tio2与nabh4的质量比1:1。
17、进一步的,所述步骤(2)中b-tio2@mon、抗癌药物与盐酸多巴胺的质量比为20:5:1。
18、进一步的,所述①中药物@b-tio2@mon-pda纳米粒子与rbcm的质量比为2.5:1;②中药物@b-tio2@mon-pda@rbcm与磷脂-聚乙二醇-叶酸的质量比为4:1。
19、进一步的,上述缓冲液为10mm ph=7.4pbs缓冲液。
20、进一步的,所述红细胞膜rbcm由以下方法得到:
21、从健康的balb/c小鼠中采集全血后,通过离心分离红细胞rbc,并用4℃的磷酸盐缓冲液洗涤三次,将获得的红细胞重新悬浮在0.25mm乙二胺四乙酸(edta)低渗溶液中以诱导红细胞破裂,然后将溶液离心(14000g,30min)收集红细胞膜rbcm,重复上述低渗破裂和离心处理直到收集到的rbcm溶液无色。将rbcm无色溶液冻干并储存在-80℃条件下以供下一步使用;
22、称取上一步冻干得到的rbcm 6mg,加入6ml ph=7.4pbs缓冲液超声溶解,待rbcm完全溶解后,使用细胞超声破碎仪破碎10min,使rbcm更加分散,使用脂质体挤出器结合直径800nm的聚碳酸脂膜,将超声破碎好的rbcm吸入脂质体挤出器中反复推挤11次,待上述rmcm溶液全部通过800nm聚碳酸脂膜挤出后,换成直径400nm的聚碳酸酯膜,继续反复推挤11次,得到直径约为400nm rbcm的分散液,rbcm的浓度约为1mg/ml。
23、进一步的,所述抗癌药物为紫杉醇、10-羟基喜树碱、替莫唑胺或盐酸阿霉素。
24、本发明还提供了上述红细胞膜仿生修饰的“核-壳”型纳米复合材料在制备抗癌药物中的应用。
25、本技术设计并构建了一类兼具超长循环、肿瘤靶向和药物可控释放等优势的新型仿生类药物递送体系。首先,利用氢化还原法使白色tio2表面生成大量深层次缺陷(ti3+、-oh等),将其转化为氢化的黑色tio2(bt),从而提高了二氧化钛在可见光/近红外光(vis/nir)区域的吸收,进而提升其光能利用率。其次,在bt表面通过原位反应合成含有-s-s-键可被还原型谷胱甘肽降解的介孔有机二氧化硅(mons)外壳,然后将抗癌药物,比如阿霉素(dox)负载至介孔孔道中,并进一步包覆具有ph响应性的聚多巴胺(pda)涂层作为“纳米阀”,实现对dox的有效包埋和智能型释放。最后,采用静电吸附法制备红细胞膜(rbcm)包覆的仿生纳米粒子(bt@m/d-p@r),并进一步靶向修饰dspe-peg-fa,从而制备一类仿生型纳米复合药物载体,以有效躲避体内复杂的生物屏障,延长纳米粒子在体内的循环时间,实现纳米粒子在肿瘤中的高效蓄积。在显著提高药物抗癌效果的同时降低其毒副作用,最终产生肿瘤靶向性化疗-光热联合治疗。
26、与现有技术相比,本发明具有以下优势和有益效果:
27、(1)二氧化钛的宽带隙(3.2ev)限制了它们的光吸收仅在紫外区。本技术利用硼氢化钠化学还原法将白色二氧化钛转化为黑色tio2(bt),表面无序和化学缺陷使其带隙大幅缩小,具有增强的近红外光吸收性能和光热性能;
28、(2)以黑色tio2(bt)为内核,包覆了可降解介孔硅,显著提高实心tio2的药物负载能力;
29、(3)介孔二氧化硅纳米颗粒(msn)中的si-o键稳定且不易分解,导致msn在体内停留时间过长,可能会造成潜在的生物安全问题。因此,本技术在msn中引入谷胱甘肽(gsh)响应性二硫键,制备在生物体内可降解的有机介孔硅(mon)。利用肿瘤细胞的高gsh环境诱导mon在肿瘤环境中发生特异性降解,从而提高包埋在mon中的药物可控释放性能、材料在体内的降解能力和生物相容性,并大大降低药物对正常细胞的毒性;
30、(4)红细胞膜(rbcm)表面存在诸多蛋白和基团,有助于巧妙避免遭受免疫系统的检查,因此将红细胞膜修饰到nps的表面后,可赋予nps拥有红细胞膜的这种特异性功能,从而降低被免疫系统清除的概率,延长nps在体内的循环时间。与此同时,通过靶向基团fa的修饰,进一步提高药物在不损害正常细胞的情况下能快速富集于肿瘤组织,进而发挥药物高效治疗肿瘤的作用。
- 还没有人留言评论。精彩留言会获得点赞!