用于治疗癌症的免疫修饰粒子的制作方法
发明领域本公开总体上涉及使用免疫修饰粒子与诸如检查点调节剂、小分子或生物剂等癌症治疗剂的组合通过改变肿瘤微环境中的髓源性抑制细胞(mdsc)、肿瘤相关巨噬细胞(tam)、嗜中性粒细胞以及单核细胞来治疗癌症和增生性疾病的方法。
背景技术:
1、现在广泛认为独特髓源性细胞群是肿瘤微环境的一部分。这些细胞包括单核细胞、肿瘤相关巨噬细胞(tam)、髓源性抑制细胞(mdsc)以及树突细胞(kumar等,trendsimmunol.,37(3):208-220(2016);richards等,cancer microenviron.,6(2):179-91(2013))。大量工作表明,这些细胞是主动招募至肿瘤位点和转移位点的,在这些位点它们可根据来自局部环境的提示发生变化从而促成免疫抑制微环境(kumar等,trendsimmunol.,37(3):208-220(2016);kitamura等,front immunol.,8:2004(2018);kitamura等,j exp med.,212(7):1043-59(2015))。已证实这些细胞的免疫抑制活性促进肿瘤生长、增殖、血管生成、转移以及肿瘤免疫逃避。此外,肿瘤微环境(tme)中mdsc和tam的存在与不良疾病结果相关(gabrilovich等,nat rev immunol.,12(4):253-68(2012);ouzounova等,nat comm.,8:14979(2017);marvel等j clin invest.,125(9):3356-64(2015))。
2、除免疫细胞之外,肿瘤基质也在形成肿瘤微环境以及影响肿瘤生长和进展中起作用。肿瘤相关基质的细胞和分子组成,包括成纤维细胞、间充质基质细胞、脂肪细胞、内皮以及细胞外基质(ecm),已全部被证实促进肿瘤发生(valkenburg等,nat rev clin oncol.,15(6):366-381(2018))。已证实组织驻留和骨髓间充质干细胞(msc)源性癌症相关成纤维细胞(caf)分泌生长因子以及改变抗肿瘤免疫反应并且促进肿瘤生长和转移的蛋白质(valkenburg等,nat rev clin oncol.,15(6):366-381(2018);shiga等,cancers,7,2443-2548(2015))。类似地,已报道ecm蛋白、间充质基质细胞、内皮细胞以及脂肪细胞阻抑抗肿瘤免疫性并且促进肿瘤进展(lu等,j cell biol.,196(4):395-406(2012);kumar等,cancer cell 32(5):654-668.e5(2017);quante等,cancer cell.,19,257-272(2011);park等,endocr rev.,32(4):550-70(2011);young等,cancer immunol immunother.,61(10):1609-16(2012);hida等,int j mol sci.,19(5):1272(2018))。
3、虽然已在研发新颖抗癌治疗剂中取得重大进展,但归因于它们靶向肿瘤而不是靶向肿瘤微环境(tme)中抑制抗肿瘤免疫功能并且促进肿瘤进展的免疫抑制因子的事实,这些疗法的功效显示有限的前景。
4、通过免疫检查点受体(例如程序化细胞死亡蛋白1(pd-1)和ctla-4)和其配体(例如pd-l1)的信号传导调控细胞毒性t细胞的活性,并且已显示在调节炎性免疫反应中发挥关键作用。重要地,已知许多肿瘤类型拦截pd-1/pd-l1和ctla-4免疫检查点信号传导路径,以避开t细胞介导的抗肿瘤免疫反应。因此,使用如单克隆抗体等特定抑制剂靶向免疫检查点信号传导路径已在许多癌症中成为有吸引力的第一线治疗选择(alsaab等,frontpharmacol 8:561(2017))。然而,已显示肿瘤微环境中髓源性抑制细胞(mdsc)和肿瘤相关巨噬细胞(tam)的存在与肿瘤相关基质一起阻抑如抗pd1单克隆抗体等免疫检查点抑制剂的抗肿瘤功效(weber等,front immunol.,9:1310,(2018);highfill等,sci transl med.,6(237):237ra67(2014);zhao等,cancer immunol res.,6(12):1459-1471(2016);wang等,nat commun.,9(1):3503(2018))。
5、免疫修饰粒子(imp)为具有免疫调节性质的带负电荷的纳米粒子(参见例如美国专利公布号us20150010631;us20130323319)。
技术实现思路
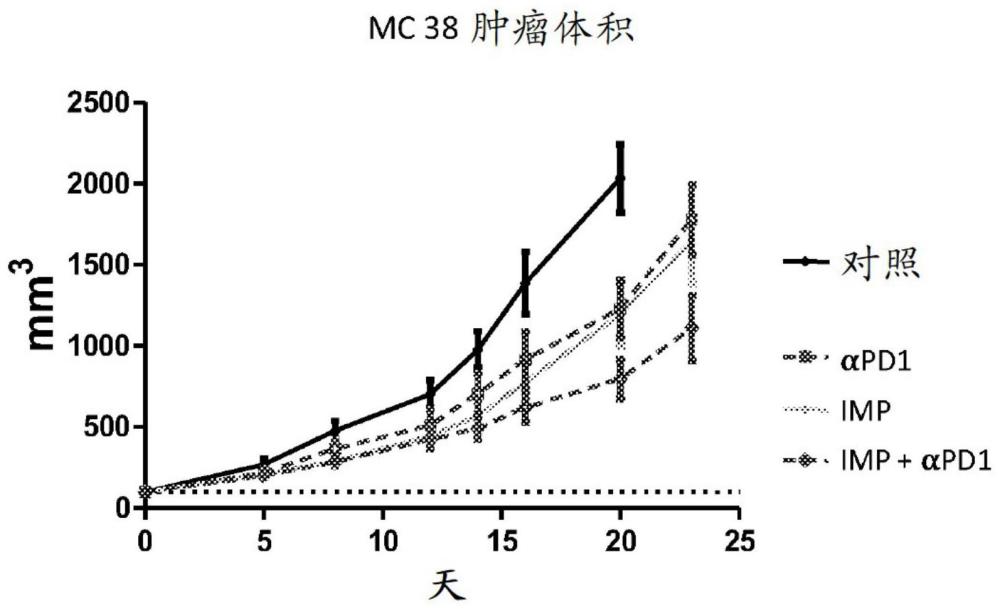
1、本公开提供了一种治疗癌症和增生性疾病的方法,所述方法包括施用不含能够抑制受试者中的单核细胞和其他吞噬细胞的抗原或其他生物活性剂的免疫修饰粒子与癌症疗法的组合。在不受理论约束的情况下,假定imp改变肿瘤微环境中的免疫抑制单核细胞源性细胞,这又将在向受试者施用时增强其他癌症疗法的功效。本文中表明,与使用癌症治疗剂(诸如免疫检查点抑制剂)的单一疗法相比,可靶向两种肿瘤细胞并且通过靶向mdsc、tam、嗜中性粒细胞、其他单核细胞源性细胞以及肿瘤相关基质克服免疫抑制肿瘤微环境的使用imp和癌症治疗剂的组合疗法也许能提供增强的治疗益处。
2、在各个实施方案中,本公开提供了一种治疗受试者的癌症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变肿瘤位点处的髓源性抑制细胞(mdsc)、肿瘤相关巨噬细胞(tam)、嗜中性粒细胞、单核细胞、树突细胞的群体和/或基质。
3、在各个实施方案中,本公开提供了一种治疗受试者的癌症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变肿瘤相关基质。
4、在各个实施方案中,本公开提供了一种治疗受试者的癌症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变基质结缔组织、成纤维细胞、内皮、脂肪组织、细胞外基质、外膜细胞、癌症干细胞、间充质干细胞和/或间充质基质细胞。
5、在各个实施方案中,本公开提供了一种治疗受试者的癌症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用使肿瘤尺寸减小和/或使肿瘤生长减少。在各个实施方案中,所述施用经由由肿瘤细胞直接摄入粒子诱导肿瘤细胞死亡、凋亡和/或坏死。
6、在各个实施方案中,本公开提供了一种治疗受试者的癌症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用调控抗肿瘤免疫反应。
7、在各个实施方案中,本公开提供了一种治疗受试者的癌症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变或调节肿瘤特异性免疫反应。
8、在各个实施方案中,本公开提供了一种治疗受试者的增生性疾病的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变肿瘤位点处的髓源性抑制细胞(mdsc)、肿瘤相关巨噬细胞(tam)、树突细胞、嗜中性粒细胞和/或单核细胞的群体。
9、在各个实施方案中,本公开提供了一种治疗受试者的增生性疾病的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变肿瘤相关基质。
10、在各个实施方案中,本公开提供了一种治疗受试者的增生性疾病的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变基质结缔组织、成纤维细胞、内皮、脂肪组织、细胞外基质、外膜细胞、间充质干细胞和/或间充质基质细胞。
11、在各个实施方案中,本公开提供了一种治疗受试者的增生性疾病的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用使肿瘤尺寸减小和/或使肿瘤生长减少。
12、在各个实施方案中,本公开提供了一种治疗受试者的增生性疾病的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用调控抗肿瘤免疫反应。
13、在各个实施方案中,本公开提供了一种治疗受试者的增生性疾病的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用调控肿瘤特异性免疫反应。
14、在各个实施方案中,本公开提供了一种治疗受试者的癌症或增生性病症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用调控癌症干细胞。
15、在各个实施方案中,带负电荷的粒子为聚乙醇酸(pga)粒子、聚乳酸(pla)粒子、聚苯乙烯粒子、聚(乳酸-共-乙醇酸)(plga)粒子、金刚石粒子,或铁、锌、镉、金或银粒子,或它们的组合。
16、在一些实施方案中,带负电荷的粒子为聚(乳酸-共-乙醇酸)(plga)粒子。在各个实施方案中,粒子包含约50:50、约80:20至约100:0的聚乳酸:聚乙醇酸或约50:50、约80:20至约100:0的聚乙醇酸:聚乳酸。在各个实施方案中,粒子包含50:50的聚乳酸:聚乙醇酸。在各个实施方案中,粒子包含约99:1至约1:99的聚乳酸:聚乙醇酸,包括位于这些值之间的所有值和范围。
17、在各个实施方案中,粒子为表面官能化的。在各个实施方案中,通过羧化来实现表面官能化。在其他实施方案中,通过添加靶向剂来实现表面官能化。在一些实施方案中,所述靶向剂包含多肽、抗体、核酸、脂质、小分子、碳水化合物以及表面活性剂。在各个实施方案中,使表面官能化的纳米粒子优先靶向单核细胞、嗜中性粒细胞、巨噬细胞、树突细胞、t细胞、b细胞、nk细胞、nk t细胞、成纤维细胞、癌症相关成纤维细胞、内皮细胞、脂肪细胞、外膜细胞、内皮、脉管系统、淋巴管、肿瘤相关脉管系统、间充质基质细胞、间充质干细胞和/或细胞外基质。
18、在各个实施方案中,粒子具有介于-100mv与-1mv之间的ζ电位。在各个实施方案中,粒子具有介于-80mv与-30mv之间的ζ电位。在一些实施方案中,粒子的ζ电位为约-100mv至约-40mv、约-75mv至约-40mv、约-70mv至约-30mv、约-60mv至约-35mv或约-50mv至约-40mv。在各个实施方案中,ζ电位为约-30mv、-35mv、-40mv、-45mv、-50mv、-55mv、-60mv、-65mv、-70mv、-75mv、-80mv、-85mv、-90mv、-95mv或-100mv,包括位于这些值之间的所有值和子范围。
19、在各个实施方案中,带负电荷的粒子的直径介于0.1μm至10μm之间。在各个实施方案中,粒子具有介于约0.2μm与约2μm之间;约0.3μm至约5μm之间;约0.5μm至约3μm之间;或约0.5μm至约1μm之间的平均直径。在一些实施方案中,粒子具有约100至1500nm、约200至2000nm、约100至10000nm、约300至1000nm、约400至800nm或约200至700nm的直径。在各个实施方案中,粒子具有约100nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1000nm、1100nm、1200nm、1300nm、1400nm、1500nm或2000nm的平均直径,包括位于这些值之间的所有值和子范围。在一些实施方案中,带负电荷的粒子的直径介于400nm至800nm之间。
20、在各个实施方案中,受试者患有选自由以下组成的组的癌症:脑癌、皮肤癌、眼癌、乳腺癌、前列腺癌、胰腺癌、肺癌、食管癌、头颈癌、宫颈癌、肝癌、结肠癌、结肠直肠癌、直肠癌、骨癌、子宫癌、卵巢癌、膀胱癌、胃癌、口腔癌、甲状腺癌、肾癌、睾丸癌、白血病、淋巴瘤以及间皮瘤。具体实施方式中公开了所述方法所涵盖的其他癌症。
21、在各个实施方案中,癌症治疗剂为选自由以下组成的组的化学治疗剂:生长抑制剂、dna复制抑制剂、激酶抑制剂、信号传导级联反应抑制剂、血管生成抑制剂、代谢抑制剂、氨基酸合成抑制剂、致癌蛋白的选择性抑制剂、转移抑制剂、抗凋亡因子抑制剂、凋亡诱导剂、核苷信号传导抑制剂、酶抑制剂以及dna损伤剂。
22、在各个实施方案中,癌症治疗剂包含选自由以下组成的组的一种或多种生物剂:细胞因子、血管生成抑制剂、酶、免疫检查点调节剂以及单克隆抗体。
23、在各个实施方案中,细胞因子选自由以下组成的组:转化生长因子、肿瘤坏死因子、干扰素以及白介素。例示性细胞因子包括但不限于ifn-α、ifn-β、ifn-γ、il-1、il-2、il-4、il-5、il-6、il-7、il-10、il-11、il-12、il-13、il-15、il-17、il-18、il-21、转化生长因子β超家族的成员(包括tgf-β1、tgf-β2以及tgf-β3)、肿瘤坏死因子α、粒细胞集落刺激因子(g-csf)以及粒细胞巨噬细胞集落刺激因子(gm-csf)。
24、在各个实施方案中,单克隆抗体为单特异性、双特异性、三特异性或双特异性t细胞接合(bite)抗体。
25、在各个实施方案中,单克隆抗体为诱导抗肿瘤免疫反应的免疫细胞共刺激分子激动剂。例示性共刺激分子包括但不限于icos(可诱导t细胞共刺激剂)(cd278)、ox40(cd134)、41bb、gitr(糖皮质素诱导肿瘤坏死因子受体)、cd40以及cd27。
26、在各个实施方案中,免疫检查点调节剂靶向程序化细胞死亡蛋白1(pd-1)、程序化细胞死亡蛋白配体-1(pd-l1)、细胞毒性t-淋巴细胞相关蛋白4(ctla-4)、t细胞免疫球蛋白和含粘蛋白结构域-3(tim-3)、淋巴细胞活化基因3(lag-3)和/或tigit(具有ig和itim结构域的t细胞免疫受体)。在各个实施方案中,免疫检查点调节剂为选自由以下组成的组的抗体:伊匹单抗(ipilimumab)、曲美木单抗(tremelimumab)、派姆单抗(pembrolizumab)、纳武单抗(nivolumab)、阿特珠单抗(atezolizumab)、阿维单抗(avelumab)、赛米单抗(cemiplimab)以及德瓦鲁单抗(durvalumab)。
27、在各个实施方案中,可用于所述方法中的单克隆抗体选自包含以下的组:阿仑单抗(alemtuzumab)、贝伐单抗(bevacizumab)、本妥昔单抗(brentuximab)、西妥昔单抗(cetuximab)、地诺单抗(denosumab)、伊莫单抗(ibritumomab)、曲妥珠单抗(trastuzumab)、帕尼单抗(panitumumab)、帕妥珠单抗(pertuzumab)以及利妥昔单抗(rituximab)。在各个实施方案中,可用于所述方法中的单克隆抗体靶向受体酪氨酸激酶、egfr、vegf、vegfr、pdgf、pdgfr、tgf-β、tgf-β-lap、sirp-α、cd47、cd39、cd73以及成纤维细胞活化蛋白(fap)。
28、在各个实施方案中,癌症治疗剂包含酶。在各个实施方案中,癌症治疗剂包含靶向t细胞、b细胞、apc、巨噬细胞、树突细胞、单核细胞、mdsc、tam、嗜中性粒细胞、其他单核细胞源性细胞、肿瘤相关基质、癌症干细胞、间充质干细胞、细胞外基质以及氨基酸的酶。在各个实施方案中,癌症治疗剂包含选自包含以下的组的酶:天冬酰胺酶、犬尿氨酸酶(kynurininase)、l-精氨酸脱亚氨酶、l-甲硫氨酸-γ-裂解酶、一种或多种氨基酸降解酶以及一种或多种核苷降解酶。
29、在各个实施方案中,癌症治疗剂包含选自由以下组成的组的一种或多种基于细胞的疗法:过继性细胞转移、肿瘤浸润性白细胞疗法、嵌合抗原受体t细胞疗法(car-t)、nk细胞疗法以及干细胞疗法。
30、在各个实施方案中,基于细胞的疗法为自体患者源性细胞的过继转移。在各个实施方案中,基于细胞的疗法为异体供体源性细胞的过继转移。
31、在各个实施方案中,基于细胞的疗法为并非患者特有并且便于长期储存的通用供体源性或诱导多能干细胞源性细胞的转移。此类疗法也称为‘现成’疗法。
32、在各个实施方案中,癌症治疗剂为激素疗法。在各个实施方案中,癌症治疗剂包含一种或多种抗体-药物缀合物。在各个实施方案中,癌症治疗剂包含一种或多种癌症疫苗。在各个实施方案中,癌症疫苗为蛋白质、多肽、核酸疫苗和/或树突细胞疫苗。
33、在各个实施方案中,癌症治疗剂为选自包含以下的组的免疫疗法:溶瘤病毒、细菌、溶瘤细菌或其他细菌组合物、卡介苗(bacillus calmette-guerin,bcg)、微生物组调节剂和/或钟样受体(toll-like receptor,tlr)激动剂。在各个实施方案中,tlr激动剂为tlr3、tlr4、tlr5、tlr7、tlr8、tlr9、tlr10、tlr11、tlr12和/或tlr13激动剂。在各个实施方案中,tlr激动剂源自于病毒、细菌和/或为合成制备的。在各个实施方案中,免疫疗法为sting路径调节剂。
34、在各个实施方案中,癌症治疗剂包含病毒或细菌载体。在各个实施方案中,病毒载体选自包含以下的组:腺病毒、腺相关病毒(aav)、单纯疱疹病毒、慢病毒、逆转录病毒、α病毒、黄病毒、棒状病毒、麻疹病毒、新城疫病毒(newcastledisease virus)、痘病毒、痘苗病毒、改良安卡拉病毒(modified ankara virus)、水疱性口炎病毒、小核糖核酸病毒、烟草花叶病毒、马铃薯x病毒、豇豆花叶病毒或黄瓜花叶病毒。在各个实施方案中,病毒为溶瘤病毒。在各个实施方案中,病毒为嵌合病毒、合成病毒、花叶病毒或假型病毒。
35、具体实施方式中阐述了预期用于所述方法中的其他癌症治疗剂。
36、在各个实施方案中,每周两次、每周一次、每两周一次、每三周一次、每4周一次、每两个月一次、每三个月一次、每6个月一次或每年一次地施用粒子和/或癌症治疗剂。
37、在各个实施方案中,静脉内、经口、经鼻、肌肉内、经眼、经皮或皮下施用粒子和/或癌症治疗剂。
38、在各个实施方案中,受试者为哺乳动物。在各个实施方案中,受试者为人。
39、在各个实施方案中,所述施用改善癌症或增生性病症的一种或多种症状。在各个实施方案中,所述一种或多种症状选自由以下组成的组:受试者中的肿瘤尺寸或肿瘤负荷、肿瘤转移以及肿瘤中或肿瘤微环境中炎性细胞的水平。在各个实施方案中,所述施用使肿瘤尺寸或肿瘤负荷减小10%、20%、30%或更多。在各个实施方案中,所述施用改变肿瘤处的单核细胞、巨噬细胞、粒细胞、树突细胞和/或嗜中性粒细胞。
40、在各个实施方案中,将粒子配制在包含药学上可接受的载体、稀释剂或赋形剂的组合物中。在各个实施方案中,将癌症治疗剂配制在包含药学上可接受的载体、稀释剂或赋形剂的组合物中。在各个实施方案中,可将粒子和癌症治疗剂配制在同一组合物中或单独组合物中。
41、还涵盖一种包含本公开的任何前述粒子或癌症治疗剂组合物的组合物,或其用于制备用于治疗本文所描述的与炎症相关的病症以及癌症和/或增生性疾病中的任一者的药剂的用途。
42、本技术进一步涉及以下实施方案:
43、1.一种治疗受试者的癌症或增生性疾病的方法,所述方法包括向所述受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂。
44、2.如实施方案1所述的方法,其中所述施用改变肿瘤位点处的髓源性抑制细胞(mdsc)、肿瘤相关巨噬细胞(tam)、嗜中性粒细胞和/或单核细胞。
45、3.如实施方案1或实施方案2所述的方法,其中所述施用使所述受试者中的肿瘤尺寸减小和/或使肿瘤生长减少。
46、4.如实施方案1至3中任一项所述的方法,其中所述施用调控抗肿瘤免疫反应。
47、5.如实施方案1至4中任一项所述的方法,其中所述施用改变癌症干细胞和/或间充质干细胞。
48、6.如实施方案1至5中任一项所述的方法,其中所述施用改变肿瘤相关基质。
49、7.如实施方案1至6中任一项所述的方法,其中所述施用改变成纤维细胞、脂肪细胞、内皮细胞、间充质基质细胞和/或所述肿瘤相关基质中的ecm。
50、8.如前述实施方案中任一项所述的方法,其中所述带负电荷的粒子为聚乙醇酸聚合物(pga)、聚乳酸(pla)、聚苯乙烯粒子或聚(乳酸-共-乙醇酸)(plga)粒子、金刚石粒子,或铁、锌、镉、金或银粒子。
51、9.如前述实施方案中任一项所述的方法,其中所述带负电荷的粒子为聚(乳酸-共-乙醇酸)(plga)粒子。
52、10.如实施方案8或9所述的方法,其中所述粒子包含约50:50、约80:20至约100:0的聚乳酸:聚乙醇酸或约50:50、约80:20至约100:0的聚乙醇酸:聚乳酸。
53、11.如前述实施方案中任一项所述的方法,其中所述粒子包含50:50的聚乳酸:聚乙醇酸。
54、12.如前述实施方案中任一项所述的方法,其中所述粒子为羧化的。
55、13.如前述实施方案中任一项所述的方法,其中所述粒子具有介于-100mv与-1mv之间的ζ电位。
56、14.如前述实施方案中任一项所述的方法,其中所述粒子具有介于-80mv与-30mv之间的ζ电位。
57、15.如前述实施方案中任一项所述的方法,其中所述带负电荷的粒子的直径介于0.1μm至10μm之间。
58、16.如前述实施方案中任一项所述的方法,其中所述带负电荷的粒子的直径介于400nm至800nm之间。
59、17.如前述实施方案中任一项所述的方法,其中所述受试者患有选自由以下组成的组的癌症:脑癌、皮肤癌、眼癌、乳腺癌、胰腺癌、前列腺癌、肺癌、食管癌、头颈癌、宫颈癌、肝癌、结肠癌、结肠直肠癌、直肠癌、骨癌、子宫癌、卵巢癌、膀胱癌、胃癌、口腔癌、甲状腺癌、肾癌、睾丸癌、白血病、淋巴瘤以及间皮瘤。
60、18.如前述实施方案中任一项所述的方法,其中所述癌症治疗剂为选自由以下组成的组的化学治疗剂:生长抑制剂、dna复制抑制剂、激酶抑制剂、信号传导级联反应抑制剂、血管生成抑制剂、代谢抑制剂、氨基酸合成抑制剂、致癌蛋白的选择性抑制剂、转移抑制剂、抗凋亡因子抑制剂、凋亡诱导剂、酶抑制剂、核苷信号传导抑制剂以及dna损伤剂。
61、19.如实施方案1至17中任一项所述的方法,其中所述癌症治疗剂包含选自由以下组成的组的一种或多种生物剂:细胞因子、酶、血管生成抑制剂、免疫检查点调节剂以及单克隆抗体。
62、20.如实施方案19所述的方法,其中所述细胞因子选自由以下组成的组:转化生长因子、肿瘤坏死因子、干扰素以及白介素。
63、21.如实施方案19所述的方法,其中所述免疫检查点调节剂靶向程序化细胞死亡蛋白1(pd1)、程序化细胞死亡蛋白配体-1(pd-l1)、细胞毒性t-淋巴细胞相关蛋白4(ctla-4)、t细胞免疫球蛋白和含粘蛋白结构域3(tim-3)、淋巴细胞活化基因-3(lag-3)和/或tigit(具有ig和itim结构域的t细胞免疫受体)。
64、22.如实施方案21所述的方法,其中所述免疫检查点调节剂为选自由以下组成的组的抗体:伊匹单抗、曲美木单抗、派姆单抗、纳武单抗、阿特珠单抗、阿维单抗、赛米单抗以及德瓦鲁单抗。
65、23.如实施方案19所述的方法,其中所述单克隆抗体为单特异性、双特异性、三特异性或双特异性t细胞衔接器(bite)。
66、24.如实施方案19所述的方法,其中所述单克隆抗体包含阿仑单抗、贝伐单抗、本妥昔单抗、西妥昔单抗、地诺单抗、伊莫单抗、曲妥珠单抗、帕尼单抗、帕妥珠单抗以及利妥昔单抗。
67、25.如实施方案19所述的方法,其中所述单克隆抗体靶向受体酪氨酸激酶、egfr、vegf、vegfr、pdgf、pdgfr、tgf-β、tgf-β-lap、sirp-α、cd47、cd39、cd73和/或成纤维细胞活化蛋白(fap)。
68、26.如实施方案1至17中任一项所述的方法,其中所述癌症治疗剂包含选自由以下组成的组的一种或多种基于细胞的疗法:过继性细胞转移、肿瘤浸润性白细胞疗法、嵌合抗原受体t细胞疗法(car-t)、nk细胞疗法以及干细胞疗法。
69、27.如实施方案1至17中任一项所述的方法,其中所述癌症治疗剂为激素疗法。
70、28.如实施方案1至17中任一项所述的方法,其中所述癌症治疗剂包含一种或多种抗体-药物缀合物。
71、29.如实施方案1至17中任一项所述的方法,其中所述癌症治疗剂包含一种或多种癌症疫苗。
72、30.如实施方案1至17中任一项所述的方法,其中所述癌症治疗剂为包含以下的免疫疗法:溶瘤病毒、溶瘤细菌或其他细菌组合物、卡介苗(bcg)、微生物组调节剂、sting路径调节剂和/或钟样受体(tlr)激动剂。
73、31.如前述实施方案中任一项所述的方法,其中每周两次、每周一次、每两周一次、每三周一次、每4周一次、每两个月一次、每三个月一次、每6个月一次或每年一次施用所述粒子和或所述癌症治疗剂。
74、32.如前述实施方案中任一项所述的方法,其中静脉内、经口、经鼻、肌肉内、经眼、经皮或皮下施用所述粒子。
75、33.如前述实施方案中任一项所述的方法,其中所述受试者为人。
76、34.如前述实施方案中任一项所述的方法,其中所述施用改善所述癌症或所述增生性病症的一种或多种症状。
77、35.如实施方案34所述的方法,其中所述一种或多种症状选自由以下组成的组:所述受试者中的肿瘤尺寸或肿瘤负荷、肿瘤转移以及所述肿瘤中的炎性细胞的水平。
78、36.如实施方案35所述的方法,其中所述施用使所述肿瘤尺寸或所述肿瘤负荷减小10%、20%、30%或更多。
79、37.如实施方案34所述的方法,其中所述施用使所述肿瘤处的单核细胞、巨噬细胞、粒细胞和/或嗜中性粒细胞的数目减少。
80、38.如前述实施方案中任一项所述的方法,其中将所述粒子配制在包含药学上可接受的载体、稀释剂或赋形剂的组合物中。
81、39.如前述实施方案中任一项所述的方法,其中将所述癌症治疗剂配制在包含药学上可接受的载体、稀释剂或赋形剂的组合物中。
82、应了解,本文所描述的各个特征或实施方案或组合为本发明的方面中的任一者的非限制性、说明性实例,并且因而意味着可与本文所描述的任何其他特征或实施方案或组合加以组合。举例来说,在用诸如“一个实施方案”、“一些实施方案”、“其他实施方案”、“特定例示性实施方案”和/或“另一实施方案”等措辞描述特征的情况下,这些类型的实施方案中的每一者为特征的非限制性实例,所述特征旨在与本文所描述的任何其他特征或特征组合加以组合,而不必列出每种可能的组合。此类特征或特征组合适用于本公开的方面中的任一者。在公开属于范围内的值的实例的情况下,将这些实例中的任一者考虑为可能的范围终点,此类终点之间的任何和所有数值均被涵盖,并且设想上终点和下终点的任何和所有组合。
- 还没有人留言评论。精彩留言会获得点赞!