PD-1激动剂抗体及其用途的制作方法
本发明在医学领域中。更具体地,本发明涉及针对人程序性死亡1(pd-1;也称为cd279)的激动性抗体,包含此类抗人pd-1激动性抗体的组合物以及使用此类抗人pd-1激动性抗体用于治疗自身免疫性病症或移植排斥的方法。
背景技术:
1、免疫检查点途径调节自身免疫性应答和抗癌免疫应答两者(isakov, n., j. autoimmune disorders 2016; 2(2):17)。在自身免疫性疾病疗法中,期望促进(即激动)免疫-抑制途径的作用,使得抑制免疫应答。相反,在癌症疗法中,期望抑制(即拮抗)免疫-抑制途径的作用,使得将免疫应答去抑制或刺激。
2、pd-1是i型细胞膜蛋白。pd-1属于含有细胞外igv结构域、随后为跨膜和细胞内结构域的扩展的cd28/ctla-4家族。pd-1途径的活化导致免疫细胞活化的抑制,诸如降低的细胞增殖,降低的细胞存活和炎性细胞因子(例如,ifnγ、tnfα和il-2)的抑制。pd-1在最近活化的免疫细胞(诸如t细胞、b细胞、nkt细胞、单核细胞和树突状细胞)上表达;并且其表达受到严格调节。pd-1介导的信号传导在调节人免疫应答中的重要性通过用拮抗剂pd-1抗体治疗肿瘤患者的成功来证明。用pd-1拮抗剂抗体治疗的癌症患者倾向于具有不同的自身免疫性表现作为该治疗的副作用(cappelli, l.c., 等人, 2017; hoffman, l., 等人,2016)。此外,自身免疫性疾病活动和pd-1途径之间存在其他已知的相关性。例如,爆发的sle患者倾向于具有低pd-l1表达(mozaffarian, n., 等人, 2008)和针对pd-1的自身抗体(shi, h., 等人, 2017)。
3、因此,增加pd-1介导的信号传导构成一种潜在的方法来管控自身免疫性病症,与当前的免疫调节性疗法相比,其可能导致深刻的疾病改变和应答的持久性以及关键的安全性益处。一般来说,这些当前的疗法广泛下调机体的免疫系统(例如,皮质类固醇和环磷酰胺)。然而,pd-1主要在活化的免疫细胞上表达。因此,抗pd-1抗体具有选择性靶向治疗时期间活化的细胞、使免疫细胞库的剩余部分完整的潜能。
4、该领域已经努力提供pd-1激动性抗体(sharpe, a. 和pauken, e., nature reviews immunology (2017))。该困难至少部分地被认为是在体外或体内在生理环境中实现pd-1激动作用所需的复杂的细胞相互作用的结果。因此,当评价pd-1激动剂抗体活性时,用于鉴定治疗性抗体的测定或模型的背景清楚地是重要的。
5、美国专利申请公开us20170088618公开了抗人pd-1抗体,其在一些实施方案中,并且在某些体外测定中,表现为就pd-1细胞外结构域而言具有缔合和解离的速率的激动剂,导致kd值在19-22 nm之间(如通过使用biacore®t200的表面等离振子共振(spr)所测定)。
6、因此,需要替代的抗人pd-1抗体,其1)以对于最佳的激动剂活性期望的缔合和解离速率结合人pd-1,2)在免疫学相关的背景下激动人pd-1以实现体内效力,3)作为用于治疗和/或预防自身免疫性病症或预防移植排斥的单一疗法,展示足够的功效,4)作为与用于治疗和/或预防自身免疫性病症或预防移植排斥的其他治疗剂的组合疗法的一部分,展示期望的活性,和/或5)当在用另一种抗人pd-1激动剂抗体治疗自身免疫性病症期间由于至少一种不良事件和/或无效(尤其是抗药物抗体(ada)介导的效力降低)而暂停疗法时,为药物转换提供了有效的替代物。
技术实现思路
1、因此,本发明提供了新型的人源化的抗人pd-1激动剂igg1抗体。由于各种原因,本发明的抗体特别优于现有技术的抗pd-1抗体,所述原因包括但不限于以下:1)它们以期望的缔合和解离速率结合人pd-1(以及食蟹猴pd-1),2)它们在较低剂量或较不频繁给药下可能治疗上有效,3)它们在体外抑制原代人t细胞增殖,4)它们调节人pd-1细胞表面表达,5)它们在体外nfat报告子细胞测定中抑制t细胞受体信号传导活性,6)它们具有低治疗性蛋白免疫原性(即,抗药物抗体(ada))潜能,7)它们在人源化gvhd模型中降低疾病活性,和/或8)在狼疮性肾炎体内模型中,它们抑制免疫细胞活化:
2、a)没有显著和/或可检测的补体-依赖性细胞毒性,
3、b)不与人pd-l1/2竞争结合人pd-1,
4、c)在体外测定中不诱导显著和/或可检测的细胞因子释放。
5、此外,本发明的示例性抗人pd-1激动剂igg1抗体还表现出体内稳定性、物理和化学稳定性,包括但不限于热稳定性、溶解性、低自缔合和药代动力学特征,其对于开发和/或用于治疗自身免疫性病症和/或移植排斥(即移植物抗宿主病)是可接受的。另外,本文公开的编码本发明的示例性抗人pd-1激动剂igg1抗体的多核苷酸序列经工程改造以使用优选的密码子来显著提高所述抗体在优选的哺乳动物细胞系表达系统、诸如cho中的表达。
6、本发明通过提供组合物和方法而提供优于现有技术的进步,所述组合物和方法可用于通过使用显著工程改造的抗人pd-1激动剂igg1抗体的免疫检查点刺激来预防、下调或改善自身免疫和/或免疫耐受相关的病症。本发明的抗人pd-1激动剂igg1抗体能够改善或恢复免疫病理学,优选地,通过抑制免疫应答的适应性组,废除抗原特异性免疫过程,且由此直接解决潜在的疾病病理学。临床上使用此类抗体可以证明导致所治疗疾病的长期持久性或缓解。
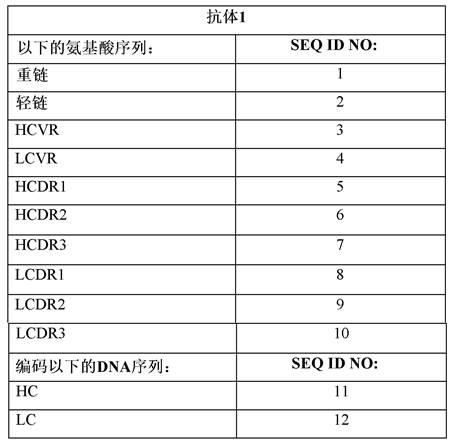
7、本公开提供了抗人pd-1抗体,其包含:1)重链可变区(hcvr),其包含具有seq idno:5的氨基酸序列的hcdr1,具有seq id no:6的氨基酸序列的hcdr2,具有seq id no:7的氨基酸序列的hcdr3;和2)轻链可变区(lcvr),其包含具有seq id no:8的氨基酸序列的lcdr1,具有seq id no:9的氨基酸序列的lcdr2,和具有seq id no:10的氨基酸序列的lcdr3,其中所述抗体是igg同种型亚类1 (igg1)。
8、在一些实施方案中,本公开提供了抗人pd-1抗体,其包含:1)具有seq id no:3的氨基酸序列的hcvr;和2)具有seq id no:4的氨基酸序列的lcvr,其中所述抗体是igg1。
9、在一些实施方案中,本公开提供了抗人pd-1抗体,其包含:1)具有seq id no:1的氨基酸序列的重链;和2)具有seq id no:2的氨基酸序列的轻链。
10、在一些实施方案中,本公开提供了抗人pd-1抗体,其由以下组成:两条具有seq idno:1的氨基酸序列的重链,和两条具有seq id no:2的氨基酸序列的轻链。
11、本公开还提供了能够表达抗人pd-1抗体的哺乳动物细胞,所述抗人pd-1抗体包含:1) hcvr,其包含具有seq id no:5的氨基酸序列的hcdr1,具有seq id no:6的氨基酸序列的hcdr2,具有seq id no:7的氨基酸序列的hcdr3;和2) lcvr,其包含具有seq id no:8的氨基酸序列的lcdr1,具有seq id no:9的氨基酸序列的lcdr2,和具有seq id no:10的氨基酸序列的lcdr3,其中所述抗体是igg1。
12、在一些实施方案中,本公开提供了能够表达抗人pd-1抗体的哺乳动物细胞,所述抗人pd-1抗体包含:1)具有seq id no:3的氨基酸序列的hcvr;和2)具有seq id no:4的氨基酸序列的lcvr,其中所述抗体是igg1。
13、在一些实施方案中,本公开提供了能够表达抗人pd-1抗体的哺乳动物细胞,所述抗人pd-1抗体包含:1)具有seq id no:1的氨基酸序列的重链;和2)具有seq id no:2的氨基酸序列的轻链。在一些实施方案中,本公开提供了抗人pd-1抗体由以下组成:两条具有seq id no:1的氨基酸序列的重链,和两条具有seq id no:2的氨基酸序列的轻链。
14、本公开还提供了用于产生抗人pd-1抗体的方法,其包括:a)培养能够表达所述抗体的哺乳动物细胞,其中所述抗体包含:1) hcvr,其包含具有seq id no:5的氨基酸序列的hcdr1,具有seqid no:6的氨基酸序列的hcdr2,具有seq id no:7的氨基酸序列的hcdr3;和2)lcvr,其包含具有seq id no:8的氨基酸序列的lcdr1,具有seq id no:9的氨基酸序列的lcdr2,和具有seq id no:10的氨基酸序列的lcdr3,其中所述抗体是igg1;和b)回收所述抗体。
15、在一些实施方案中,本公开提供了用于产生抗人pd-1抗体的方法,其包括:a)培养能够表达所述抗体的哺乳动物细胞,其中所述抗体包含:1)具有seq id no:3的氨基酸序列的hcvr;和2)具有seq id no:4的氨基酸序列的lcvr,其中所述抗体是igg1;和b)回收所述抗体。
16、在一些实施方案中,本公开提供了用于产生抗人pd-1抗体的方法,其包括:a)培养能够表达所述抗体的哺乳动物细胞,其中所述抗体包含:1)具有seq id no:1的氨基酸序列的重链;和2)具有seqid no:2的氨基酸序列的轻链;和b)回收所述抗体。
17、在一些实施方案中,本公开提供了用于产生抗人pd-1激动剂抗体的方法,其包括:a)培养能够表达所述抗体的哺乳动物细胞,其中所述抗体由以下组成:两条具有seq idno:1的氨基酸序列的重链,和两条具有seq id no:2的氨基酸序列的轻链;和b)回收所述抗体。
18、本公开还提供了通过前述方法产生的抗人pd-1抗体。
19、本公开还提供了药物组合物,其包含通过前述方法产生的抗人pd-1抗体和可接受的载体、稀释剂或赋形剂。
20、本公开还提供了dna分子,其包含具有seq id no:11、seq id no:12或seq id no:11和12的序列的多核苷酸。本公开还提供了包含dna分子的哺乳动物细胞,所述dna分子包含具有seq id no:11、seq id no:12或seqid no:11和12的序列的多核苷酸。
21、本公开提供了药物组合物,其包含:1)抗人pd-1抗体,其包含:a) hcvr,其包含具有seq id no:5的氨基酸序列的hcdr1,具有seq id no:6的氨基酸序列的hcdr2,具有seqid no:7的氨基酸序列的hcdr3;和b) lcvr,其包含具有seq id no:8的氨基酸序列的lcdr1,具有seq id no:9的氨基酸序列的lcdr2,和具有seq id no:10的氨基酸序列的lcdr3,其中所述抗体是igg1;和2)可接受的载体、稀释剂或赋形剂。
22、在一些实施方案中,本公开提供了药物组合物,其包含:1)抗人pd-1抗体,其包含:a)具有seq id no:3的氨基酸序列的hcvr;和b)具有seq id no:4的氨基酸序列的lcvr,其中所述抗体是igg1;和2)可接受的载体、稀释剂或赋形剂。
23、本公开提供了药物组合物,其包含:1)抗人pd-1抗体,其包含:a)具有seq id no:1的氨基酸序列的重链;和b)具有seq id no:2的氨基酸序列的轻链;和2)可接受的载体、稀释剂或赋形剂。在一些实施方案中,前述药物组合物的抗人pd-1抗体由以下组成:两条具有seq id no:1的氨基酸序列的重链,和两条具有seq id no:2的氨基酸序列的轻链。
24、如本文所用,“pd-1”是指程序性细胞死亡1,也称为程序性死亡1 (pd-1; cd279),属于含有细胞外igv结构域、随后为跨膜和细胞内结构域的扩展的cd28/ctla-4家族的i型细胞膜蛋白。
25、如本文所用,“hpd-1”或“人pd-1”是指野生型人pd-1,优选地,具有seq id no:13中所示的氨基酸序列的野生型人pd-1 (即,ncbi参考序列np_005009.2)。
26、术语“食蟹猴(cyno)”、“食蟹猴(cynomolgus)”或“食蟹猴(cynomolgus monkey)”在本文可互换使用。当关于pd-1多肽使用时,意欲该术语是指野生型食蟹猴pd-1,和优选地,具有seq id no:15中所示的氨基酸序列的野生型食蟹猴pd-1。
27、pd-1多肽“细胞外结构域”或“ ecd”是指基本上不含跨膜和细胞质结构域的pd-1多肽的形式。优选地,pd-1 ecd具有小于1%的跨膜和细胞质结构域,更优选地,pd-1 ecd具有小于0.5%的此类结构域。甚至更优选地,人pd-1 ecd多肽如seq id no:14中所示,且食蟹猴pd-1 ecd多肽如seqid no:16中所示。pd-1多肽ecd可以使用本领域中已知的方法制备。或者,人pd-1多肽ecd可以从各种供应商、诸如sino biological (beijing, china; 参考号10377-h08)和r&d systems (minneapolis, mn, usa; 目录号8986-pd)商业购买。食蟹猴pd-1多肽ecd可以从r&d systems (minneapolis, mn, usa; 目录号8509-pd)商业购买。
28、如本文所用,“抗人pd-1激动剂抗体”是指这样的抗体,其结合人pd-1,并且当在体内施用时,导致至少一种显著降低的自身免疫活性,诸如抗双链dna (ds-dna)滴度的降低,疾病评分的降低或炎性细胞因子的降低。
29、如本文所用,“抗体1”是指人pd-1结合抗体,其包含:1)具有seq id no:5的hcdr1氨基酸序列、seq id no:6的hcdr2氨基酸序列、seq id no:7的hcdr3氨基酸序列的hcvr;和2)具有seq id no:8的lcdr1氨基酸序列、seq id no:9的lcdr2氨基酸序列、seq id no:10的lcdr3氨基酸序列的lcvr;seq id no:3的hcvr氨基酸序列、seq id no:4的lcvr氨基酸序列;seq id no:1的hc氨基酸序列和seq id no:2的lc氨基酸序列。
30、如本文所用的术语“抗体”是指工程改造的、非天然存在的多肽复合物,其具有两条重链(hc)和两条轻链(lc),使得所述重链和所述轻链通过二硫键互连,其中所述抗体是igg同种型抗体。如本文关于本发明的抗体所用,术语“抗体”是指作为igg同种型亚类1(即igg1)的抗体,并且具有经由链内和链间二硫键交联的“重”链和“轻”链。轻链各自与重链形成二硫键,并且两条重链在彼此之间形成两个二硫键。各重链由n-末端hcvr和重链恒定区("hccr")构成。各轻链由n-末端lcvr和轻链恒定区("lccr")构成。当在某些生物系统中表达时,具有天然人fc序列的抗体在fc区中被糖基化。通常,糖基化发生在抗体的fc区中的高度保守的n-糖基化位点处。n-聚糖通常与天冬酰胺连接。抗体同样可在其他位置处被糖基化。
31、优选地,本发明的抗体含有作为人igg1亚型的fc部分。众所周知,人igg1结合fc-γ受体家族(fcγr)以及c1q。与这些受体的相互作用可诱导抗体依赖性细胞的细胞毒性(adcc)和补体依赖性细胞毒性(cdc)。
32、重链的恒定区含有ch1、ch2和ch3结构域。ch1在hcvr之后;ch1和hcvr形成fab的重链部分。ch2在铰链区之后,并且在ch3之前。ch3在ch2之后,并且在重链的羧基-末端处。轻链的恒定区含有一个结构域cl。cl在lcvr之后;cl和lcvr形成fab的轻链部分。优选地,本发明的抗人pd-1激动剂抗体的cl区域是人κ亚型的(例如,seq id no:18)。
33、本发明的dna分子是包含非天然存在的多核苷酸序列的dna分子,所述多核苷酸序列编码具有本发明的抗体中的至少一个多肽(例如,重链、轻链、可变重链和可变轻链)的氨基酸序列的多肽。
34、本发明的抗体的hcvr和lcvr区可进一步细分成间插有更保守区(称为框架区("fr"))的超变区(称为互补决定区("cdr"))。各hcvr和lcvr由三个cdr和四个fr构成,其从氨基-末端至羧基-末端以下列顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。在本文中,重链的三个cdr称为"hcdr1、hcdr2和hcdr3"且轻链的三个cdr称为"lcdr1、lcdr2和lcdr3"。cdr含有大多数与抗原形成特异性相互作用的残基。kabat cdr定义(kabat等人, “sequencesof proteins of immunological interest,”national institutes of health,bethesda, md. (1991))基于抗体序列可变性。chothia cdr定义(chothia等人,“canonical structures for the hypervariable regions of immunoglobulins”,journal of molecular biology, 196, 901-917 (1987);al-lazikani等人, “standardconformations for the canonical structures ofimmunoglobulins”, journal ofmolecular biology, 273, 927-948 (1997))基于抗体的三维结构和cdr环的拓扑学。除hcdr1和hcdr2外,chothia cdr定义与kabatcdr定义是相同的。north cdr定义(north等人,“a new clustering of antibody cdr loop conformations”,journal of molecularbiology, 406, 228-256 (2011))基于用大量晶体结构的亲和力传播聚类。为了本发明的目的,将氨基酸分配至本发明的抗体的lcvr和hcvr区域内的cdr结构域是基于众所周知的kabat编号惯例(kabat, 等人, ann. ny acad. sci. 190:382-93 (1971);kabat等人,sequences of proteins of immunological interest, 第五版, u.s. department ofhealth and humanservices, nih publication no. 91-3242 (1991)),以及north编号惯例(north等人, a new clustering of antibody cdr loop conformations, journal ofmolecular biology, 406:228-256(2011))。在本发明的抗体的轻链cdr的情况下,使用north cdr定义。在重链中,hcdr1和hcdr3两者均使用north定义。hcdr2使用north和kabat定义的杂合体。north定义用于鉴定起始的n-末端位点,而kabat用于定义最后的位置。
35、可通过使编码hcvr的dna可操作连接至编码重链恒定区的另一dna分子,来将编码hcvr区的分离dna转化成全长重链基因。人以及其他哺乳动物重链恒定区基因的序列是本领域中已知的。可例如通过标准pcr扩增获得涵盖这些区域的dna片段。
36、可通过使编码lcvr的dna可操作连接至编码轻链恒定区的另一dna分子,来将编码lcvr区的分离dna转化成全长轻链基因。人以及其他哺乳动物轻链恒定区基因的序列是本领域中已知的。可通过标准pcr扩增来获得涵盖这些区域的dna片段。轻链恒定区可以是κ或λ恒定区。优选地,对于本发明的抗体而言,轻链恒定区为κ恒定区。
37、可以在序列已可操作连接至表达控制序列之后在宿主细胞中表达本发明的多核苷酸。表达载体通常可在宿主生物体中作为附加体或作为宿主染色体dna的整合部分复制。通常,表达载体将含有选择标记(例如四环素、新霉素和二氢叶酸还原酶)以允许检测用期望dna序列转化的那些细胞。
38、本发明的抗体可容易在哺乳动物细胞(其非限制性实例包括cho、ns0、hek293或cos细胞)中产生。使用本领域中众所周知的技术培养宿主细胞。
39、可通过众所周知的方法将含有目标多核苷酸序列(例如,编码抗体的多肽的多核苷酸和表达控制序列)的载体转移至宿主细胞中,所述方法根据细胞宿主的类型而变化。
40、可以采用蛋白纯化的各种方法来纯化蛋白,包括但不限于抗体,并且此类方法是本领域中已知的。
41、在本发明的其他实施方案中,以分离形式提供抗体或编码其的核酸。如本文所用,术语"分离的"是指不含或基本上不含细胞环境中发现的任何其他大分子物质的蛋白、肽或核酸。如本文所用的"基本上不含"意指目标蛋白、肽或核酸占存在的大分子物质的大于80%(以摩尔计)、优选地大于90%和更优选地大于95%。
42、本发明的抗体或包含其的药物组合物可通过肠胃外途径(其非限制性实例为皮下施用和静脉内施用)施用。本发明的抗体可以连同药学上可接受的载体、稀释剂或赋形剂以单个或多个剂量施用于患者。本发明的药物组合物可通过本领域中众所周知的方法制备(例如,remington:the science and practice of pharmacy, 第22版 (2012), a. loyd等人,pharmaceutical press)并且包含如本文所公开的抗体和一种或多种药学上可接受的载体、稀释剂或赋形剂。
43、如本文所用,术语“自身免疫性疾病”或“自身免疫性病症”在本文中可互换使用,并且是指由针对自身细胞和/或组织或移植的细胞和/或组织的不适当或不想要的免疫反应产生的不期望的病况。术语“自身免疫性疾病”或“自身免疫性病症”意在此类病况,无论它们是通过体液免疫应答还是细胞免疫应答介导。示例性自身免疫性疾病或病症包括但不限于移植物抗宿主病(gvhd)、实体器官移植排斥、血管炎、系统性红斑狼疮(sle)、1型糖尿病(t1dm)、多发性硬化症(ms)、巨细胞动脉炎(gca)、牛皮癣(pso)、牛皮癣关节炎(psa)、类风湿性关节炎(ra)、炎性肠病(ibd)、溃疡性结肠炎(uc)、强直性脊柱炎(as)、肖格伦氏综合征(sjs)、自身免疫性肝炎、硬皮病、乳糜泻、艾迪生氏病、桥本氏病、格雷夫斯氏病、萎缩性胃炎/恶性贫血、后天的性腺功能减退/不育、甲状旁腺功能低下、库姆斯阳性-溶血性贫血、慢性过敏性疾病(诸如哮喘、枯草热或过敏性鼻炎)、克罗恩氏病、男性或女性不育、白塞氏病、韦格纳氏肉芽肿病、心肌炎、肌炎、风湿性多肌痛(pmr)、自发性流产、白癜风、动脉粥样硬化、自身免疫性胰腺炎、大疱性类天疱疮、慢性病毒感染和重症肌无力。为了本公开的目的,优选的自身免疫性疾病是移植物抗宿主病(gvhd)、实体器官移植排斥、血管炎、系统性红斑狼疮(sle)、1型糖尿病(t1dm)、多发性硬化症(ms) 、巨细胞动脉炎(gca)、牛皮癣(pso)、牛皮癣关节炎(psa)、类风湿性关节炎(ra)、炎性肠病(ibd)、溃疡性结肠炎(uc)、强直性脊柱炎(as)、肖格伦氏综合征(sjs)、自身免疫性肝炎和硬皮病。
44、如本文所用,术语“约”暗示所述值或值范围的正负百分之十。例如:“约”12包括范围为10.8(包括端值)至13.2(包括端值)的值;约10 wt%涵盖包括9(包括端值)至11(包括端值) wt%之间的形式;等。
45、除非另有指示,否则如本文关于抗人pd-1激动剂igg1抗体对人pd-1 (seq id no:13)或人pd-1 ecd、优选如seq id no:14中所示的人pd-1 ecd的亲和力所用的“结合”意指约1 x10-7m、约1 x 10-8m、约1 x 10-9m、约5 x 10-9m、约1 x 10-10m的kd,如通过本领域中已知的方法和/或通过基本上如本文所述的方法(包括,但不限于,在25℃或37℃下使用表面等离振子共振(spr)生物传感器)所测定。更优选地,本发明的抗人pd-1激动剂igg1抗体结合人pd-1(即,seq id no:13)或人pd-1 ecd(例如,seq id no:14),其中kd在约1 x 10-8m和约5 x 10-10m之间,如通过本领域中已知的方法和/或通过基本上如本文所述的方法(包括通过在25℃或37℃下使用spr生物传感器)所测定。甚至更优选地,这种抗体结合对于人pd-1(即,seqid no:13)或人pd-1 ecd(例如,seq id no:14)的亲和力将为约5 x 10-8m至约5 x10-10m,如通过本领域中已知的方法和/或通过基本上如本文所述的方法(包括通过在25℃或37℃下使用spr生物传感器)所测定。甚至更优选地,这种抗体对于人pd-1 ecd(例如,seqid no:14)将分别具有约1.0 x 10-4至约1.0 x 10-3和约1.3 x 105至约2.0 x 105的kon和koff值(如通过在基本上如本文所述的biacore®8k上的spr所测定)。
46、在单克隆抗体的背景下,术语“人”、“人源化”和“完全人”是本领域普通技术人员众所周知的(weiner lj, j. immunother. 2006; 29: 1-9; mallbris l, 等人, j. clin. aesthet. dermatol. 2016; 9: 13-15)。
47、如本文所用,术语“适应性免疫”包括免疫应答的组,其与免疫应答的先天组相反,是抗原特异性的,并且在用相同抗原重新刺激后显示增强的次级抗原特异性免疫应答。
48、术语"治疗(treating)"(或"治疗(treat)"或"治疗(treatment)")是指减缓、中断、阻止、缓解、停止、减轻或逆转现有症状、病症、病况或疾病的进展或严重程度。
49、"有效量"意指本发明的抗人pd-1激动剂igg1抗体或包含这种抗体的药物组合物将引发研究者、医师或其他临床医师寻求的对组织、系统、动物、哺乳动物或人的生物或医学应答或期望治疗效果的量。抗体的有效量可根据因素而变化,所述因素诸如个体的疾病状态、年龄、性别和重量以及抗体在个体内引发期望应答的能力。有效量也是其中治疗有益效果胜过抗体的任何毒性或有害效果的量。这种益处包括以下中的任何一项或多项:增加的移植器官的免疫耐受;稳定的自身免疫性疾病或病症;或改善自身免疫性病症的体征或症状等。本领域技术人员可以通过使用已知技术并通过观察在类似情况下获得的结果来容易地确定有效量。在确定用于患者的有效量时,参加的诊断专家考虑许多因素,包括但不限于:患者的体型、年龄和总体健康;所涉及的特定疾病或病症;所述疾病或病症的程度或参与或严重程度;个体患者的应答;施用的特定化合物;施用模式;所施用制剂的生物利用度特征;选择的剂量方案;伴随用药的使用;和其他相关情况。
50、如本文所用,术语患者的“有效应答”或患者对治疗的“应答性”是指在施用本公开的抗体后赋予患者的临床或治疗益处。这种益处包括以下中的任何一项或多项:增加的移植器官的免疫耐受;稳定的自身免疫性疾病或病症;或改善自身免疫性病症的体征或症状等。
51、本文公开的方法的潜在优点是,在患有自身免疫性病症的患者中产生显著和/或延长的缓解的可能性,其具有可接受的安全性概况,包括可接受的耐受性、毒性和/或不良事件,使得患者总体受益于治疗方法。可以通过通常用于评估各种自身免疫性病症的治疗的各种终点来测量本公开的疗效,所述终点包括但不限于美国风湿病学会(acr) 20、acr50、acr70、牛皮癣面积和严重程度指数(pasi) 50、pasi75、pasi90、pasi100、系统性红斑狼疮疾病活动指数(sledai)。可以任选地采用确定本发明的任何特定疗法的效力的各种其他方法,包括例如免疫细胞活化标志物、炎症的量度、细胞周期依赖性生物标志物测量可视化和/或通过疼痛评价测量应答。
52、由于形成中和抗体或更快的药代动力学,对生物制剂形成抗药物抗体可以降低治疗的有效性。在一些罕见情况下,ada也可以与安全性问题相关。自身免疫性疾病是慢性的,需要长期治疗。因此,当治疗性生物药物(例如,治疗性抗体)停止工作时,经常需要替代治疗。为了克服随着时间的免疫原性的挑战,依次使用生物制剂,甚至是靶标相同靶标的生物制剂,例如tnf抑制剂,是自身免疫领域中广泛接受和利用的治疗实践(参见,例如,lloyd,s., 等人(2010) the effectiveness of anti-tnfα therapies when usedsequentially in rheumatoid arthritispatients: a systematic review and meta-analysis. rheumatology, 49:2313-21)。
53、本公开提供了抗人pd-1抗体,其包含:
54、1) hcvr,其包含具有seq id no:5的氨基酸序列的hcdr1,具有seq id no:6的氨基酸序列的hcdr2,具有seq id no:7的氨基酸序列的hcdr3;和
55、2) lcvr,其包含具有seq id no:8的氨基酸序列的lcdr1,具有seq id no:9的氨基酸序列的lcdr2,和具有seq id no:10的氨基酸序列的lcdr3,其中所述抗体是igg1。优选地,这种抗体结合人pd-1(即,seq id no:13)或人pd-1 ecd(例如,seqid no:14),其中kd为约1 x 10-7m,约1 x 10-8m,约1 x 10-9m,约5 x 10-9m,或约1 x 10-10m,如通过本领域中已知的方法和/或通过基本上如本文所述的方法(包括,但不限于,在25℃或37℃下使用表面等离振子共振(spr)生物传感器)所测定。优选地,这种抗体结合人pd-1(即,seq id no:13)或人pd-1 ecd(例如,seq id no:14),其中kd在约1 x 10-8m和约5 x 10-10m之间,如通过本领域中已知的方法和/或通过基本上如本文所述的方法(包括,但不限于,在25℃或37℃下使用表面等离振子共振(spr)生物传感器)所测定。更优选地,这种抗体结合人pd-1(即,seqidno:13)或人pd-1 ecd(例如,seq id no:14),其中kd在约5 x 10-8m和约5 x 10-10m之间,如通过本领域中已知的方法和/或通过基本上如本文所述的方法(包括,但不限于,在25℃或37℃下使用表面等离振子共振(spr)生物传感器)所测定。
56、在一些实施方案中,本公开提供了抗人pd-1抗体,其包含:
57、1)具有seq id no:3的氨基酸序列的hcvr;和
58、2)具有seq id no:4的氨基酸序列的lcvr,其中所述抗体是igg1。优选地,这种抗体结合人pd-1(即,seq id no:13)或人pd-1 ecd(例如,seqid no:14),其中kd为约1 x10-7m,约1 x 10-8m,约1 x 10-9m,约5 x 10-9m,或约1 x 10-10m,如通过本领域中已知的方法和/或通过基本上如本文所述的方法(包括,但不限于,在25℃或37℃下使用表面等离振子共振(spr)生物传感器)所测定。更优选地,这种抗体结合人pd-1(即,seq id no:13)或人pd-1 ecd(例如,seq id no:14),其中kd在约1 x 10-8m和约5 x 10-10m之间,如通过本领域中已知的方法和/或通过基本上如本文所述的方法(包括,但不限于,在25℃或37℃下使用表面等离振子共振(spr)生物传感器)所测定。甚至更优选地,这种抗体结合人pd-1(即,seqid no:13)或人pd-1 ecd(例如,seq id no:14),其中kd在约5 x 10-8m和约5 x 10-10m之间,如通过本领域中已知的方法和/或通过基本上如本文所述的方法(包括,但不限于,在25℃或37℃下使用表面等离振子共振(spr)生物传感器)所测定。
59、在一些实施方案中,本公开提供了抗人pd-1抗体,其包含:
60、1)具有seq id no:1的氨基酸序列的重链;和
61、2)具有seq id no:2的氨基酸序列的轻链。在一些实施方案中,本公开提供了抗人pd-1抗体,其由以下组成:两条具有seq id no:1的氨基酸序列的重链,和两条具有seq idno:2的氨基酸序列的轻链。优选地,这种抗体结合人pd-1(即,seqid no:13)或人pd-1 ecd(例如,seq id no:14),其中kd为约1 x10-7m,约1 x 10-8m,约1 x 10-9m,约5 x 10-9m,约1 x10-10m,如通过本领域中已知的方法和/或通过基本上如本文所述的方法(包括,但不限于,在25℃或37℃下使用表面等离振子共振(spr)生物传感器)所测定。更优选地,这种抗体结合人pd-1(即,seq id no:13)或人pd-1 ecd(例如,seq id no:14),其中kd在约1 x 10-8m和约5 x 10-10m之间,如通过本领域中已知的方法和/或通过基本上如本文所述的方法(包括,但不限于,在25℃或37℃下使用表面等离振子共振(spr)生物传感器)所测定。甚至更优选地,这种抗体结合人pd-1(即,seqid no:13)或人pd-1 ecd(例如,seq id no:14),其中kd在约5 x 10-8m和约5 x 10-10m之间,如通过本领域中已知的方法和/或通过基本上如本文所述的方法(包括,但不限于,在25℃或37℃下使用表面等离振子共振(spr)生物传感器)所测定。
62、本公开提供了能够表达抗人pd-1抗体的哺乳动物细胞,所述抗人pd-1抗体包含:具有seq id no:5的氨基酸序列的hcdr1,具有seq id no:6的氨基酸序列的hcdr2,具有seqid no:7的氨基酸序列的hcdr3,具有seq id no:8的氨基酸序列的lcdr1,具有seq id no:9的氨基酸序列的lcdr2,和具有seq id no:10的氨基酸序列的lcdr3,其中所述抗体是igg1。
63、在一些实施方案中,本公开提供了能够表达抗人pd-1抗体的哺乳动物细胞,所述抗人pd-1抗体包含:具有seq id no:3的氨基酸序列的hcvr,和具有seq id no:4的氨基酸序列的lcvr,其中所述抗体是igg1。
64、在一些实施方案中,本公开提供了能够表达抗人pd-1抗体的哺乳动物细胞,所述抗人pd-1抗体包括包含以下的抗人pd-1抗体:具有seq id no:1的氨基酸序列的重链,和具有seq id no:2的氨基酸序列的轻链。在一些实施方案中,本公开提供了能够表达抗人pd-1抗体的哺乳动物细胞,所述抗人pd-1抗体包括由以下组成的抗人pd-1抗体:两条具有seqid no:1的氨基酸序列的重链,和两条具有seq id no:2的氨基酸序列的轻链。
65、本公开提供了用于产生抗人pd-1抗体的方法,其包括:1)培养能够表达抗人pd-1抗体的哺乳动物细胞,所述抗人pd-1抗体包含:具有seq id no:5的氨基酸序列的hcdr1,具有seq id no:6的氨基酸序列的hcdr2,具有seq id no:7的氨基酸序列的hcdr3,具有seqid no:8的氨基酸序列的lcdr1,具有seq id no:9的氨基酸序列的lcdr2,和具有seq idno:10的氨基酸序列的lcdr3,其中所述抗体是igg1;和2)回收所述抗体。
66、在一些实施方案中,本公开提供了用于产生抗人pd-1抗体的方法,其包括:1)培养能够表达抗人pd-1抗体的哺乳动物细胞,所述抗人pd-1抗体包含:具有seq id no:3的氨基酸序列的hcvr,和具有seq id no:4的氨基酸序列的lcvr,其中所述抗体是igg1,和2)回收所述抗体。
67、在一些实施方案中,本公开提供了用于产生抗人pd-1抗体的方法,其包括:1)培养能够表达抗人pd-1抗体的哺乳动物细胞,所述抗人pd-1抗体包含:具有seq id no:1的氨基酸序列的重链,和具有seq id no:2的氨基酸序列的轻链;和2)回收所述抗体。在一些实施方案中,本公开提供了用于产生抗人pd-1抗体的方法,其包括:1)培养能够表达抗人pd-1抗体的哺乳动物细胞,所述抗人pd-1抗体由以下组成:两条具有seq id no:1的氨基酸序列的重链,和两条具有seq id no:2的氨基酸序列的轻链;和2)回收所述抗体。本公开还提供了通过所述方法产生的抗人pd-1抗体和可接受的载体、稀释剂或赋形剂。
68、本公开提供了dna分子,其包含具有seq id no:11、seq id no:12或seq id no:11和12的序列的多核苷酸。本公开还提供了包含dna分子的哺乳动物细胞,所述dna分子包含具有seq id no:11、seq id no:12或seq idno:11和12的序列的多核苷酸。
69、本公开提供了药物组合物,其包含:1)抗人pd-1抗体,其包含:具有seq id no:5的氨基酸序列的hcdr1,具有seq id no:6的氨基酸序列的hcdr2,具有seq id no:7的氨基酸序列的hcdr3,具有seq id no:8的氨基酸序列的lcdr1,具有seq id no:9的氨基酸序列的lcdr2,和具有seq id no:10的氨基酸序列的lcdr3,其中所述抗体是igg1,和2)可接受的载体、稀释剂或赋形剂。在一些实施方案中,所述抗人pd-1抗体包含:具有seq id no:3的氨基酸序列的hcvr,和具有seqid no:4的氨基酸序列的lcvr,其中所述抗体是igg1。在一些实施方案中,所述抗人pd-1抗体包含:具有seq id no:1的氨基酸序列的重链,和具有seq idno:2的氨基酸序列的轻链。在一些实施方案中,所述抗人pd-1抗体由以下组成:两条具有seq id no:1的氨基酸序列的重链,和两条具有seq id no:2的氨基酸序列的轻链。
70、pd-1途径作为免疫检查点的作用已得到广泛研究。已知当刺激pd-1途径时,免疫系统活性通常降低,其可用于治疗自身免疫性病症,诱导免疫耐受和/或减少移植物抗宿主疾病。
71、本公开提供了治疗自身免疫性病症的方法,其包括向有此需要的患者施用有效量的抗人pd-1抗体,所述抗人pd-1抗体包含:1) hcvr,其包含具有seq id no:5的氨基酸序列的hcdr1,具有seq id no:6的氨基酸序列的hcdr2,具有seq id no:7的氨基酸序列的hcdr3;和2) lcvr,其包含具有seq id no:8的氨基酸序列的lcdr1,具有seq id no:9的氨基酸序列的lcdr2,和具有seq id no:10的氨基酸序列的lcdr3,其中所述抗体是igg1。在一些实施方案中,本公开提供了治疗自身免疫性病症的方法,其包括向有此需要的患者施用有效量的抗人pd-1抗体,所述抗人pd-1抗体包含:1)具有seq id no:3的氨基酸序列的hcvr;和2)具有seq id no:4的氨基酸序列的lcvr,其中所述抗体是igg1。在一些实施方案中,本公开提供了治疗自身免疫性病症的方法,其包括向有此需要的患者施用有效量的抗人pd-1抗体,所述抗人pd-1抗体包含:1)具有seq id no:1的氨基酸序列的重链,和2)具有seq id no:2的氨基酸序列的轻链。在一些实施方案中,本公开还提供了所述抗体由以下组成:两条具有seq id no:1的氨基酸序列的重链,和两条具有seq id no:2的氨基酸序列的轻链。在此类实施方案中,本公开还提供了所述自身免疫性病症是gvhd、实体器官移植排斥、血管炎、sle、t1dm、ms、gca、pso、psa、ra、ibd、uc、as、sjs、自身免疫性肝炎、硬皮病、乳糜泻、艾迪生氏病、桥本氏病、格雷夫斯氏病、萎缩性胃炎/恶性贫血、后天的性腺功能减退/不育、甲状旁腺功能低下、库姆斯阳性-溶血性贫血、慢性过敏性疾病(诸如哮喘、枯草热或过敏性鼻炎)、克罗恩氏病、男性或女性不育、白塞氏病、韦格纳氏肉芽肿病、心肌炎、肌炎、pmr、自发性流产、白癜风、动脉粥样硬化、自身免疫性胰腺炎、大疱性类天疱疮、慢性病毒感染或重症肌无力。
72、在一些实施方案中,本公开还提供了所述抗体与用于治疗自身免疫性病症的其他治疗剂组合施用。
73、本公开提供了本发明的抗人pd-1抗体,其用于疗法中。在一些实施方案中,本公开提供了抗人pd-1抗体,其包含:1)具有seq id no:3的氨基酸序列的hcvr;和2)具有seq idno:4的氨基酸序列的lcvr,其中所述抗体是igg1,所述抗人pd-1抗体用于疗法中。在一些实施方案中,本公开提供了抗人pd-1抗体,其包含:1)具有seq id no:1的氨基酸序列的重链,和具有seq id no:2的氨基酸序列的轻链,所述抗人pd-1抗体用于疗法中。在一些实施方案中,本公开还提供了所述抗体由以下组成:两条具有seq id no:1的氨基酸序列的重链,和两条具有seq id no:2的氨基酸序列的轻链。在一些实施方案中,本公开提供了所述疗法用于治疗自身免疫性病症。在一些实施方案中,本公开提供了所述自身免疫性病症是gvhd、实体器官移植排斥、血管炎、sle、t1dm、ms、gca、pso、psa、ra、ibd、uc、as、sjs、自身免疫性肝炎、硬皮病、乳糜泻、艾迪生氏病、桥本氏病、格雷夫斯氏病、萎缩性胃炎/恶性贫血、后天的性腺功能减退/不育、甲状旁腺功能低下、库姆斯阳性-溶血性贫血、慢性过敏性疾病(诸如哮喘、枯草热或过敏性鼻炎)、克罗恩氏病、男性或女性不育、白塞氏病、韦格纳氏肉芽肿病、心肌炎、肌炎、pmr、自发性流产、白癜风、动脉粥样硬化、自身免疫性胰腺炎、大疱性类天疱疮、慢性病毒感染或重症肌无力。在一些实施方案中,本公开提供了所述抗体与用于治疗自身免疫性病症的另一种治疗剂组合施用。在一些实施方案中,本公开还提供了所述抗体与用于治疗自身免疫性病症的另一种治疗剂同时、分开或依次组合施用(或待施用)。
74、本公开提供了本发明的抗人pd-1抗体,其用于制备用于治疗自身免疫性病症的药物。在一些实施方案中,本公开提供了抗人pd-1抗体,其包含:1)具有seq id no:3的氨基酸序列的hcvr;和2)具有seq id no:4的氨基酸序列的lcvr,其中所述抗体是igg1,所述抗人pd-1抗体用于制备用于治疗自身免疫性病症的药物。在一些实施方案中,本公开提供了抗人pd-1抗体,其包含:1)具有seq id no:1的氨基酸序列的重链;和2)具有seq id no:2的氨基酸序列的轻链,所述抗人pd-1抗体用于制备用于治疗自身免疫性病症的药物。在一些实施方案中,本公开还提供了所述抗体由以下组成:两条具有seq id no:1的氨基酸序列的重链,和两条具有seq id no:2的氨基酸序列的轻链。在一个实施方案中,本公开提供了所述药物用于治疗自身免疫性病症。在一些实施方案中,本公开提供了所述药物用于治疗gvhd、实体器官移植排斥、血管炎、sle、t1dm、ms、gca、pso、psa、ra、ibd、uc、as、sjs、自身免疫性肝炎、硬皮病、乳糜泻、艾迪生氏病、桥本氏病、格雷夫斯氏病、萎缩性胃炎/恶性贫血、后天的性腺功能减退/不育、甲状旁腺功能低下、库姆斯阳性-溶血性贫血、慢性过敏性疾病(诸如哮喘、枯草热或过敏性鼻炎)、克罗恩氏病、男性或女性不育、白塞氏病、韦格纳氏肉芽肿病、心肌炎、肌炎、pmr、自发性流产、白癜风、动脉粥样硬化、自身免疫性胰腺炎、大疱性类天疱疮、慢性病毒感染或重症肌无力。
75、剂量方案可以进行调整以提供最佳的期望应答(例如,治疗效果)。可以滴定治疗剂量以优化安全性和效力。对于静脉内(i.v.)或非静脉内施用、皮下(s.c.)局部或全身或其组合的给药时间表将通常范围为单次推注剂量或连续输注至每月多次皮下施用,优选每天不超过一次,或更优选地,每周不超过一次,甚至更优选地,每两周不超过一次,甚至更优选地,每月不超过一次,或者如治疗医师和患者的病况所指示。给药量和频率可以由治疗患者的医师确定。
- 还没有人留言评论。精彩留言会获得点赞!