本发明涉及基因表达与调控,具体为一种筛选与鉴定猪胚胎附植关键基因的方法。
背景技术:
1、猪胚胎附植和胎盘发育异常导致的妊娠损失高达20%,同时也是体细胞克隆胚胎死亡的主要因素,但关键调控机制尚不清楚。
2、合胞素基因(syncytin)是胎盘发育的关键调控基因,由内源性逆转录病毒(endogenous retrovirus,ervs)的env基因进化而来。本方案分析了猪基因组中的env基因,并利用bulk转录组测序分析了正常和scnt胚胎与胎盘之间表达差异,筛选到候选合胞素基因。同时,通过系统发育分析鉴定候选合胞素基因的进化特征。并通过细胞融合与假型病毒试验鉴定猪合胞素基因典型功能特征。本方案首次在猪基因组中发现猪关键合胞素基因,揭示猪合胞素基因介导猪合子基因组激活与胎盘促融合与介导病毒进入功能,为解决妊娠失败和体细胞克隆效率低的问题提供新的理论依据;
3、由于猪原代胚胎滋养层细胞系的缺乏,如若通过表达和敲除或者缺失进一步验证内源性猪合胞素基因的功能则面临一定的困难与挑战,ervs的env基因进化形成的合胞素基因是调控哺乳动物胎盘滋养层细胞分化和胎盘形态多样性的关键基因,因此,只有鉴定出猪关键合胞素基因,并揭示其调控胎盘滋养层细胞分化的机制,才能解决正常胚胎和体细胞克隆胚胎附植期妊娠损失率较高的问题。
4、因此,本发明提供一种筛选与鉴定猪胚胎附植关键基因的方法以解决上述提出的问题。
技术实现思路
1、(一)解决的技术问题
2、针对现有技术的不足,本发明提供了一种筛选与鉴定猪胚胎附植关键基因的方法,具备以下等优点,解决了上述提出的问题。
3、(二)技术方案
4、为实现上述目的,本发明提供如下技术方案:一种筛选与鉴定猪胚胎附植关键基因的方法,包括以下步骤:
5、步骤一:生物信息学鉴定;
6、步骤二:胚胎收集与培养;
7、步骤三:猪胎儿成纤维细胞分离培养与冻存;
8、步骤四:体外受精胚胎制备;
9、步骤五:核移植胚胎制备;
10、步骤六:反转录pcr;
11、步骤七:荧光定量pcr;
12、步骤八:pcr扩增;
13、步骤九:细胞融合试验;
14、步骤十:假型病毒试验。
15、优选的,所述生物信息学鉴定的具体步骤为:
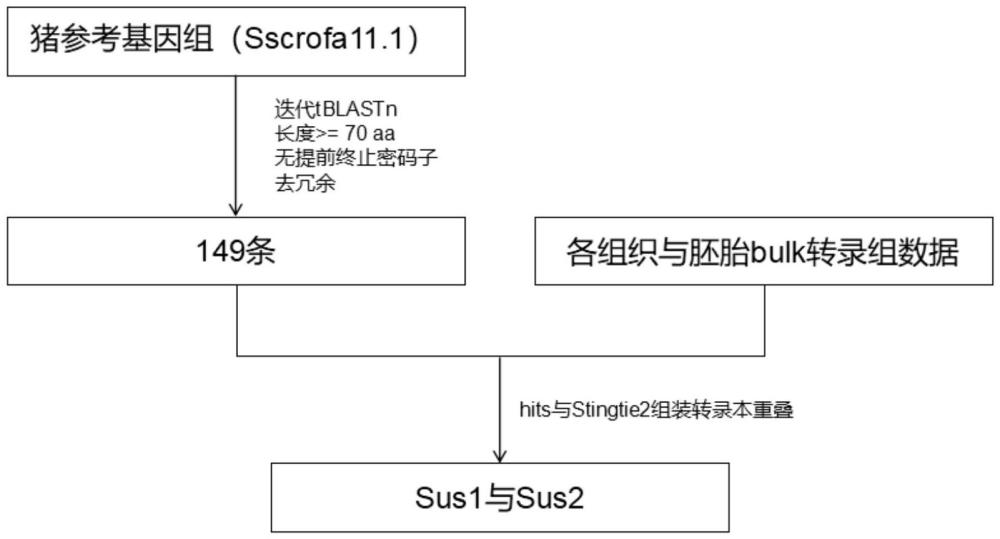
16、1)、在ncbi的geo数据库收集猪组织与胚胎转录组测序数据,使用fastq-dumpv2.9.6将sra对象转换为fastq文件,利用hisat2v2.2.1将gcf_000003025.6猪参考基因组建立基因组索引,然后将fastq文件比对至参考基因组得到原始bam文件,并通过samtoolsv1.17将bam文件排序从而进行下一步tpm(transcriptsperkilobasemillion)与counts值计算;
17、2)、在ncbi的genome数据库中下载gcf_000003025.6猪参考基因组fasta文件,利用tblastnv2.5.0将参考基因组fatsa文件建立核苷酸数据库;
18、ncbi蛋白库中accensionnumber为np_041188.1、yp_004222726.1、np_045939.1、np_056899.1、np_054717.1、np_040334.1、np_057856.1、np_056883.1、np_043923.1作为tblastn程序中的query,参数默认,将第一次tblastn得到的hits通过氨基酸大于或等于70aa且无终止密码子进行迭代tblastn,将迭代tblastn得到的hits通过氨基酸大于或等于70aa且无终止密码子并去冗余后得到149个有价值hits,将149条hits根据染色体号以及起始终止位置与方向制作成基因组注释文件,并加入至gcf_000003025.6参考基因组注释文件并重新排序用于转录组数据计算与分析;
19、3)、使用stringtie2v2.2.1计算以上149条hits的tpm与counts,通过设置参数“-rf”明确规定bam文件的转录本组装的链特异性,将得到的gtf文件通过stringtie2中“-merge”参数合并从而得到一个合并后的gtf文件,使用stringtie2的“-e、-rf”参数计算收集的组织与胚胎的样品的tpm与counts,发现149条hits中有2条hits与合并后得到的组装转录本重叠,因此将其命名为sus1(loc100624077)与sus2,并且发现sus1在早期胚胎中4-cell与8-cell表达且表达量较高,其他组织中广泛表达,sus2仅在胎盘与肺中表达,且胎盘中高表达;
20、4)、使用ncbi的conserveddomian数据库发现sus1与sus2都具有保守结构域tlvcoatsuperfamily和ebola_hiv-1-like_hr1-hr2superfamily,且都具cxxc与rxxr基序,利用signalp6.0,参数默认,发现sus2具信号肽结构域。
21、优选的,所述胚胎收集与培养的具体步骤为:
22、1)、从屠宰场收集的卵巢放入含1×青链霉素生理盐水的保温瓶,水温为20℃,4h内运抵实验室;
23、2)、剪去卵巢外多余的组织,用生理盐水反复洗涤干净,然后用带12号针头的注射器抽吸卵巢表面2-8mm的卵泡,将抽取的卵泡液注入60mm培养皿,在体视显微镜下收集卵丘-卵母细胞复合体(cocs),移入采卵用pbs;
24、3)、多次洗涤后,选择颗粒细胞包裹致密且卵胞质黑亮均匀的cocs,放入提前预热的卵母细胞体外成熟培养液(om);每3ml om最多容纳100个cocs;
25、4)、在38.5℃,5%co2的细胞培养箱中培养20-22h,成熟完毕后,在om中用吸头轻微吹打cocs至颗粒细胞仅剩3-4层,这样的cocs可用于制备ivf胚胎,吹打至大部分卵子不再黏附颗粒细胞;
26、5)、再移入颗粒细胞消化液,38.5℃消化3min,最后移入新的om中,用玻璃吸头拨动卵子,挑取排出第一极体的卵子,用于制备孤雌与核移植胚胎。
27、优选的,所述猪胎儿成纤维细胞分离培养与冻存的具体步骤为:
28、1)、猪胎儿成纤维细胞采用组织块贴壁法分离,即收集一月龄纯种长白猪胎儿,浸入含5×青链霉素双抗的pbs三次,每次3min,用眼科剪和镊子剥离胎猪皮肤组织,浸入bffs培养液,剪碎为0.5-1.0mm3的组织块;
29、2)、再将组织块均匀贴附于60mm细胞培养皿,倒置放入37℃,5%co2的细胞培养箱,10min后,向组织块滴加新鲜培养液,正置放入培养箱;
30、3)、4h后向培养皿补加4mlbffs培养液,培养3-4d后,观察猪胎儿成纤维细胞的迁出情况,并更换新鲜的培养液,继续培养至细胞汇合度为90%,剔除组织块,吸弃培养液,加2mlpbs轻柔吹洗细胞,再加1ml细胞消化液,放入培养箱3min;
31、4)、显微镜下观察细胞间隙扩大,细胞呈圆球状后,立即加1ml培养液终止消化,所得的细胞悬液移入4ml离心管,1000rpm离心5min,弃上清,加入新鲜培养液重悬,按1:3-1:5的比例接种于新的60mm培养皿,记为第一代猪胎儿成纤维细胞;
32、5)、用细胞计数板计算细胞密度,然后接种于细胞板,然后加1ml细胞冻存液重悬并转入冻存管,放入梯度降温盒并置于-80℃冰箱,4h后,转入液氮储存罐中保存。
33、优选的,所述体外受精胚胎制备的具体步骤为:
34、改良ivf液pzm放入培养箱中平衡12h,包括用于上浮精子和洗涤精子的两个5mlmbo,用于洗涤cocs的两个1mlmbo,以及矿物油覆盖的60μlmbo液滴数个,将冻精细管从液氮罐中取出,迅速放入37℃水浴中解冻,所得精液吸入长玻璃吸头,移入含5mlmbo的离心管底部,45°倾斜放入培养箱,静置30-45min,而后在om中用吸头轻微吹打cocs至颗粒细胞仅剩3-4层,移入1mlmbo,洗去多余颗粒细胞,放入培养箱孵育10min,然后再次洗去多余颗粒细胞,再将cocs移入ivf液滴,每个液滴含20-25个cocs,精子上浮结束后,吸取3-4ml上清,1,500rpm离心10min,弃上清,保留底部50-100μl的液体,加入5mlmbo重悬精子,并吸取少量液体用细胞计数板确定精子密度,再次离心后,调整精子密度为每1ml含2×106个精子,并将50μl精子悬液也加入ivf液滴,放入培养箱受精20h,受精完毕后,将受精卵移入msof,用吸头轻微吹打以去除多余的颗粒细胞和黏附精子,每次5min,最后将受精卵置于矿物油覆盖的msof液滴并放入培养箱,每150μlmsof液滴培养15-20个胚胎,受精后第3d需对培养液滴进行半换液。
35、优选的,所述核移植胚胎制备的具体步骤为:
36、将40-50个成熟卵子首先浸入卵母细胞核染液10min,再移入核移植操作液微滴,室温平衡10min,采用盲吸法去核,显微操作臂左端为固定针,用以吸住卵子;右端为去核针,用以扎入卵周隙并吸取极体以及极体附近的部分胞质,去核完毕后,用荧光显微镜的紫外光激发,挑出未能成功去核的卵子,供体细胞悬液注入相邻微滴,用去核针吸取直径为15-20μm的细胞,注入去核卵母细胞的透明带下,最后将重构胚胎移入om,置于培养箱中恢复20min,恢复完毕的胚胎先移入电融合液中,室温平衡3min,显微操作臂加载铂金丝微电极并连接电融合仪,用微电极拨动胚胎,将卵胞质、供体细胞和两端电极排列在一条线上,轻压胚胎并给予电脉冲,融合参数为电压35v,脉冲时长10μs,电击1次,再将胚胎移入om,置于培养箱中恢复2h,接下来使用离子霉素联合6-dmap对胚胎进行药物激活,即恢复完毕的胚胎先移入离子霉素激活液中4min,再移入om中洗涤5min,再移入6-dmap激活液并置于培养箱中孵育4h,随后用改良合成输卵管液pzm洗涤两次,每次5min,最后在体视显微镜下挑选成功融合的胚胎,置于矿物油覆盖的pzm液滴并放入培养箱,每150μlmsof液滴培养15-20个胚胎,激活后第3d对培养液滴进行半换液,即吸弃一半体积的原有pzm,添加一半体积的新鲜pzm培养基。
37、优选的,所述反转录pcr的具体步骤为:
38、收集猪早期各阶段体外受精胚胎与核移植胚胎3个囊胚收为一组样品,其余时期每组样品收集15个胚胎;
39、样品用无rnase的洗卵用pbs洗三次,每次3min,并以2μl的pbs液体将所有胚胎直接移入6μlcells-to-signallysisbuffer,冰上裂解10min,再向裂解液中加入1μl10×dnaseireactionbuffer和1μl1u/μldnasei,37℃水浴10min,最后加入1μl25mmedtasolution,65℃水浴10min以使dnasei失活,20μl反转录pcr体系:10×rtbuffer2μl、dntpmix4μl、randomdecamers1μl、oligo(dt)primers1μl、反转录酶m-mlvrt1μl、胚胎裂解产物10μl、rnase抑制剂1μl,反应程序为42℃,30min;95℃,10min;降温至4℃,cdna产物-80℃保存或直接进行荧光定量pcr;
40、荧光定量pcr的具体步骤为:
41、sus1与sus2定量引物序列送至合成,反转录得到的cdna用于模板,使用通用型高灵敏度染料法定量pcr检测试剂盒与steponeplus进行荧光定量检测sus1与sus2表达量;
42、反应体系:2×chamquniversalsybrqpcrmastermix5μl、上下游引物各0.2μl、template1μl、ddh2o4.6μl;
43、反应参数为:95℃30s预变性;95℃10s变性,60℃30s退火,根据仪器默认熔解曲线采集程序,内参引物为猪组蛋白h2a基因;
44、pcr扩增的具体步骤为:
45、sus1与sus2的扩增引物序列合成,将反转录得到的cdna作为模板,使用基因扩增仪qiqian-a100进行pcr实验,
46、采用hsdnapolymerase试剂盒进行高保真pcr试验;
47、反应体系(50μl):5×primestarbuffer(mg2+plus)10μl、dntpmixture(2.5mmeach)4μl、上下游引物各1μl、template1μl、primestarhsdnapolymerase(2.5u/μl)0.5μl、ddh2o32.5μl,反应参数:98℃2min预变性;98℃20s变性,58-65℃34s退火,72℃延伸2min30s,40个循环;72℃延伸5min。
48、优选的,所述细胞融合试验的具体步骤为:
49、sus1与sus2的cds序列被插入到pcdna3.1-3xflag-c质粒,使用peasy-uni无缝克隆和组装试剂盒进行操作,对于lacz报告质粒,表达带有脑心肌炎病毒内部核糖体进入位点的lacz,在存在t7聚合酶的情况下,移除pcdna3.1(+)的cmv启动子和增强子序列作为骨架质粒,插入emcv、ires、lacz和t7终止子序列,同样使用peasy-uni无缝克隆和组装试剂盒进行操作,emcv序列通过pcr扩增与ires序列连接,ires和lacz序列分别从pmx-ires-puro和pub6-v5-his-lacz中克隆,t7终止子序列合成,上述所有pcr均使用primestarhsdna聚合酶进行,hek-293t与pk15细胞使用pei试剂转染法,即细胞以2×105的密度传入24孔板或1×106的密度传入6孔板12h后,加入转染预混液,转染4-6h后再将分别转染后的细胞共孵育,转染预混液的配制:准备两个ep管,加入300微升opti-mem,两个管分别预混2μg质粒和10μlpei试剂以及2μgpcag-t7-pol,分别室温静置5min;轻柔混匀并再次静置15min后转染预混液加入6孔板一孔,待培养24-48h后,弃去培养基,使用pbs将细胞洗5遍,使用4%多聚甲醛固定细胞20min后pbs洗5遍,加入预热的xgal染色液置于37摄氏度培养箱孵育24h后显微镜下观察;
50、假型病毒试验的具体步骤为:
51、sus1与sus2的cds序列被插入到pcdna3.1-3xflag-c质粒,使用peasy-uni无缝克隆和组装试剂盒进行操作,对于编码mlvgag和pol蛋白的质粒,使用pumvc(addgene)作为骨架质粒,插入了从质粒pmx-ires-puro(addgene)克隆的ires-puro序列,同样使用peasy-uni无缝克隆和组装试剂盒进行操作,对于带有核定位信号的lacz的逆转录质粒,移除了pmx-ires-puro作为骨架质粒的ires-puro序列,插入了sv40-nls和lacz序列,使用了peasy-uni无缝克隆和组装试剂盒进行操作,sv40-nls由合成,lacz序列从pub6-v5-his-lacz(addgene)中克隆,hek-293t与pk15细胞使用pei试剂转染法,即细胞以2×105的密度传入24孔板或1×106的密度传入6孔板12h后,加入转染预混液,转染4-6h后再换液,转染预混液的配制:准备1个ep管,加入300微升opti-mem,预混3μg质粒和15μlpei试剂,室温静置5min;轻柔混匀并再次静置15min后转染预混液加入6孔板一孔,待培养24-48h后,收集培养基离心,并使用pvdf膜过滤培养液上清,加入未处理的接受细胞培养基中,病毒上清与培养基体积比为1:1,孵育48h后弃去培养基,加入预热的xgal染色液置于37摄氏度培养箱孵育24h后显微镜下观察。
52、与现有技术相比,本发明提供了一种筛选与鉴定猪胚胎附植关键基因的方法,具备以下有益效果:
53、1、该筛选与鉴定猪胚胎附植关键基因的方法,通过分析了猪基因组中的env基因,并利用bulk转录组测序分析了正常和scnt胚胎与胎盘之间表达差异,筛选到2个候选合胞素基因;通过结构分析发现sus1与sus2具经典合胞素基因结构,表达分析发现sus1在早期胚胎合子基因组激活阶段高表达,sus2仅在胎盘与肺中表达且胎盘特异高表达,揭示sus1与sus2可能介导猪胚胎发育并发挥重要作用。
54、2、该筛选与鉴定猪胚胎附植关键基因的方法,通过细胞融合与假型病毒试验验证发现,sus1与sus2均可促进细胞融合并且介导病毒进入,这进一步表明sus1与sus2可能参与早期胚胎发育与胎盘形成过程;本方案为首次筛选并鉴定猪合胞素基因,基于结构与表达分析的基础,并在细胞水平验证其促进细胞融合与介导病毒进入的功能,揭示体细胞克隆胚胎胎盘发育异常的分子机制,为解决猪克隆胚胎胎盘发育异常提供了坚实的理论依据。
