用曲妥珠单抗美坦新治疗残存乳腺癌的方法与流程
本公开涉及使用曲妥珠单抗美坦新偶联物(trastuzumab emtansine,t-dm1)治疗残存乳腺癌的方法。
背景技术:
1、乳腺癌是全世界发病率和死亡率的高度重要原因。每年全球在全球诊断出超过130万例乳腺癌病例,与该疾病相关的死亡人数超过45万(jemal a,bray f,center m,等人,global cancer statistics.ca cancer j clin,2011;61(2):69-90)。
2、her2(erbb2)受体酪氨酸激酶是跨膜受体的表皮生长因子受体(egfr)家族的成员。在大约20%的人类乳腺癌(以下称为her2-阳性乳腺癌)中观察到her2的过表达,并且与这些肿瘤相关的侵袭性生长和不良的临床预后相关(slamon等人,(1987)science 235:177-182)。her2蛋白过表达可以使用基于免疫组织化学的固定肿瘤块的评估来确定(pressmf,等人,(1993)cancer res 53:4960-70)。
3、曲妥珠单抗(cas180288-69-1,humab4d5-8,rhumab her2,genentech)是重组dna衍生的igg1κ单克隆抗体,其是人源化形式的鼠抗her2抗体(4d5),其在基于细胞的测定中可以高度亲和力(kd=5nm)选择性结合her2的细胞外结构域(us5677171;us 5821337;us 6054297;us 6165464;us 6339142;us 6407213;us 6639055;us6719971;us 6800738;us 7074404;coussens等人,(1985)science230:1132-9;slamon等人,(1989)science 244:707-12;slamon等人,(2001)new engl.j.med.344:783-792)。曲妥珠单抗在体外测定法和动物中均显示抑制过表达her2的人肿瘤细胞的增殖(hudziak等人,(1989)mol cell biol 9:1165-72;lewis等人,(1993)cancer immunol immunother;37:255-63;baselga等人,(1998)cancer res.58:2825-2831)。曲妥珠单抗是抗体依赖性细胞毒性adcc的介体(lewis等人,(1993)cancer immunol immunother 37(4):255-263;hotaling等人,(1996)proc.annual meeting am assoc cancer res;37:471;pegram md,等人,(1997)[proc am assoc cancer res;38:602;sliwkowski等人,(1999)seminars inoncology 26(4),suppl12:60-70;yarden y.和sliwkowski,m.(2001)nature reviews:molecular cell biology,macmillan magazines,ltd.,vol.2:127-137)。
4、于1998年被批准用于治疗已接受了广泛的现有抗癌疗法的过表达her2的转移性乳腺癌患者(baselga等人,(1996)j.clin.oncol.14:737-744),此后已用于超过300,000例患者中(slamon dj,等人,n engl j med 2001;344:783-92;vogel cl,等人,j clin oncol2002;20:719-26;marty m,等人,j clin oncol 2005;23:4265-74;romond eh,等人,t n engl j med 2005;353:1673-84;piccart-gebhart mj,等人,n engl j med 2005;353:1659-72;slamon d,等人,breast cancer res treat2006,100(suppl 1):52)。2006年,fda批准(曲妥珠单抗,genentech inc.)作为包括阿霉素、环磷酰胺和紫杉醇的治疗方案的一部分,用于辅助治疗her2阳性、淋巴结阳性的乳腺癌患者。
5、抗体靶向疗法的另一种方法是利用抗体将细胞毒性药物特异性地递送至表达抗原的癌细胞。抗体-药物偶联物或adc是已与高效细胞毒性剂偶联的单克隆抗体。adc代表一种赋予系统性施用的抗肿瘤治疗剂以肿瘤选择性的新颖方案。利用肿瘤特异性及/或过表达的表面抗原,adc旨在将高效的细胞毒性剂集中递送至肿瘤细胞。这种方案的潜力是为此类药剂创造比通过将其作为游离药物施用所获得的治疗窗口更有利的治疗窗口。
6、抗有丝分裂药物美登素(maytansine)的衍生物美登素生物碱(maytansinoid)以与长春花生物碱药物相似的方式与微管结合(issell bf等人,(1978)cancertreat.rev.5:199-207;cabanillas f等人,(1979)cancer treat rep,63:507–9)。dm1是一种含-硫醇的美登素生物碱,衍生自天然存在的酯类安那托霉素p3(remillard s,rebhunli,howie ga,等人,(1975)science 189(4207):1002–1005.3;cassady jm,chan kk,flosshg.(2004)chem pharm bull 52(1):1–26.4)。相关的植物酯美登素已被作为化学治疗剂,在大约800名患者中,每3周以2.0mg/m2的剂量施用,单次施用或连续3天施用进行了研究(issell bf,crooke st.(1978)maytansine.cancer treat rev 5:199-207)。尽管有临床前活性,但临床上美登素的活性在可以安全递送的剂量下是适度的。剂量限制毒性(dlt)是胃肠道疾病,包括恶心,呕吐和腹泻(通常随后便秘)。这些毒性与剂量有关,但与时间表无关。据报道,周围神经病变(主要是感觉异常)在患有神经病变的患者中最为明显。据报道,肝转氨酶、碱性磷酸酶和总胆红素的亚临床瞬时升高。体质上的毒性很常见,包括虚弱、嗜睡、烦躁不安和失眠。较不常见的毒性包括输液-部位静脉炎和轻度骨髓抑制。由于治疗窗口狭窄,该药的进一步开发在1980年代被放弃了。
7、曲妥珠单抗美坦新偶联物(t-dm1、曲妥珠单抗-mcc-dm1、ado-曲妥珠单抗美坦新偶联物、)是一种用于治疗her2-阳性乳腺癌的新型抗体-药物偶联物(adc),由细胞毒性剂dm1(含-硫醇的美登素生物碱抗-微管剂)通过mcc连接基在赖氨酸侧链上与曲妥珠单抗偶联,平均载药量(药物与抗体之比)约为3.5。与肿瘤细胞上表达的her2结合后,t-dm1经历受体-介导的内化作用,导致细胞内释放含有dm1的细胞毒性分解代谢物并随后导致细胞死亡。
8、当前,对由标准化学疗法和her2靶向疗法组成的新辅助治疗未达到病理性完全应答的患有her2阳性早期乳腺癌的患者,与那些实现了病理性完全应答的患者相比,其疾病复发风险显著更高,生存期显著降低。在her2阳性患者中,达到病理性完全应答与3年后侵袭性疾病或死亡风险降低62%至73%以及因任何原因导致死亡风险降低65%有关(schneeweiss 2018;de azambuja lancet oncol 2014;gianni lancet oncol2014)。然而,这些患者中仅约30%至40%达到了病理性完全应答(schneeweiss 2018;de azambujalancet oncol 2014;gianni lancet oncol 2014;untch jco 2011)。因此,治疗对新辅助疗法未达到病理性完全应答的那些癌症患者仍存在未满足的医学需求。
技术实现思路
1、本公开总体上涉及使用抗体-药物偶联物曲妥珠单抗美坦新偶联物(t-dm1)治疗乳腺癌患者的方法。
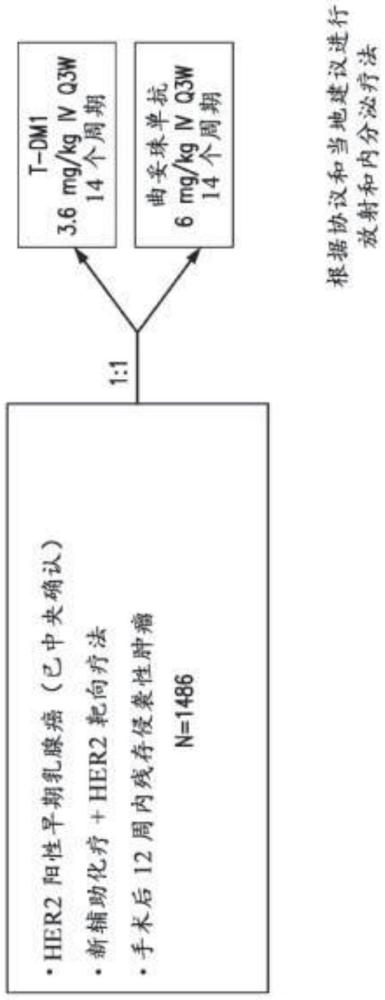
2、在一个方面,本公开涉及一种辅助疗法的方法,该方法包括向患有her2阳性的早期乳腺癌的患者施用有效量的曲妥珠单抗美坦新偶联物(t-dm1)作为单一疗法,其中该患者在术前全身治疗后具有残存疾病。在某些实施例中,残存疾病存在于乳腺、淋巴结中,或存在于乳腺和淋巴结中。在某些实施例中,术前全身治疗包括her2靶向疗法,例如曲妥珠单抗。在某些实施例中,her2靶向疗法还包括帕妥珠单抗(pertuzumab)、拉帕替尼(lapatinib)、来那替尼(neratinib)、达克替尼(neratinib)及/或阿法替尼。在某些实施例中,her2靶向疗法包括曲妥珠单抗和帕妥珠单抗。在某些实施例中,her2靶向疗法包括曲妥珠单抗,并且还包括选自拉帕替尼、来那替尼、达克替尼和阿法替尼的药剂。在某些实施例中,术前全身治疗还包括紫杉烷类。在某些实施例中,患者是成年患者。在某些实施例中,在施用t-dm1之前对患者进行确定性手术。在某些实施例中,在确定性手术后不超过12周向患者施用t-dm1。在某些实施例中,患者已经完成至少16周的使用含紫杉烷类化疗方案和her2靶向疗法的术前全身治疗。在某些实施例中,患者已经完成至少6个周期的含紫杉烷类化学疗法。在某些实施例中,以每3周3.6mg/kg的剂量给患者施用t-dm1。在某些实施例中,以每3周3.6mg/kg的剂量给患者施用t-dm1,进行十四个周期。在某些实施例中,与使用曲妥珠单抗的辅助疗法相比,辅助疗法显著增加了无侵袭性疾病生存期(idfs)。在某些实施例中,与使用曲妥珠单抗的辅助疗法相比,辅助疗法使侵袭性疾病复发的风险降低了50%。在某些实施例中,与使用曲妥珠单抗的辅助疗法相比,辅助疗法导致远处复发减少。在某些实施例中,与辅助曲妥珠单抗相比,辅助疗法使远处复发的风险降低了40%。
3、一方面,本公开涉及曲妥珠单抗美坦新偶联物(t-dm1),其用于患者的her2阳性早期乳腺癌的辅助治疗中,其中所述辅助疗法是单一疗法,并且其中所述患者在术前全身治疗后具有残存疾病。在某些实施例中,残存疾病存在于乳腺中、存在于淋巴结中、或存在于乳腺和淋巴结中。在某些实施例中,术前全身治疗包括her2靶向疗法。在某些实施例中,her2靶向疗法包括曲妥珠单抗。在某些实施例中,her2靶向疗法还包括帕妥珠单抗(pertuzumab)、拉帕替尼(lapatinib)、来那替尼(neratinib)、达克替尼(neratinib)及/或阿法替尼。在某些实施例中,her2靶向疗法包括曲妥珠单抗和帕妥珠单抗。在某些实施例中,her2靶向疗法包括曲妥珠单抗,并且还包括选自拉帕替尼、来那替尼、达克替尼和阿法替尼的药剂。在某些实施例中,术前全身治疗还包括紫杉烷类。在某些实施例中,患者是成年患者。在某些实施例中,在施用t-dm1之前对患者进行确定性手术。在某些实施例中,与使用曲妥珠单抗的辅助疗法相比,辅助疗法显著增加了无侵袭性疾病生存期(idfs)。在某些实施例中,与使用曲妥珠单抗的辅助疗法相比,辅助疗法使侵袭性疾病复发的风险降低了50%。在某些实施例中,与使用曲妥珠单抗的辅助疗法相比,辅助疗法导致远处复发减少。在某些实施例中,与辅助曲妥珠单抗相比,辅助疗法使远处复发的风险降低了40%。
4、一方面,本公开涉及曲妥珠单抗美坦新偶联物(t-dm1)在制备用于患者的her2阳性早期乳腺癌辅助疗法的药物中的用途,其中辅助疗法是单一疗法,并且其中患者在术前全身治疗后具有残存疾病。在某些实施例中,残存疾病存在于乳腺中、存在于淋巴结中、或存在于乳腺和淋巴结中。在某些实施例中,术前全身治疗包括her2靶向疗法。在某些实施例中,her2靶向疗法包括曲妥珠单抗。在某些实施例中,her2靶向疗法还包括帕妥珠单抗(pertuzumab)、拉帕替尼(lapatinib)、来那替尼(neratinib)、达克替尼(neratinib)及/或阿法替尼。在某些实施例中,her2靶向疗法包括曲妥珠单抗和帕妥珠单抗。在某些实施例中,her2靶向疗法包括曲妥珠单抗,并且还包括选自拉帕替尼、来那替尼、达克替尼和阿法替尼的药剂。在某些实施例中,术前全身治疗还包括紫杉烷类。在某些实施例中,患者是成年患者。在某些实施例中,在施用t-dm1之前对患者进行确定性手术。在某些实施例中,与使用曲妥珠单抗的辅助疗法相比,辅助疗法显著增加了无侵袭性疾病生存期(idfs)。在某些实施例中,与使用曲妥珠单抗的辅助疗法相比,辅助疗法使侵袭性疾病复发的风险降低了50%。在某些实施例中,与使用曲妥珠单抗的辅助疗法相比,辅助疗法导致远处复发减少。在某些实施例中,与辅助曲妥珠单抗相比,辅助疗法使远处复发的风险降低了40%。
5、在一个方面,本公开涉及一种用于治疗患有her2阳性早期乳腺癌的患者的乳腺癌的方法,该患者在用化学疗法和her2靶向疗法的新辅助疗法后在乳腺或腋窝淋巴结中有残存疾病,所述方法包括(i)通过确定性手术清除乳腺和腋窝淋巴结中所有临床上明显的肿瘤细胞;(ii)在没有先前或同时进行化疗的辅助治疗的情况下,对患者进行t-dm1辅助治疗。在某些实施例中,在用紫杉烷类和her2靶向疗法的新辅助疗法后,患者在乳腺或腋窝淋巴结中有残存疾病。在某些实施例中,患者已经完成至少16周的使用含紫杉烷类化疗方案和her2靶向疗法的新辅助疗法。在某些实施例中,患者已经完成至少6个周期的含紫杉烷类化疗方案。在某些实施例中,在确定性手术后不超过12周对患者进行t-dm1辅助治疗。在某些实施例中,在新辅助疗法完成后至少14天进行确定性手术。在某些实施例中,确定性手术在新辅助疗法完成后不迟于9周进行。在某些实施例中,以每3周3.6mg/kg的剂量的t-dm1输注对患者进行辅助治疗。在某些实施例中,以每3周3.6mg/kg的剂量的t-dm1输注对患者进行十四个周期的辅助治疗。在某些实施例中,与使用曲妥珠单抗的辅助治疗相比,所述治疗显著增加了无侵袭性疾病生存期(idfs)。在某些实施例中,与使用曲妥珠单抗的辅助治疗相比,治疗使得远处复发减少。在某些实施例中,与使用曲妥珠单抗的辅助疗法相比,辅助疗法使侵袭性疾病复发的风险降低了50%。在某些实施例中,与辅助曲妥珠单抗相比,辅助疗法使远处复发的风险降低了40%。
6、在一个方面,本公开涉及一种用于治疗患有her2阳性早期乳腺癌的患者的乳腺癌的方法,该患者在新辅助疗法后具有残存疾病,该方法包括在患者接受了确定性手术后向患者施用有效量的t-dm1。在一个方面,残存疾病是病理性残存侵袭性疾病。在某些实施例中,残存疾病是乳腺及/或腋窝淋巴结中的病理性残存侵袭性疾病。在某些实施例中,方法不包括先前或同时进行的使用化疗的辅助治疗。在某些实施例中,新辅助疗法包括紫杉烷类和her2靶向疗法。在某些实施例中,新辅助疗法包括紫杉烷类和曲妥珠单抗。在某些实施例中,患者已经完成至少16周的新辅助疗法。在某些实施例中,患者已经完成至少6个周期的含紫杉烷类的新辅助化疗。在某些实施例中,在确定性手术后不超过12周对患者进行t-dm1治疗。在某些实施例中,在新辅助疗法完成后至少14天进行确定性手术。在某些实施例中,在新辅助疗法完成后不迟于9周进行确定性手术。在某些实施例中,以每3周3.6mg/kg的剂量的t-dm1输注对患者进行治疗。在某些实施例中,以每3周3.6mg/kg的剂量的t-dm1输注对患者进行治疗,进行十四个周期。在某些实施例中,与使用曲妥珠单抗的辅助治疗相比,治疗显著增加了无侵袭性疾病生存期(idfs)。在某些实施例中,与使用曲妥珠单抗的辅助治疗相比,治疗使得远处复发减少。在某些实施例中,与使用曲妥珠单抗的辅助疗法相比,辅助疗法使侵袭性疾病复发的风险降低了50%。在某些实施例中,与辅助曲妥珠单抗相比,辅助疗法使远处复发的风险降低了40%。
7、在另一方面,本公开涉及用于降低患有her2阳性早期乳腺癌的患者中的癌症复发的风险的方法,其包括向所述患者施用有效量的t-dm1,其中所述患者对新辅助疗法未达到病理性完全应答,并且患者在施用t-dm1之前已进行了确定性手术。在某些实施例中,方法不包括先前或同时进行的使用化疗的辅助治疗。在某些实施例中,新辅助疗法包括紫杉烷类和her2靶向疗法。在某些实施例中,新辅助疗法包括紫杉烷类和曲妥珠单抗。在某些实施例中,患者已经完成至少16周的新辅助疗法。在某些实施例中,患者已经完成至少6个周期的含紫杉烷类的新辅助疗法。在某些实施例中,在确定性手术后不超过12周对患者进行t-dm1治疗。在某些实施例中,在新辅助疗法完成后至少14天进行确定性手术。在某些实施例中,在新辅助疗法完成后不迟于9周进行确定性手术。在某些实施例中,以每3周3.6mg/kg的剂量的t-dm1输注对患者进行治疗。在某些实施例中,以每3周3.6mg/kg的剂量的t-dm1输注对患者进行治疗,进行十四个周期。在某些实施例中,与使用曲妥珠单抗的辅助治疗相比,所述治疗显著增加了无侵袭性疾病生存期(idfs)。在某些实施例中,与使用曲妥珠单抗的辅助治疗相比,治疗使得远处复发减少。在某些实施例中,与使用曲妥珠单抗的辅助疗法相比,辅助疗法使侵袭性疾病复发的风险降低了50%。在某些实施例中,与辅助曲妥珠单抗相比,辅助疗法使远处复发的风险降低了40%。
- 还没有人留言评论。精彩留言会获得点赞!