一种光激活双特异性核酸适体嵌合体及其制备方法和使用方法
本发明属于医药领域,具体而言,涉及一种靶向溶酶体蛋白降解药物。
背景技术:
1、靶向蛋白降解技术(targeted protein degradation,tpd)通过泛素蛋白酶体和溶酶体降解目标蛋白,是近年发展起来的一项具有颠覆意义的蛋白调控新技术。
2、其中,蛋白降解靶向嵌合体(proteolysis targeting chimera, protac)发展最为成熟,在疾病治疗领域显示出广阔应用前景,其主要利用细胞内天然的蛋白降解体系——泛素蛋白酶系统(ubiquitin-proteasome system, ups)实现目标蛋白(protein ofinterest, poi)的靶向降解。protac是一种双功能的小分子,其一端靶向poi,一端招募e3泛素连接酶形成哑铃型结构的三元复合物,poi被打上泛素化标签,进而被蛋白酶体识别降解。在过去的20年里,基于protac技术的各类降解系统层出不穷,相关研究成果在近些年呈爆发式增长,例如分子胶、自噬靶向嵌合体等,极大丰富了胞内蛋白稳态调控手段。更令人兴奋的是,截止2023年3月,已有19款protac药物进入临床研究,并初步显示出良好的治疗效果。
3、溶酶体靶向嵌合体(lysosome-targeting chimaeras,lytac)技术是另一种新型的靶向蛋白降解技术。该技术由2022年诺贝尔奖得主,斯坦福大学carolyn. r. bertozzi教授团队于2020年开发设计。lytac依赖溶酶体降解途径,首次实现了将肿瘤细胞膜表面靶标蛋白及胞外靶标蛋白带入溶酶体进行降解,从而抑制肿瘤发展。lytac弥补了传统protac只能降解胞内蛋白的技术短板,逐渐成为药物研发界的新宠。目前,利用lytac技术已成功实现膜蛋白如表皮生长因子受体(egfr)、程序性死亡配体1(pd-l1)、转铁蛋白受体(cd71)以及分泌蛋白载脂蛋白e4(apoe4)等的降解。lytac的发展为肿瘤治疗提供了新工具,成为近年肿瘤治疗药物开发的研究热点。
4、虽然lytac技术得到了快速发展,仍存在以下两个关键技术亟待解决:
5、(1)如何制备结构相对简单又精准可控的lytac分子?基于传统技术上的亲和素和生物素分子的偶联方式亦不够精准调控,存在很大的相对不确定性。基于糖蛋白相互识别的糖基lytac分子依靠糖配体与抗体偶联制备,一方面识别溶酶体靶向受体蛋白(lysosometargeting receptors,ltr)的糖配体合成复杂、产率低、成本高;另一方面,靶向ltr的糖配体对抗体的标记是非特异的,最优数量和最佳偶联点尚不明确;
6、(2)如何提高lytac的肿瘤治疗功效?越来越多的证据表明lytac的降解效率受到多种因素的影响,例如lytac分子与目标蛋白的亲和力、细胞内的运输和回收机制等。因此lytac的肿瘤治疗功效有待提升。
技术实现思路
1、为解决现有技术提及的上述问题,本发明提供了一种光激活双特异性核酸适体嵌合体(photoactive bispecific aptamer chimeras (pbacs)),其分子结构可以精确控制,且响应近红外光,增强细胞内ros的生成并触发增强细胞自噬,通过细胞自噬强化溶酶体途径靶向蛋白降解,实现大幅限制肿瘤细胞克隆、迁移能力,提高肿瘤细胞杀伤效果和lytac的治疗效果。
2、具体技术方案如下:所述光激活双特异性核酸适体嵌合体包括第一核酸序列、第二核酸序列和光敏剂;
3、所述第一核酸序列包括:第一核酸适体序列、第一互补序列,所述第一核酸适体特异性识别并结合细胞表面转运蛋白;
4、所述第二核酸序列包括:第二核酸适体序列、第二互补序列、载药序列,所述第二核酸适体特异性识别并结合待降解的膜蛋白靶点,所述第二互补序列与第一互补序列能够实现精准的碱基互补配对;
5、所述光敏剂精准修饰在第二核酸序列的所述载药序列上;所述光敏剂响应近红外光,增加肿瘤细胞内ros生成,启动细胞自噬,
6、其中第一核酸序列被设计为带有靶向igfiir的核酸适体序列和互补序列;第二核酸序列被设计为带有sgc8核酸适体序列、互补序列和载药序列;igfiir的序列为ttgccagtgattgatcca;sgc8的序列为ggatcaatcactggcaa。
7、通过设计第一和第二互补序列以及在第二核酸适体的载药序列上精准修饰光敏剂,本发明的产物结构可以实现稳定、精准地控制。
8、优选地,所述第二核酸适体为肿瘤靶向的dna核酸分子。特别优选地,所述第二核酸适体为sgc8、as1411或xq-2d核酸适体。
9、优选地,所述第二核酸适体所识别结合的待降解的膜蛋白靶点为ptk7、核仁素蛋白、pdl1蛋白或pd1蛋白等。
10、第二核酸适体能够帮助本发明靶向肿瘤细胞,其结合的膜蛋白可以是与肿瘤细胞的发生、发展密切有关的蛋白质,使本发明欲开启和强化的溶酶体靶向蛋白降解能够有效干扰肿瘤的发生、发展。上述所提及的核酸适体和膜蛋白中,sgc8核酸适体识别肿瘤细胞表面的ptk7蛋白,ptk7与肿瘤的生长和浸润有关;as1411核酸适体结合的核仁素蛋白是作为与血管生成和肿瘤发生有关的几种配体的结合蛋白;xq-2d核酸适体是与cd71特异性结合的胰腺癌特异性核酸适体,cd71为转铁蛋白受体,介导细胞对铁的吸收;而肿瘤细胞膜上的pd-1蛋白和pd-l1蛋白能够通过信号通路影响肿瘤细胞的生长。
11、优选地,所述细胞表面的转运蛋白包括:溶酶体靶向受体(lysosome-targetingreceptor,ltr)、蛋白酶体转运蛋白、甘露糖6磷酸受体(m6pr)或溶酶体整合膜蛋白2(lysosomal integral membrane protein 2,limp-2)等,这些转运蛋白已被验证能够开启溶酶体转运,其能够与本发明产物pbacs的第一核酸适体相互识别并结合,并携带本发明pbacs和与之结合待降解的靶标膜蛋白内吞入细胞,以开启后续溶酶体途径的蛋白降解。
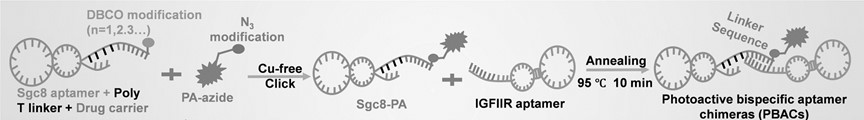
12、优选地,所述光敏剂为能够响应近红外光的第一代、第二代、第三代或第四代光敏小分子药物。光敏剂作为肿瘤的光动力治疗常用药物,其在细胞中进行光响应产生活性氧物质,产生细胞毒性作用,实现光动力治疗。其中,第一代光敏剂主要是血卟啉类;第二代光敏剂为二氢卟吩类,包括5-氨基酮戊酸、海姆泊芬、维替泊芬等;第三代光敏剂是第二代的光敏剂偶联上不同的靶向分子的衍生物,第四代光敏剂包括前三者具备其他功能的进一步衍生或一些新型光动力纳米材料。包括光动力治疗常用的疏水性ce6,吲哚青绿,5-ala,焦脱镁叶绿素 a(pyropheophorbide a,pa)在内,各代光敏剂都含有能与核酸分子通过化学手段实现精准共价连接的羟基、羧基或不饱和键,因此它们都能够精准修饰在本发明设计的载药序列上。载药序列可以仅为单个载药位点,可以设计在第二核酸序列的3’端或5’端或不影响第二核酸适体功能性折叠或互补序列相互配对的任意位置。
13、本发明还提供一种光激活双特异性核酸适体嵌合体(pbacs)的制备方法,包括以下步骤:
14、步骤1:设计第一核酸序列和第二核酸序列;所述第一核酸序列包括第一核酸适体序列、第一互补序列;所述第一核酸适体特异性识别并结合细胞表面转运蛋白;所述第二核酸序列包括第二核酸适体序列、第二互补序列、载药序列;所述第二核酸适体特异性识别并结合待降解的膜蛋白靶点;所述第二互补序列与第一互补序列能够实现精准的碱基互补配对;
15、步骤2:在第二核酸序列的载药序列上精准修饰光敏剂;
16、步骤3:将第一核酸序列和第二核酸序列在退火环境下互补配对,制备得到pbacs。
17、优选地,在第二核酸适体精准修饰光敏剂所采用的修饰方法为以下反应的一种:点击化学叠氮化修饰、炔基与叠氮的环加成反应、环炔基与叠氮的环加成反应、非醇醛羰基化合物的缩合反应、巯基与碳碳多键的加成反应或氨基或羧基脱水缩合反应,这些反应是本领域实现核酸序列与光敏剂精准修饰所常用的技术手段。
18、本发明还提供一种光激活双特异性核酸适体嵌合体(pbacs)的使用方法:该pbacs用于开启和强化溶酶体途径的靶向蛋白降解。优选地,pbacs用于肿瘤治疗的相关药物的制备。
19、本发明提供了一种近红外光激活双特异性核酸适体嵌合体,具备通过增强细胞自噬来强化溶酶体途径靶向蛋白降解的潜力。本发明产物能精准靶向细胞膜蛋白,通过近红外光响应开启细胞自噬程序,在细胞自噬程序的促进下显著增强溶酶体降解途径对靶向蛋白的降解能力,大幅降低肿瘤细胞迁移能力、抑制细胞克隆,有效杀伤肿瘤细胞。
20、具体而言:一方面,本发明pbacs可通过溶酶体途径将肿瘤细胞膜蛋白转运到溶酶体中,触发蛋白降解作用;另一方面,在近红外光照射下,光响应反应使肿瘤细胞内ros含量增加,调节细胞氧化应激并触发细胞自噬,细胞自噬程序的启动得以大幅激活溶酶体降解途径的相关反应,显著提高溶酶体对靶标膜蛋白的降解效率,限制肿瘤细胞的迁移和克隆,并通过光动力治疗对肿瘤细胞进行杀伤,提升lytac平台肿瘤治疗功效。
21、本发明通过sgc8-pa和igfiir核酸适体实施例,一方面验证了本发明技术方案精准合成pbacs的相关制备方法的有效性;另一方面,验证了当将pbacs作为药物用于肿瘤治疗时,具有的两个技术效果:(1)igfiir核酸适体能够与细胞表面溶酶体穿梭受体结合,开启溶酶体降解途径;(2)sgc8-pa能够通过点击化学叠氮化修饰进行精确修饰形成,得以识别膜蛋白质靶点和响应近红外光,启动细胞自噬来强化膜蛋白的溶酶体降解。
22、综上所述,本发明构建的pbacs作为一种多功能光触发lytac平台,具有模块化设计精确、制备简单、脱靶副作用小、降解效率高等特点,将为膜蛋白的细胞特异性降解提供一个有前景的转化平台。同时本发明的制备工艺,简单、高效和经济,具有大规模生产的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!