一种TPZ/TPP@RBC-FA脂质体及其在口腔癌治疗中的应用
本发明属于生物医学,具体地,涉及一种tpz/tpp@rbc-fa脂质体及其在口腔癌治疗中的应用。
背景技术:
1、口腔癌是头颈部最常见的恶性肿瘤之一,其中鳞癌占90%以上。全球每年新增口腔癌病例超过40万,其中2/3确诊于发展中国家,其危险因素包括嚼槟榔、吸烟、感染人类乳头瘤病毒和饮酒等。口腔癌大部分病例在晚期才确诊,平均5年生存率低至40%。可见,口腔癌是一个重要的公共卫生问题,是全球最常见的恶性肿瘤之一,具有较高的死亡率。随着医疗水平的提升,口腔癌的生存率不断提高,术后患者的功能恢复良好,但传统癌症治疗的非特异性、非选择性、耐药性和毒性仍然是巨大挑战。
2、近年来,光动力疗法(photodynamic therapy,pdt)由于其低全身毒性和可忽略的耐药性的特点受到了越来越多的关注。除了手术,光动力疗法被视为治疗口腔癌的另一种有效方法。光动力疗法是利用光动力效应进行疾病诊断和治疗的一种新技术。其作用基础是光动力效应。这是一种有氧分子参与的伴随生物效应的光敏化反应。其过程是特定波长的激光照射使组织吸收的光敏剂受到激发,而激发态的光敏剂又把能量传递给周围的氧,生成活性很强的单态氧,单态氧和相邻的生物大分子发生氧化反应,产生细胞毒性作用,进而导致细胞受损乃至死亡。
3、然而,肿瘤微环境中有限的氧气含量降低了当前光动力疗法的效率,如何克服光动力疗法因氧气耗竭导致的肿瘤杀伤不足仍是本领域亟待解决的技术问题之一。
技术实现思路
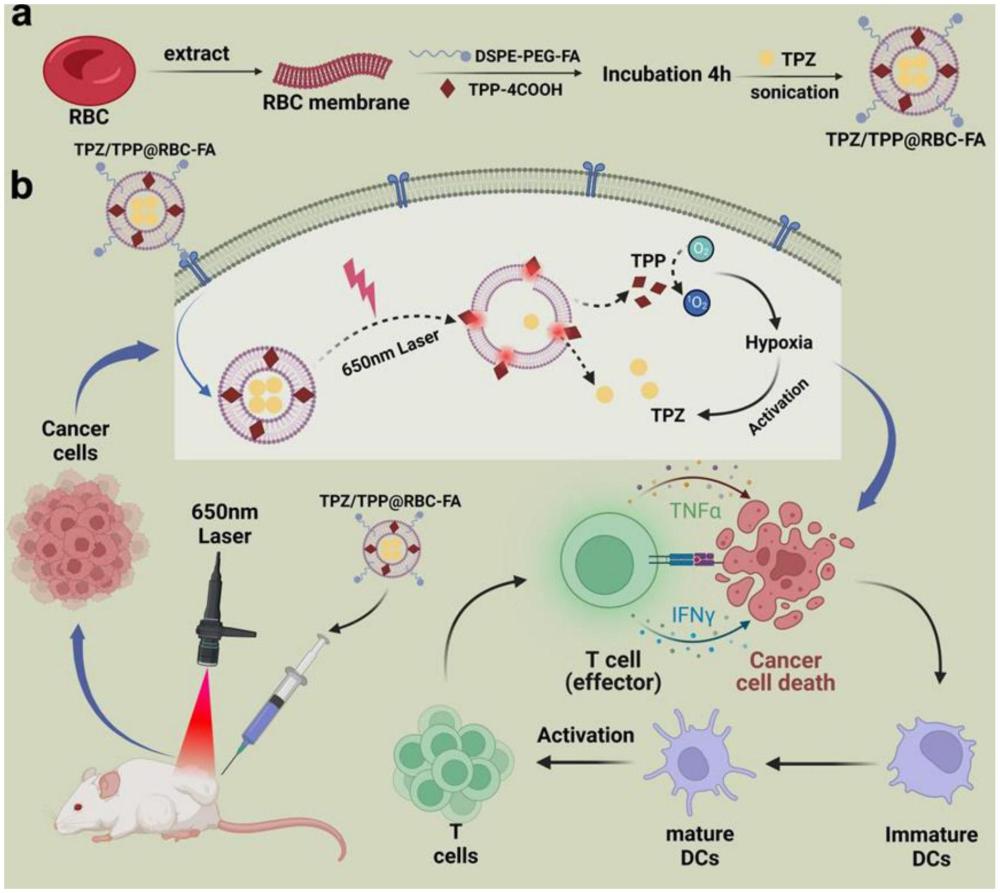
1、有鉴于此,本发明开发了一种互补的肿瘤杀伤系统,通过将乏氧激活的化疗药物引入靶向肿瘤的脂质体,以克服目前现有技术中存在的pdt因氧气耗竭导致的肿瘤杀伤不足这一技术问题。
2、首先,本发明将靶向肿瘤的叶酸(fa)修饰在基于红细胞膜的脂质体表面,并将光敏剂tpp和乏氧激活药物tpz载入脂质体当中(tpz/tpp@rbc-fa)。对肿瘤部位进行激光照射后,tpz/tpp@rbc-fa脂质体中的化疗药物tpz因光动力疗法产生的活性氧(ros)的破膜作用释放,而活性氧是在光动力疗法过程中由氧气生成的,导致肿瘤组织内缺氧加剧,并进一步生成携带有毒自由基的tpz。乏氧激活的化疗与光动力疗法的结合不仅能够有效诱导细胞凋亡,还能引起免疫原性细胞死亡和免疫细胞激活,脂质体载药的策略也显示出良好的生物安全性。相信将光动力疗法和乏氧激活化疗使用脂质体相结合的策略在不久的将来能够应用于临床口腔癌的治疗。
3、本发明采用如下技术方案实现上述发明目的:
4、本发明的第一方面提供了一种tpz/tpp@rbc-fa脂质体的制备方法。
5、进一步,所述方法包括如下步骤:
6、将四羧基卟吩溶液和dspe-peg-fa粉末加入红细胞膜悬液中,避光振荡混合后得到混合溶液a;
7、在所述混合溶液a中加入替拉扎明溶液,避光振荡混合后得到混合溶液b;
8、将所述混合溶液b于冰上超声破碎后得到tpz/tpp@rbc-fa脂质体。
9、在一些实施方案中,所述四羧基卟吩溶液和dspe-peg-fa粉末加入红细胞膜悬液中的加入顺序并无特别限制,包括但不限于:先将四羧基卟吩溶液加入红细胞膜悬液中、再加入dspe-peg-fa粉末;同时将四羧基卟吩溶液和dspe-peg-fa粉末加入红细胞膜悬液中;先将dspe-peg-fa粉末加入红细胞膜悬液中、再加入四羧基卟吩溶液。
10、在本发明中,所述替拉扎明(tirapazamine,tpz)是一种缺氧选择性的细胞毒素,其对应的cas号为27314-97-2,分子式为c7h6n4o2,分子量为178.15,结构式如下式(ⅰ)所示。在缺氧环境下,替拉扎明被还原为一种自由基,引起dna双链断裂(dsbs)、单链断裂和碱基损伤。tpz能抑制dna拓扑异构酶iiα和调节复制蛋白a(rpa),抑制dna复制。另外,tpz还能强力抑制hif-1α表达,通过调节真核启动因子eif2α磷酸化来发挥作用。tpz能诱导神经母细胞瘤细胞凋亡,降低线粒体膜电位和谷胱甘肽水平,这一生理效应可能是p53依赖性的。在本发明中,所述替拉扎明可与tpz互换使用。
11、
12、在本发明中,所述四羧基卟吩(tetrakis(4-carboxyphenyl)porphyrin,tpp-4cooh)可以作为光敏剂参与光化学反应,也可以在光电器件中作为电子传输材料使用。其对应的cas号为14609-54-2,分子式为c48h30n4o8,分子量为790.774,结构式如下式(ⅱ)所示。此外,所述四羧基卟吩还可以通过与其他分子的相互作用,形成具有特定功能的超分子结构,为化学合成和材料制备提供了新的思路和方法。卟吩是一种具有大π共轭体系的有机化合物,而四羧基卟吩则是在卟吩的基础上,通过引入四个4-羧基苯基基团而得到的衍生物。这种结构使得四羧基卟吩具有了许多独特的性质,如较强的吸光性、良好的电子传输性能以及较高的化学稳定性等。在本发明中,所述四羧基卟吩和tpp-4cooh可互换使用。
13、
14、在本发明中,所述dspe-peg-fa的全称为二硬脂酰基磷脂酰乙醇胺-聚乙二醇-叶酸,是一种由磷脂酰乙醇胺(dspe)、聚乙二醇(peg)以及叶酸(fa)共聚合得到的复合物,其中,dspe是一种磷脂质,具有疏水的磷脂酯尾部和亲水的磷脂酰胆碱头部。peg是一种聚合物,具有良好的水溶性。fa是一种能够与叶酸受体结合的分子,能够实现对特定细胞的靶向递送。其对应的cas号为1236288-25-7,结构式如下式(ⅲ)所示。
15、
16、进一步,所述四羧基卟吩溶液的浓度为5-15mg/ml,加入量为7.5-17.5μl;
17、所述dspe-peg-fa粉末的加入量为0.2-3.5mg。
18、进一步,所述四羧基卟吩溶液的浓度为10mg/ml,加入量为12.5μl
19、所述dspe-peg-fa粉末的加入量为1mg。
20、进一步,所述红细胞膜的用量为0.5-3.5mg;
21、可选地,所述红细胞膜的用量为2mg;
22、可选地,所述避光振荡混合后得到混合溶液a中的避光振荡的时间为1-5h;
23、可选地,所述避光振荡混合后得到混合溶液a中的避光振荡的时间为2h。
24、进一步,所述替拉扎明溶液的浓度为5-15mg/ml,加入量为5-15μl;
25、可选地,所述替拉扎明溶液的浓度为10mg/ml,加入量为10μl;
26、可选地,所述避光振荡混合后得到混合溶液b中的避光振荡的时间为10-60min;
27、可选地,所述避光振荡混合后得到混合溶液b中的避光振荡的时间为30min。
28、进一步,所述冰上超声破碎的条件为使用探头超声细胞破碎仪将探头伸入所述混合溶液b液面超声2-8min;
29、可选地,所述冰上超声破碎的条件为使用探头超声细胞破碎仪将探头伸入所述混合溶液b液面超声5min;
30、可选地,所述红细胞膜为纯化的红细胞膜;
31、可选地,所述方法还包括对得到的tpz/tpp@rbc-fa脂质体进行纯化;
32、可选地,所述纯化包括将得到的tpz/tpp@rbc-fa脂质体在磁力搅拌下透析得到纯化的tpz/tpp@rbc-fa脂质体;
33、可选地,所述磁力搅拌的条件为100-300转/分钟、1-3天;
34、可选地,所述磁力搅拌的条件为200转/分钟、2天。
35、在本发明的具体实施方案中,所述纯化的红细胞膜采用如下方法制备得到:取25μl的edta溶液,加入1ml的pbs中制备抗凝液。然后,通过balb/c小鼠眶静脉窦采集小鼠血液,并加入提前准备好的抗凝液中。经2500转/分钟离心后,丢弃上清和残余血细胞,剩下的沉淀就是纯化的红细胞。将纯化的红细胞使用0.25×pbs重悬,在渗透压作用下红细胞会被裂解,在4℃条件下裂解25分钟,然后以12000转/分钟离心,并丢弃上清液以去除裂解红细胞中的血红蛋白及杂质,留下的沉淀就是纯化的红细胞膜。重复三次上述方法裂解和离心后,最终获得纯化的红细胞膜。
36、在一些实施方案中,本发明对所述红细胞膜的来源并无特别限制,其并不局限于本发明具体实施方案中所述的具体方法制备获得的纯化的红细胞膜。采用任何本领域技术人员已知的方法制备得到的纯化的红细胞膜、或任何商品化来源的纯化的红细胞膜均落入本发明的保护范围内。
37、在本发明的具体实施方案中,所述替拉扎明溶液为将上述具体用量的替拉扎明溶解于对应体积的dmso溶液中制备获得,在本发明的具体实施方案中,所述四羧基卟吩溶液为将上述具体用量的四羧基卟吩溶解于对应体积的dmso溶液中制备获得。
38、在一些实施方案中,本发明所述的溶剂类型并不局限于dmso溶液,任何能够用于溶解本发明如前所述的替拉扎明或四羧基卟吩的溶剂均在本发明的保护范围内。在一些实施方案中,所述溶剂包括但不限于:dmso溶液、甲苯、二甲苯、戊烷、己烷、辛烷、环己烷、环己酮、氯苯、二氯苯、甲醇、乙醇、乙醚、醋酸甲酯、丙酮、水、四氯化碳等。
39、在本发明的具体实施方案中,所述对得到的tpz/tpp@rbc-fa脂质体进行纯化采用如下方法进行纯化:裁剪约15cm长度的分子量孔径为1kda的透析袋,用专用夹子夹闭一端,将上述混合液加入透析袋后夹闭另一端,放入盛有1000ml pbs缓冲液的大烧杯中,使用磁力搅拌在200转/分钟的搅拌速度下透析2天,从而去除溶液中未结合的tpz和tpp-4cooh分子,留在透析袋中的物质即为纯化的tpz/tpp@rbc-fa脂质体。
40、本发明的第二方面提供了一种tpz/tpp@rbc-fa脂质体。
41、进一步,所述tpz/tpp@rbc-fa脂质体为将替拉扎明和四羧基卟吩载入叶酸修饰的基于红细胞膜的脂质体中制备得到;
42、可选地,所述tpz/tpp@rbc-fa脂质体为采用本发明第一方面所述的方法制备得到的tpz/tpp@rbc-fa脂质体。
43、本发明的第三方面提供了一种药物组合物。
44、进一步,所述药物组合物包含本发明第二方面所述的tpz/tpp@rbc-fa脂质体。
45、在一些实施方案中,所述药物组合物还可包含药学上可接受的载体和/或赋形剂。
46、在一些实施方案中,所述药学上可接受的载体和/或赋形剂在remington'spharmaceutical sciences(19th ed,1995)中有详细的记载,这些物质根据需要用于帮助药物的稳定性或有助于提高有效成分(有效成分即为本发明如前所述的tpz/tpp@rbc-fa脂质体)的活性,所述物质包括但不限于:稀释剂、表面活性剂、致湿剂、粘合剂、填充剂、崩解剂、吸附载体、润滑剂、稳定剂、杀菌剂、缓冲剂、等渗剂、螯合剂、ph控制剂,如此配制得到的药物组合物根据需要可选择本领域技术人员已知的任何适当的给药方式将所述药物组合物进行给药。
47、在一些实施方案中,所述药学上可接受的载体和/或赋形剂可另外含有液体,诸如水、生理盐水、甘油和/或乙醇等。
48、本发明的第四方面提供了一种药物制剂。
49、进一步,所述药物制剂包含本发明第三方面所述的药物组合物。
50、在一些实施方案中,所述药物制剂的剂型包括但不限于:混悬剂、控制释放制剂、溶液剂、乳剂、片剂、丸剂、粉剂、颗粒剂、胶囊剂、锭剂、糖浆剂、气雾剂、膜剂、注射剂、静脉滴注剂、透皮吸收制剂、软膏剂、洗剂、粘附制剂、栓剂、鼻制剂、肺制剂等,以便患者摄入。
51、在一些实施方案中,所述药物组合物或药物制剂的合适给药方式包括本领域技术人员已知的各种方法和递送系统中的任一种,以将本发明所述的药物组合物或药物制剂物理引入到受试者中,所述给药方式包括但不限于:局部给药、直肠给药、鼻给药、口服给药、非胃肠道给药、通过吸入喷雾给药、颊给药或通过植入的贮药装置给药。
52、本发明的第五方面提供了根据本发明第一方面所述的方法制备得到的tpz/tpp@rbc-fa脂质体在制备用于治疗癌症的药物中的应用。
53、可选地,所述癌症包括口腔癌、鼻咽癌、胃癌、肺癌、结直肠癌、肾癌、卵巢癌、肝癌、乳腺癌、宫颈癌、膀胱癌、结直肠癌、软组织肉瘤、头颈癌、滤泡性淋巴瘤、b细胞淋巴瘤或胰腺癌。
54、此外,本发明还提供了一种用于治疗癌症的方法,所述方法包括给有需要的受试者施用治疗有效量的本发明如前所述的tpz/tpp@rbc-fa脂质体、药物组合物或药物制剂。
55、在一些实施方案中,所述受试者包括一种或多种动物,包括例如,牛、马、绵羊、灵长类动物、禽类和啮齿类动物物种。所述受试者可以是哺乳动物、鸟、鱼、爬行动物或两栖动物。所述哺乳动物包括人或非人哺乳动物。在另一些实施方案中,所述对象可以是小鼠、大鼠、仓鼠、白鼬、沙鼠、兔、猴子、黑猩猩、马、矮种马、驴、绵羊、猪、鸡、山羊、猫或狗。在优选的实施方案中,所述受试者为人。
56、在一些实施方案中,所述治疗通常涉及治疗人类或动物(例如,被兽医所应用),其中可达到某些预期的治疗效果,例如,抑制病症的发展(包括降低发展速度、使发展停止)、改善病症和治愈病症。还包括作为预防措施(例如预防)的治疗。对还没有发展为病症但有发展为该病症危险的患者的用途,也包括在所述术语治疗中。
57、在一些实施方案中,所述治疗有效量是指具有治疗效果的量或在治疗对象中产生治疗效果所需要的量。例如,药物治疗上或药学上有效量是指产生需要的治疗效果所需要的药物的量,治疗效果可以通过临床试验结果、模型动物研究和/或体外研究的结果来反映。药学上有效量取决于几个因素,包括但不限于:治疗对象的特征因素(如身高、体重、性别、年龄和用药史)、罹患疾病的严重程度等。
58、在一些实施方案中,所述癌症包括但不限于:口腔癌、鼻咽癌、胃癌、肺癌、结直肠癌、肾癌、卵巢癌、肝癌、乳腺癌、宫颈癌、膀胱癌、结直肠癌、软组织肉瘤、头颈癌、滤泡性淋巴瘤、b细胞淋巴瘤或胰腺癌。
59、相对于现有技术,本发明具有的有益效果如下:
60、本发明首次创造性地为口腔癌治疗这一技术领域提供了一种全新的tpz/tpp@rbc-fa脂质体,并通过体外细胞实验和体内实验证明了所述tpz/tpp@rbc-fa脂质体在口腔癌治疗中的有效性,所述tpz/tpp@rbc-fa脂质体不仅能够有效诱导肿瘤细胞凋亡,还能引起免疫原性细胞死亡和免疫细胞激活,在口腔癌的临床治疗中具有广阔的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!