视黄醇饱和酶作为靶点在治疗糖尿病肾脏病治疗中的应用的制作方法
本发明涉及生物医药,具体涉及视黄醇饱和酶(retsat)作为靶点在制备治疗糖尿病肾脏病(dkd)药物中的应用。
背景技术:
1、糖尿病肾脏病(dkd)已成为全球慢性肾病和终末期肾病的主要原因。研究表明,大约40%的糖尿病患者面临发展为dkd的风险。预计到2050年,全球将有超过13.1亿人可能受到糖尿病的影响,这突显了dkd作为一个重要临床问题所带来的日益严峻的挑战。传统观念认为,肾小球中系膜胶原合成的增加导致系膜细胞外基质(ecm)的积累,在dkd的发病中起着重要作用。然而,越来越多的研究发现,dkd的发病机制不仅仅涉及肾小球功能障碍,还包括了肾小管间质病变。近期研究发现,近端小管细胞而非肾小球细胞在调节肾小球滤过中起着关键作用。近端小管细胞是肾脏增大和高滤过的主要贡献者。在晚期dkd中,肾小管细胞的丧失与肾小球滤过率(egfr)的下降密切相关。dkd的病理改变包括结节性或弥漫性肾小球硬化、小管炎症、萎缩和间质纤维化,其中,小管间质纤维化(tif)是慢性肾病的重要病理特征,被认为是导致终末期肾病的常见最终途径,其特点是肾功能完全丧失。然而,dkd中驱动tif的分子机制仍不完全明了。研究表明,在dkd的早期阶段,肾小管上皮细胞的肥大和增生与小管基底膜的增厚同时发生,进而由于血糖水平的持续升高,加上缺血和缺氧,导致小管细胞凋亡、小管萎缩和退化,促进了tif的进展,最终导致dkd进展到终末期肾功能衰竭。由于肾小管损伤及后续的tif在dkd发生发展中起着至关重要的作用,寻找dkd肾小管损伤的治疗靶点成为了dkd治疗的希望。
2、视黄醇饱和酶(retsat)是一种氧化还原酶,在人类和啮齿动物同源物中具有保守的蛋白质序列和基因组,并在脂肪组织、肝脏和肾脏中高表达。细胞内的retsat蛋白主要定位于内质网,可以催化视黄醇转化为13,14-二氢视黄醇(13,14-dhretinol)。retsat的主要转录调控因子包括肝脏中的核过氧化物酶增殖物激活受体α(pparα),脂肪组织中的pparγ以及原代肝细胞中的叉头盒o1(foxo1)。然而,近期研究表明,retsat的功能可能远超其传统定义的范围。有研究发现retsat表达水平在胰岛素抵抗和2型糖尿病相关疾病中受到动态调节,且retsat功能与脂肪细胞分化、肝葡萄糖和脂肪酸代谢以及巨噬细胞吞噬作用有关。例如,retsat可以参与脂肪肝的发生,并通过调节碳水化合物反应元件结合蛋白(chrebp)调控肝脏糖脂代谢,并且retsat对chrebp的调节不依赖于其酶催化产物二氢视黄醇的形成。此外,人类肝脏中的retsat表达与肥胖、肝脂肪变性和chrebp靶基因的表达密切相关。既往研究还表明,高葡萄糖诱导的o-glcnac糖基化修饰的chrebp在系膜细胞中参与介导脂肪生成和纤维化。
3、尽管retsat在上述代谢调节中发挥重要作用,但其在肾脏病理生理中的具体作用和调控机制,特别是在dkd发病中的作用仍不明确。因此,本领域迫切需要开发新的dkd的缓解和治疗策略。
技术实现思路
1、本发明针对上述问题进行,对视黄醇饱和酶作为靶点在治疗糖尿病肾脏病治疗中的应用进行研究:首先确认retsat异常表达对dkd的不利影响,然后基于该靶点观察retsat异常表达消除或缓解后肾脏细胞损伤的恢复情况,进而确定retsat在dkd的发病和进展中的作用。
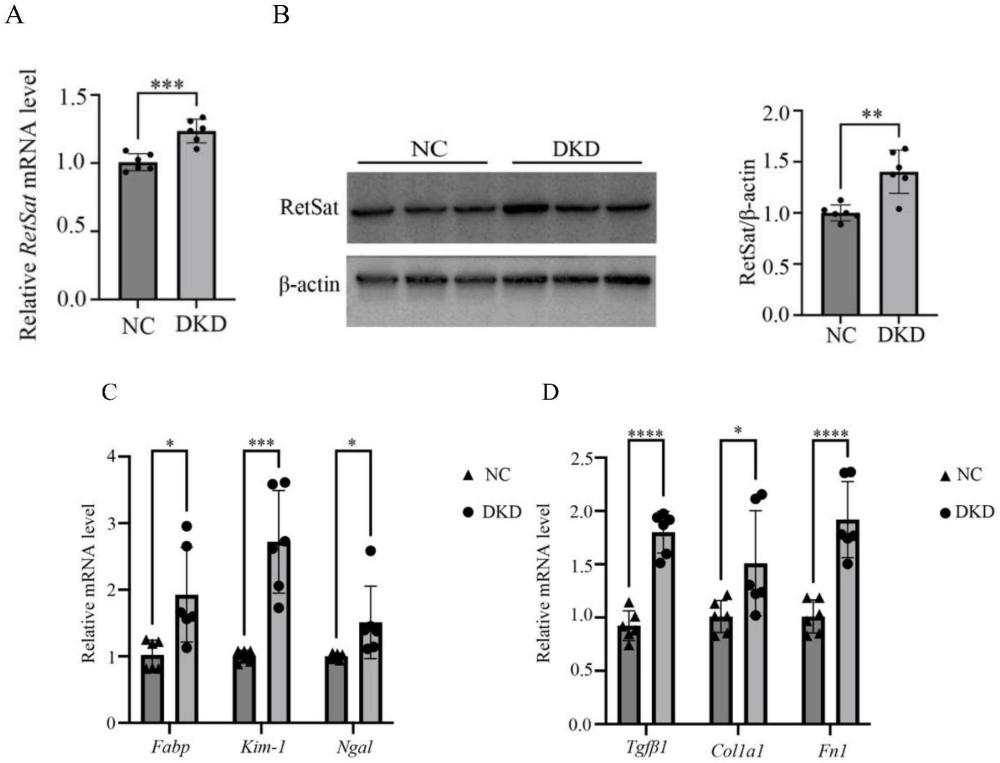
2、具体研究过程如下:首先与对照组相比,dkd患者及dkd小鼠模型均呈现出肾小管损伤及纤维化的异常增加,同时发现dkd患者及小鼠模型的肾脏retsat表达较对照组显著上调。为了进一步证实retsat的表达水平与dkd中肾小管损伤的关联,用高糖刺激人肾小管细胞株hk2后再次检测肾小管细胞中retsat的表达,结果发现,高糖可诱导肾小管细胞hk2中retsat的表达,且伴有肾小管损伤标志物及纤维化基因的表达增多。随后在hk2细胞中过表达retsat及转染sirna抑制其表达,结果显示,retsat过表达可以显著增加肾小管细胞中肾小管损伤标志物及纤维化基因的表达水平,抑制其表达后则可有效降低肾小管细胞损伤。因此,研究认为retsat可以通过调控肾小管损伤参与dkd的发生发展,retsat有望作为dkd肾小管损伤的治疗靶点进入临床应用。
3、基于上述研究,本发明的具体保护技术方案如下:
4、本发明的第一方面,提供了retsat抑制剂在制备治疗糖尿病肾脏病或其并发症药物中的用途。
5、优选的,所述retsat抑制剂选自抑制视黄醇饱和酶活性或功能的化合物或靶向retsat编码序列的干扰rna或反义寡核苷酸。
6、进一步优选,靶向retsat编码序列的干扰rna或反义寡核苷酸的序列如下任一所示:
7、5’-ccaacuacuauguuuacuatt-3’(seq id no.1);
8、5′-uaguaaacatagtagttggtt-3′(seq id no.2)。
9、细胞实验结果显示,retsat过表达可以显著增加肾小管细胞中肾小管损伤标志物(retsat、fabp、kim-1、ngal)及纤维化基因(tgfβ1、col1a1、fn1)的表达水平;抑制retsat表达后,肾小管细胞中肾小管损伤标志物及纤维化基因的表达水平则显著下调。
10、本发明第二方面,提供了一种靶向retsat的重组载体,包括表达载体以及插入设置在该表达载体上的retsat基因的sh rna或si rna,sh rna或si rna的核酸序列如上seqid no.1或2所示。
11、其中,所述表达载体为质粒载体、粘粒载体、噬菌体载体或病毒载体等常规载体,具体种类根据实际情况从现有技术中选择。所述的“病毒载体”,包括腺相关病毒和慢病毒。合适的病毒载体是本领域普通技术人员所熟知的。其余的“非病毒载体”,包括脂质体或脂类复合物、阳离子多聚物、壳聚糖聚合物及纳米粒子载体等。合适的非病毒载体是本领域普通技术人员所熟知的。
12、相应的,本发明也提供了抑制retsat基因的重组表达载体在制备治疗糖尿病肾脏病药物中的用途。
13、本发明第三方面,提供了一种治疗糖尿病肾脏病的药物组合物,包括活性组分以及药学上可接受的辅料,所述活性组分包括如上所述的retsat抑制剂,或者抑制retsat基因的重组表达载体。
14、药物形式方面,适于通过选自下组方式给予的药物或药物组合物:口服、注射(例如直接裸dna或蛋白质注射法、脂质体包裹dna或mrna注射法)、金包被基因枪轰击法、复制缺陷腺病毒携带目的dna法或目的基因所编码蛋白质、灌肠给药、透皮给药。
15、通常情况下,液体制剂可以在2℃-8℃条件下保存至少稳定一年,冻干制剂在30℃至少六个月保持稳定。制剂可为制药领域常用的混悬、水针、冻干等制剂。
16、本发明中的组合物在对包括人在内的动物给药时,给药剂量因病人的年龄和体重、疾病特性和严重性、以及给药途径而异,可以参考动物实验的结果和种种情况,总给药量不能超过一定范围。
17、进一步,本发明的药物组合物可和其他治疗糖尿病肾脏病或其它并发症的药物组合物联用。
18、本发明的第五方面,提供了检测retsat表达水平的试剂在制备糖尿病肾脏病检测试剂盒或药物筛选试剂盒中的应用。
19、实验结果显示,retsat的表达在dkd患者中显著上调,retsat抑制表达缓解了高糖诱导的肾小管细胞hk2中的病理表现,提示retsat是dkd的促进因子,具有促进dkd发生发展的作用。据此可推断retsat可作为dkd的诊断标志物或药物筛选标志物。
20、以retsat作为标志物进行药物筛选的方法如下:
21、(a)用候选物质处理dkd或模拟dkd症状的细胞、组织或动物;
22、(b)检测所述细胞、组织或动物中retsat或编码该蛋白质的核酸分子的水平;
23、(c)候选物质处理后,若retsat或编码该蛋白质的核酸分子的水平低于dkd模型组织或细胞中的retsat表达水平,则表明所述候选物质具有通过抑制retsat来治疗dkd的作用。
24、本发明的第六方面,提供了一种dkd诊断试剂盒或药物筛选试剂盒,该试剂盒包含了检测生物样品中retsat表达水平的试剂,由逆转录系统、引物系统和扩增系统组成。通过检测retsat的核酸表达水平,实现诊断或药物筛选。
25、其中,生物样品选自肾脏组织或肾脏细胞hk2,对肾脏组织中retsat具有检测特异性的引物序列如下seq id no.3和4所示;对肾脏细胞hk2中retsat具有检测特异性的引物序列如seq id no.19和20所示:
26、retsat-f1:5’-gtctacgtgggcctttacg-3’(seq id no.3);
27、retsat-r1:5’-actttcttcctagcctccttgt-3’(seq id no.4);
28、retsat-f2:5’-cagcattggccgttttatcttg-3’(seq id no.19);
29、retsat-r2:5’-ccttgaggccctgaatgtagg-3’(seq id no.20)。
30、本发明的有益保障及效果:
31、本发明提供了retsat抑制剂在制备治疗dkd或其并发症药物中的用途,通过实验证实,dkd患者及dkd小鼠模型均呈现出肾小管损伤及纤维化的异常增加,同时发现dkd患者及小鼠模型的肾脏retsat表达较对照组显著上调,抑制其表达后则可有效降低肾小管细胞损伤,提示retsat是dkd的致病因子,具有加重dkd病理损伤的作用。因此本发明针对retsat的抑制,为dkd的治疗提供了新的靶点和依据,具备广阔的临床应用前景。
- 还没有人留言评论。精彩留言会获得点赞!