用于人造神经导管的聚吡咯壳聚糖载药纤维膜及其制备方法
本发明属于组织工程领域,涉及一种用于人造神经导管的聚吡咯壳聚糖载药纤维膜及其制备方法。
背景技术:
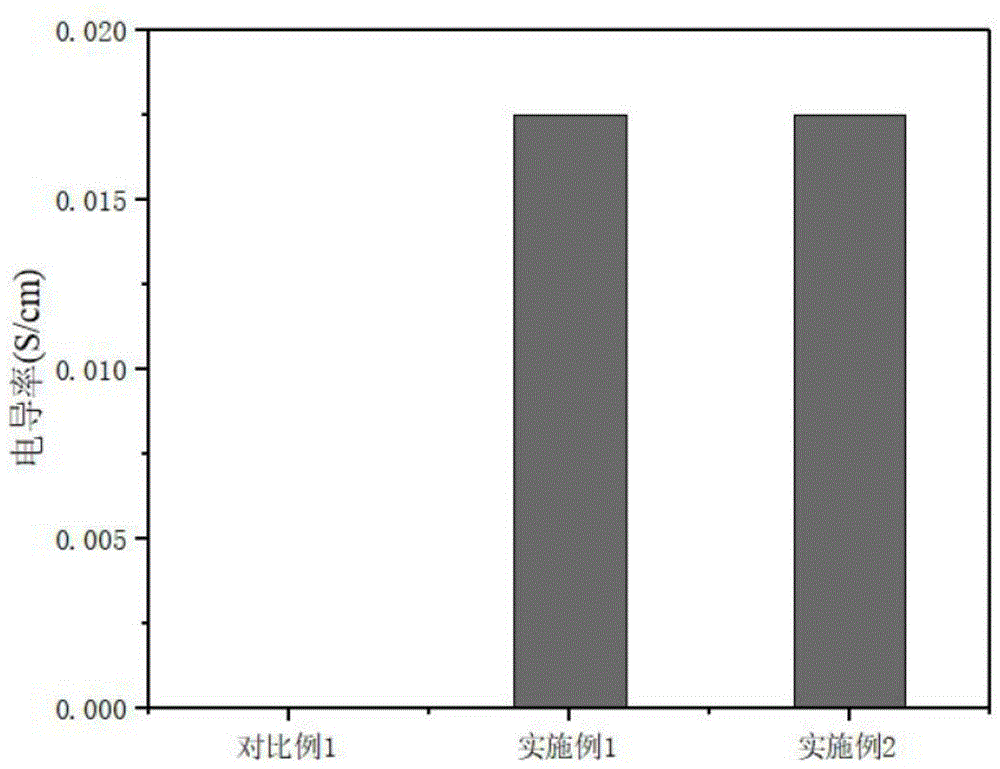
:组织工程旨在开发功能受损的组织和器官的替代品。移植前,通常将细胞播种在生物材料支架上,该支架可模拟细胞外基质,并为细胞提供对组织发育重要的信息。组织工程学是一个新兴的交叉学科领域,其应用生物学和工程学原理来开发可恢复、维持或改善组织功能的生物学替代品。它通常需要一个支架来为细胞迁移、附着和增殖提供过渡性的三维支持,并提供用于运送生化因子的载体。支架还应提供机械和生物学影响,以指导细胞的成熟和整合以形成组织。因此,组织工程中的主要挑战是设计和制造合适的支架来满足该领域不断增长的需求。周围神经系统损伤后具有修复和再生的内在能力。功能再生需要轴突再生和雪旺细胞对再生轴突的再髓鞘再生。包括神经营养因子、细胞外基质蛋白和激素在内的多种因素参与了雪旺细胞的去分化、增殖和髓鞘再生。模拟天然细胞外基质的静电纺丝神经导管提供了恢复组织功能或实现组织再生的有利支架材料促进细胞募集/播种、粘附、增殖、分化和新组织发生。电纺纤维的大表面积及其多孔结构有利于细胞粘附、增殖、迁移和分化。如有必要,可以通过掺入生物活性物质(例如酶、dna和生长因子)或者药物使纤维进一步功能化,以更好地控制植入支架的细胞的增殖和分化。这些特性使电纺纤维非常适合用作组织工程的支架。但是用于溶解可降解高分子如pla、plga和pcl等的电纺液通常为有机溶剂对生物活性物质有一定破坏。壳聚糖的生产成本低,具有良好的可生物降解性和生物相容性,离子交联法制备壳聚糖微球,条件温和,用于药物或者生物活性分子的载体非常合适。ngf这种生物活性类的蛋白比较容易变性,在被包载的过程中首先通过温和的方法被包载在壳聚糖微球中,再加入静电纺丝液中被高压电纺,有壳聚糖微球的保护就保证了生物活性。聚乳酸(pla)/聚乳酸-羟基乙酸共聚物(plga)/聚几内酯(pcl)等高分子聚合物的生物相容性、可降解性和高机械强度非常适合制备用于神经组织工程的静电纺丝纤维膜,并且同时负载药物和载药微球。聚吡咯涂层可以使纤维膜变得可以导电,通过原位聚合法在纤维表面涂覆聚吡咯涂层的方法条件温和,引入杂质少,适合组织工程膜的涂覆。通过对导电纤维膜施加生物电刺激可以加快神经修复的速度。鉴于以上所述,对壳聚糖载药微粒、静电纺丝和聚吡咯导电材料的研究,构建一种可用于制造神经导管的聚吡咯壳聚糖载药纤维膜可以提高植入后低频电刺激促进神经再生的可能。技术实现要素:本发明的目的在于针对现有技术可降解高分子聚合物材料导电性能较差、载药生物活性低的缺点,提供一种用于人造神经导管的聚吡咯壳聚糖载药纤维膜的制备方法,通过该方法制备的纤维膜可持续释放药物且具备良好的导电性。本发明的目的通过下述技术方案实现:一种用于人造神经导管的聚吡咯壳聚糖载药纤维膜的制备方法,包括如下步骤:将壳聚糖载药微球或布洛芬加到高分子聚合物溶液中得到载药纺丝液,载药纺丝液通过静电纺丝得到载药纤维膜,在载药纤维膜表面涂覆聚吡咯涂层得到所述的聚吡咯壳聚糖载药纤维膜。优选地,所述的壳聚糖载药微球中的药物为生物活性物质,如酶、dna、生长因子等。优选地,所述的壳聚糖载药微球通过离子凝胶法制备得到:将壳聚糖溶解于乙酸溶液中,调节ph至4.5~5.5,加入药物使其溶解得到药物和壳聚糖的混合溶液;将三聚磷酸钠(tpp)溶液滴加到药物和壳聚糖的混合溶液中搅拌得到壳聚糖载药微球混悬液;混悬液离心后通过冷冻干燥得到壳聚糖载药微球。更为优选地,所述的壳聚糖载药微球通过离子凝胶法制备得到:将壳聚糖溶解于1~3%(v/v)的乙酸溶液中配制得到浓度为1~2mg/ml的壳聚糖溶液,用naoh溶液调节壳聚糖溶液ph至4.5~5.5,加入药物搅拌使其溶解,得到药物和壳聚糖的混合溶液;将0.5~1.5mg/ml的tpp溶液加匀速滴加到以400~800rpm转速搅拌的药物和壳聚糖的混合溶液中,滴加完毕后继续搅拌得到壳聚糖载药微球混悬液;混悬液离心后通过冷冻干燥得到壳聚糖载药微球。其中,药物与壳聚糖的质量比为0.5~1:1,tpp与壳聚糖的质量比为1:4~6。优选地,所述的高分子聚合物为聚乳酸(pla)、聚乳酸-羟基乙酸共聚物(plga)、聚几内酯(pcl)等具有生物相容性、可降解性和高机械强度的高分子聚合物。优选地,所述的用于人造神经导管的聚吡咯壳聚糖载药纤维膜的制备方法,包括如下步骤:(1)载药纺丝液的制备:将高分子聚合物溶解于三氯甲烷和n,n-二甲基甲酰胺(dmf)组成的混合溶液中得到纺丝液,再加入壳聚糖载药微球或布洛芬,溶解后得到含药物(生物活性因子)载药纺丝液或含布洛芬的载药纺丝液。其中,所述的混合溶液中三氯甲烷和dmf的体积比优选为2~3:1;所述的纺丝液中高分子聚合物的浓度优选为8~18%(质量分数);所述的载药纺丝液含药物(生物活性因子)浓度优选为0.1%~0.3%或含布洛芬浓度优选为1%~3%。(2)静电纺丝:将载药纺丝液转移至注射器中,放入静电纺丝装置的推进器中,设置推进速度和电压,在接收器上包一层锡纸后开始电纺,在转筒接收器上固定锡纸通过往复平台收集纺丝膜,即得到载药纤维膜。(3)聚吡咯载药纤维膜的制备:将载药纤维膜浸入含吡咯、十二烷基苯磺酸(dbsa)、三氯化铁浓度的溶液中,振荡使聚吡咯涂层涂覆在纤维膜上,去离子水冲洗后烘干得到聚吡咯载药纤维膜。其中,吡咯、dbsa、三氯化铁浓度分别优选为0.003~0.006mol/l、0.003~0.013mol/l、0.013~0.053mol/l;振荡的时间优选为3~24小时。优选地,步骤(2)中的纺丝参数为:注射器推进参数4~10μl/ml,针头到转筒的距离16~18cm,转筒速度200~400r/min,高压电源15~20kv。优选地,步骤(3)为:将载药纤维膜浸入到0.01~0.04mol/l的吡咯溶液中,加入等体积0.01~0.02mol/l的dbsa溶液,低速80~120rpm震荡10~20min后加入等体积0.04~0.16mol/l的三氯化铁溶液,继续振荡3~24小时,去离子水冲洗后25~40℃烘箱烘干得到聚吡咯载药纤维膜。振荡期间保持避光和4~10℃的低温。吡咯溶液、dbsa溶液、三氯化铁溶液体积比为1:1:1。更为优选地,步骤(3)为:分别配制一定浓度的吡咯溶液、十二烷基苯磺酸溶液和三氯化铁溶液的溶液:取4~16μl的吡咯液体溶于5ml的去离子水得到0.01~0.04mol/l的吡咯溶液,取160~320μl的dbsa液体溶于50ml的去离子水得到0.01~0.02mol/l的dbsa溶液,取0.324~1.296g三氯化铁固体溶于50ml的去离子水得到0.04~0.16mol/l的三氯化铁溶液。将载药纤维膜浸入吡咯溶液,加入等体积的dbsa溶液,低速100rpm震荡10min后加入等体积的三氯化铁溶液,继续低速震荡3~24小时,期间保持避光和4~10℃的低温。取出纤维膜,使用去离子水冲洗,放入30℃烘箱烘干,得到聚吡咯载药纤维膜。一种用于人造神经导管的聚吡咯壳聚糖载药纤维膜,通过上述制备方法得到。本发明的有益效果在于:本发明提供了一种简单快速生产可用于制备人造神经导管的聚吡咯壳聚糖载药纤维膜的方法,壳聚糖具有良好的可生物降解性和生物相容性,ngf这种生物活性类的蛋白比较容易变性,在被包载的过程中首先通过温和的离子交联法被包载在壳聚糖微球中,再加入静电纺丝液中被高压电纺,有壳聚糖微球的保护就保证了生物活性。聚乳酸(pla)/聚乳酸-羟基乙酸共聚物(plga)/聚几内酯(pcl)等高分子聚合物的生物相容性、可降解性和高机械强度非常适合制备用于神经组织工程的静电纺丝纤维膜,并且同时负载药物和载药微球。聚吡咯涂层的引入可以使纤维膜变得可以导电,通过原位聚合法在纤维表面涂覆聚吡咯涂层的方法条件温和,引入杂质少,适合组织工程膜的涂覆。通过对导电纤维膜施加生物电刺激可以加快神经修复的速度。附图说明图1是实施例1、2和对比例1所得纤维膜的电导率测试结果。图2是实施例1所得纤维膜的扫描电子显微镜照片。图3是实施例1所得纤维膜的药物释放曲线。图4是实施例2所得纤维膜的药物释放曲线。具体实施方式下面结合附图和实施例对本发明做进一步详细的描述,但本发明的实施方式不限于此。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。实施例1(1)称取50mg壳聚糖粉末溶解于50ml1%(v/v)的乙酸溶液中,500rpm搅拌过夜使得壳聚糖充分溶解,用naoh溶液调整ph到5.0后加入50mg牛血清白蛋白bsa(药物模型蛋白),100rpm搅拌使其完全溶解,得到bsa和壳聚糖的混合溶液。(2)配制1.0mg/ml的三聚磷酸钠(tpp)溶液,使用胶头滴管吸取一定量的tpp溶液速度匀速滴加进500rpm搅拌的(1)中的bsa和壳聚糖的混合溶液,加入的tpp与壳聚糖的质量比例为1:4,滴加完毕后继续搅拌得到载bsa的壳聚糖微球混悬液。(3)将(2)中的混悬液转移到离心管,离心后将沉淀层用冷冻干燥机冻干,得到干燥的载bsa的壳聚糖微球。(4)称取0.7g聚乳酸(pla)溶解于4ml三氯甲烷和dmf(v/v,3:1)的混合溶液里,加入0.02g载bsa的壳聚糖微球搅拌过夜,得到一定质量分数的纺丝液,将纺丝液转移至注射器中,放入静电纺丝装置的推进器中,设置推进速度和电压,在接收器上包一层锡纸后开始电纺,通过调整速度、电压、距离的大小得到稳定的纺丝。收集载药静电纺丝膜并放入30℃干燥箱48h。纺丝参数为:(5)将以(4)中制备得到的载药纺丝膜浸入一定浓度的吡咯溶液、十二烷基苯磺酸溶液和三氯化铁溶液:0.02mol/l的吡咯溶液,0.01mol/l的dbsa溶液,0.08mol/l的三氯化铁溶液。将一张纺丝膜方片浸入1ml的吡咯溶液,加入1ml的dbsa溶液,100rpm震荡10min后加入1ml的三氯化铁溶液,继续低速震荡4小时。取出纺丝膜方片,使用去离子水冲洗后30℃烘箱烘干,得到聚吡咯壳聚糖载药纤维膜。实施例2实施例2与实施例1中的步骤相同,不同的在于在步骤(1)中不加入bsa,步骤(4)在纺丝液中加入0.04g布洛芬粉末搅拌均匀。对比例1制备方法与实施例1相同,不同的是不经过步骤(5)处理。对比例2制备方法与实施例1相同,不同的在于在步骤(1)中不加入bsa。对比例3制备方法与实施例1相同,不同的在于在步骤(1)中不加入bsa,且不经过步骤(5)处理。对实施例1、实施例2和对比例1得到的纤维膜进行电导率测试,对实施例1得到的纤维膜进行扫描电子显微镜表征,对实施例1和实施例2得到的纤维膜进行体外释药试验,对实施例1和实施例2得到的纤维膜进行浸提液体外细胞毒性测试,对实施例1、实施例2和对比例3得到的纤维膜进行电刺激细胞实验。体外释药实验过程:使用分析天平称量一定质量的实施例1、2和对比例2得到的纤维膜,对比例2作为空白对照进行实验。将纤维膜置于4ml的ph7.4的pbs缓冲液中,37℃恒温孵育进行药物缓释,在指定时间间隔内取出4ml的释放液,再添加4ml的新鲜pbs缓冲液,所取的药物缓释样品用考马斯亮蓝-酶标仪法和紫外分光光度法分别测试bsa和布洛芬的吸光度,根据标准曲线计算bsa和布洛芬的释放率,并做出释放曲线。浸提液体外细胞毒性测试过程:将实施例1和实施例2得到的纤维膜剪成12cm2,放入75%乙醇浸泡晾干,并紫外照射2小时灭菌处理,pbs缓冲液充分润洗三次后,将纤维膜浸泡在配制好的2mldmem培养基中,24小时后取出培养基并用0.22μm的滤头过滤,得到浸提液,密封备用。雪旺细胞培养到一定的密度后,使用胰酶将其消化下来并计数,配制好一定浓度的细胞液,以1×104个细胞/孔的密度接种在96孔板内。细胞接种在孔板内24小时全部铺展开后吸走培养基,加入浸提液开始培养,加入普通dmem培养基的孔为对照组。在24小时弃去浸提液和培养基,pbs洗两遍之后每孔避光加入180μl培养基和20μlmtt的混合液,37℃孵育4小时后小心吸走上清液,加入150μl的二甲亚砜(dmso)溶解底部蓝紫色结晶,放入摇床低速震荡10分钟,取100μl溶解液于96孔板,用酶标仪在490nm处检测吸光度,计算细胞增殖率,评估材料毒性等级。电刺激细胞实验:将实施例1、2和对比例3得到的纤维膜剪成4cm2,包在直径1.5cm的细胞爬片上卡进24孔板每孔板底固定,加入75%乙醇浸泡晾干,并紫外照射2小时灭菌处理,pbs缓冲液充分润洗三次后,加入一定量的dmem培养基浸润24小时,然后弃去培养基备用。雪旺细胞培养到一定的密度后,使用胰酶将其消化下来并计数,配制好一定浓度的细胞液,以4×103个细胞/孔的密度接种在浸润好的24孔板内的纤维膜上,细胞贴壁生长完全铺开在膜上之后进行电刺激,对比例3作为空白对照。在24小时弃去培养基,pbs洗两遍之后每孔避光加入180μl培养基和20μlcck-8的混合液,37℃孵育1小时后取100μl混合液于96孔板,弃去24孔板里剩下的混合液,用pbs洗三遍,加入新的培养基。用酶标仪在450nm处检测96孔板内的混合液的吸光度,计算细胞增殖率。电导率结果如图1所示,对比例1所得纤维膜的电导率为0,因为聚乳酸材料本身不导电,实施例1和2所得纤维膜都具有一定的导电性,电导率达到了1.75×10-2s/cm,这是因为导电材料聚吡咯的涂覆。扫描电子显微镜表征结果如图2所示,实施例1所得纤维膜的电镜扫描结构为均匀的纤维状,表面涂覆有聚吡咯材料而表现出一些不平滑。体外释药试验结果如图3和图4所示,图3为bsa释放曲线图,在第28天释放量达到75%;图4为布洛芬释放曲线图,在第28天释放量达到80%。细胞毒性测试结果如表1所示。表1实施例1和2所得纤维膜的细胞毒性实验结果实施例实施例1实施例2细胞增殖率/%(n=3)102.3104.5材料毒性等级00电刺激细胞实验结果如表2所示。表2实施例1和2所得纤维膜的电刺激细胞实验结果实施例实施例1实施例2细胞增殖率/%(n=3)124.9125.6最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明做了详细说明,本领域的技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1