一种利用可控接枝技术提高材料表面血液相容性的方法与流程
本发明涉及一种具有抗蛋白吸附材料,特别是涉及一种利用可控接枝技术提高材料表面血液相容性的方法,是一种具有抗蛋白吸附材料表面的制备方法。
背景技术:
生物相容性是指生物医用材料与生物体之间的相互作用而产生的各种物理化学反应,是生物医用材料最重要的特性之一,生物相容性的优劣直接决定该材料是否能应用于生物体。对于与血液接触的材料来说,材料表面血液相容性较差,蛋白质(如纤维蛋白原(Fg)、人血白蛋白(HSA)等)在材料表面的不可控的、非特异性的吸附会引起一系列不良反应,如凝血、溶血、血栓等现象。于是制备具有优异血液相容性的材料表面显得非常有意义。
目前用提高材料表面抗蛋白吸附能力的最为普遍的是PEG,然而PEG在一定环境中的降解性限制了其在很多领域的应用。聚乙烯基吡咯烷酮(PVP)是一种具有优异水溶性、良好生物相容性和化学稳定性的高分子聚合物,是由单体N‐乙烯基吡咯烷酮在一定条件下聚合而成,已广泛应用于生物、医药、食品、材料等领域。聚乙烯基吡咯烷酮(PVP)已开始被广泛应用于制备优异血液相容性的材料表面。于是利用其提高材料表面的抗蛋白吸附性能,改善材料表面血液相容性成为了研究的热点。目前研究人员采用的现有的这些修饰方法可以将聚乙烯基吡咯烷酮(PVP)接枝于材料表面,但都不能控制接枝密度和接枝链长,因而无法研究这两个因素对聚乙烯基吡咯烷酮改善基材抗蛋白非特异性吸附性能的影响,然而上述两个因素被认为是影响着材料抗蛋白非特异性吸附性能的重要因素。
技术实现要素:
本发明的目的在于克服现有技术存在的问题,提供一种利用可控接枝技术 提高材料表面血液相容性的方法,该方法可控制接枝密度和接枝链长。
本发明先合成巯基化聚乙烯基吡咯烷酮,利用该巯基与金的化学反应,将聚合物接Au表面,提高材料表面抗蛋白吸附性能,制备具有优异血液相容性材料表面。
可逆加成断裂链转移聚合采用的RAFT试剂SC(Z)S-R,R基团末端含有羧基,其结构式为:
既含氨基又含巯基的化合物NH2(CH2)nSH的结构式为:其中该化合物的n取值如何界定;n=1‐6。
食人鱼洗液(piranha溶液);巯基化聚乙烯基吡咯烷酮(HS-PVP)
本发明的目的通过以下技术方案实现:
一种利用可控接枝技术提高材料表面血液相容性的方法,包括如下步骤:
1)将单体NVP、RAFT试剂和溶剂乙腈置于容器中,加入引发剂AIBN,混合均匀;
2)进行液氮除氧,在60-80℃的恒温油浴中反应,经过5-48h聚合后,放入液氮骤冷终止反应;产物加入无水乙醚进行沉淀;沉淀产物放在常温真空干燥箱至恒重,得到PVP-COOH;
3)将PVP-COOH、DCC和NHS混合;在氮气氛围下向混合物中加入干燥的二氯甲烷,在冰水浴条件下反应0.5-3h;
4)加入巯基乙胺,常温下避光反应6-18h;将溶剂蒸发干净,得到粗制样品;
5)将步骤4)得到的粗制样品溶于水,在避光下使用去氧水透析,然后冷冻干燥得到HS-PVP;
6)将金片表面利用piranha溶液进行处理;
7)以乙醇为溶剂,溶解所述HS-PVP,得HS-PVP溶液;
8)将HS-PVP溶液置于PE管中,放入步骤6)得到的金片,使金片与巯基间进行化学吸附反应;
9)将步骤8)的金片取出,利用去离子水和乙醇充分清洗,得到具有优异血液相容性材料表面。
为进一步实现本发明目的,优选地,所述RAFT试剂与单体NVP的摩尔比为1:20-1:500。
优选地,所述引发剂AIBN与RAFT试剂的摩尔比为1:2-1:20。
优选地,所述PVP-COOH、DCC与NHS的摩尔比为1:1:1.2-1:4:4.8。
优选地,以每克PVP-COOH计,所述二氯甲烷的用量为2-20ml。
优选地,所述PVP-COOH与巯基乙胺摩尔比为1:1-1:3。
优选地,所述透析时间为12-48h,每隔2-4h换一次水;所述液氮除氧的次数为3-5次。
优选地,所述piranha溶液中双氧水与浓硫酸的体积比为3:7,处理时间为5-15分钟。
优选地,所述HS-PVP(巯基化聚乙烯基吡咯烷酮)的浓度为1mg-50mg/ml。
优选地,所述金片与巯基间进行化学吸附反应的时间为0.5-3小时,温度为25-37℃,反应中氧含量低于2ppm,且避光。
本发明与现有技术相比,具有如下优点:
(1)本发明制备具有优异血液相容性材料表面,抗蛋白吸附性能和生物相容性能优异;
(2)本发明制备的具有优异血液相容性材料表面具有良好的化学稳定性,不易降解;
(3)本发明制备的具有优异血液相容性材料表面可以抑制95%的人血白蛋白和约85%的纤维蛋白原在其表面的粘附。
(4)本发明可以控制接枝分子的接枝链长,可以得到不同接枝分子量修饰的材料表面。
附图说明
图1‐1为空白金面XPS测试C谱图
图1‐2为空白金面XPS测试N谱图;
图1‐3为空白金面XPS测试O谱图;
图2‐1为实施例1中PVP修饰后金面XPS测试C谱图;
图2‐2为实施例1中PVP修饰后金面XPS测试N谱图;
图2‐3为实施例1中PVP修饰后金面XPS测试O谱图;
图3‐1为实施例1人血白蛋白HSA吸附量测试结果图;
图3‐2为实施例2人血白蛋白HSA吸附量测试结果图;
图3‐3为实施例3人血白蛋白HSA吸附量测试结果图;
图4‐1为实施例1纤维蛋白原Fg吸附量测试结果图;
图4‐2为实施例2纤维蛋白原Fg吸附量测试结果图;
图4‐3为实施例3纤维蛋白原Fg吸附量测试结果图。
具体实施方式
为了更好理解本发明,下面结合实施例对本发明做进一步地说明,但是本发明要求保护的范围并不局限于实施例子表示的范围。
实施例1
一种利用可控接枝技术提高材料表面血液相容性的方法,包括如下步骤:
(1)称量单体NVP(4ml,0.0371mol),RAFT试剂(0.2402g,6×10-4mol),4ml溶剂乙腈置于安培瓶中,最后加入0.028g引发剂AIBN,混合均匀,对安培瓶进行液氮除氧三次,在70℃的恒温油浴中反应,反应15h,将安培瓶放入液氮骤冷终止反应;
(2)将步骤(1)安培瓶中的产物加入无水乙醚进行沉淀;放在常温真空干燥箱至恒重,得到的PVP-COOH样品;
(3)称取样品1g PVP-COOH、0.1212g DCC和0.0744g NHS置于两口烧瓶中,在氮气氛围下加入5ml干燥的二氯甲烷,在冰水浴条件下反应1h,然后加入0.0445g巯基乙胺,常温下避光反应12h,将溶剂蒸发干净,得到粗制样品;
(4)将步骤(3)得到的粗制样品溶于水,在避光下使用去氧水透析,然 后冷冻干燥得到样品HS-PVP1;
(5)将1×1cm金片表面放入食人鱼洗液(piranha溶液)进行处理;
(6)取10ml乙醇,溶解20mg的HS-PVP1;
(7)取5ml配制好的HS-PVP1溶液置于PE管中,将步骤(5)得到的直径1cm金片放入,放置150min后取出,利用去离子水和乙醇充分清洗,得到具有抗蛋白吸附的、优异血液相容性的材料表面。
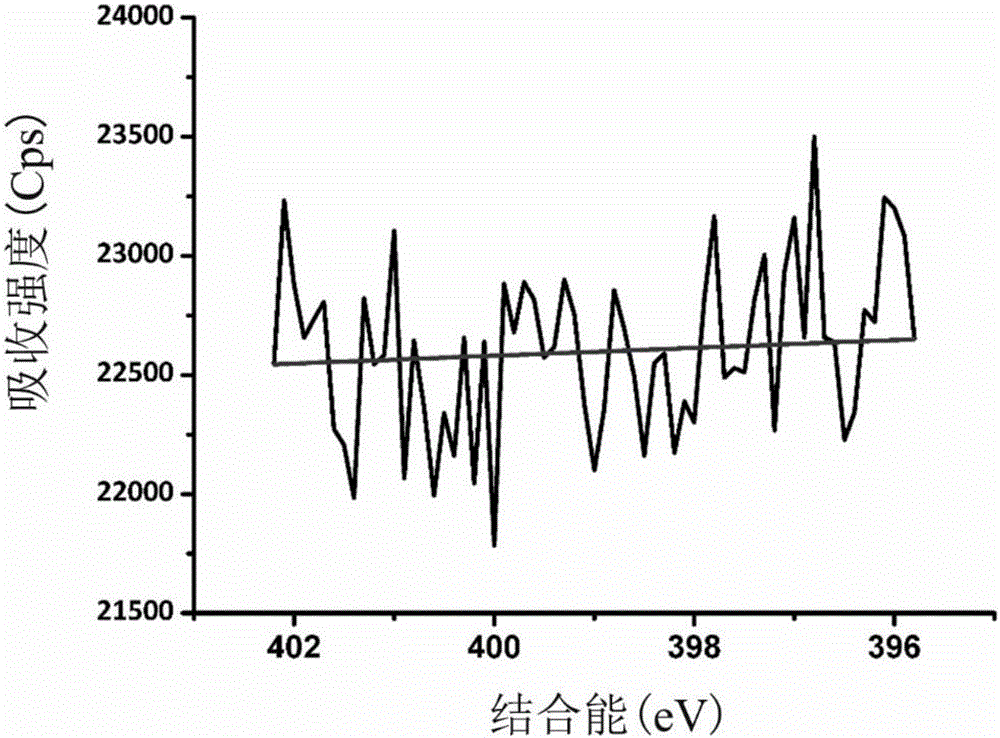
本发明采用型号为Axis UltraDCD的X射线光电子能谱(XPS)对聚乙烯基吡咯烷酮自组装前后的金片表面进行元素组成和含量的分析。X射线光电子能谱测试结果以C 1s(284.6eV)为基准对谱图进行校准,利用avantage软件对C、N、S元素进行拟合谱图。
如图1-1、图1-2、图1-3,图2-1、图2-2和图2-3为实施例1的XPS测试图,HS-PVP自组装于Au表面后,其表面元素含量发生明显变化,元素所处的化学环境也会发生明显变化,其中,图1-1、图1-2、图1-3为空白样的测试结果,空白样的表面N和S元素,C元素只有一种结合状态;图2-1、图2-2和图2-3为改性后的材料表面测试结果图,发现HS-PVP改性后的材料表面出现了N和S元素,且C元素出现三种结合状态。对比图1-1、图1-2、图1-3,图2-1、图2-2和图2-3结果表明HS-PVP1可成功接枝于材料表面。
可通过石英晶体微天平(QCM-D)研究聚乙烯基吡咯烷酮自组装金片后的材料表面对蛋白(人血浆白蛋白和人纤维蛋白原)吸附行为得到的结果;其中蛋白浓度为1mg/ml PBS溶液,吸附量是通过QCM-D测试得到的F变化以及软件拟合得到。人体血液含有多种蛋白,其中人血清白蛋白的含量最多,当材料与人体血液接触时,人血清白蛋白和纤维蛋白原在材料表面的吸附对血栓的形成有着重要影响,因而人体血液白蛋白(HSA)和纤维蛋白原(Fg)是研究材料血液相容性的常用蛋白。
空白样为Au,HS-PVP接枝修饰后的材料为Au-PVP,图3-1和图4-1分别为通过石英晶体微天平(QCM-D)测试得到的材料(Au和Au-PVP)表面对人体血液白蛋白(HSA)和纤维蛋白原(Fg)的吸附量柱状图。从测试结果可以看出,PVP成功修饰于材料表面,且相比空白样,改性后的材料表面可以 减少95.32%的人血白蛋白和84.76%的纤维蛋白原在其表面的粘附。细胞相容性实验结果表明,99.51%的细胞可以存活。
从图3-1和图4-1中可以看出,相比空白样Au,改性后的材料表面可以明显地减少人血白蛋白和纤维蛋白原在其表面的粘附。
用石英晶体微天平(QCM-D)测试HS-PVP在材料表面的接枝过程。,石英晶体微天平(QCM)的核心是石英晶体传感器。当传感器两端施加电压时,石英晶体会在共振频率处引发一个小的剪切振动。如果在晶体表面即样品表面上吸附一层物质,晶体的振动就会减弱,并且这种振动的减弱或者频率的降低随着薄膜的厚度和密度变化。即当芯片表面有物质吸附时,芯片的频率会降低,即表面晶体表面质量变化导致频率变化得到Δf,Δf曲线表示样品表面质量变化。
在以乙醇作为基线的情况下,当通入含HS-PVP的乙醇溶液后Δf曲线出现明显变化,大概在30min处出现转折,Δf变化均变缓慢,自组装时间为150min时,Δf基本达到平衡,而在150min后通入乙醇,出现比较大幅度的上升,对应的Δf分别为-19.67Hz,-21.69Hz,-24.59Hz,这表明HS-PVP溶液接触Au表面时,在Au表面同时存在HS-PVP的自组装及其物理吸附两个过程,通入乙醇后Δf的变化可能是由于表面一些只是物理吸附在Au表面的HS-PVP被乙醇冲刷带走而导致;10min后Δf曲线重新达到平衡状态,HS-PVP已比较牢固地接枝于材料表面。由于接枝前后通入的液体是一致的,通入可以溶解HS-PVP的溶剂后,Δf曲线重新达到平衡状态,即HS-PVP接枝于材料的质量达到一个稳定状态,通过良溶剂冲洗,也无法使其从样品表面脱落,说明以当前条件下,HS-PVP接枝于材料表面,且无法冲洗使其脱落,可说明HS-PVP已比较牢固地接枝于材料表面。
利用QTools软件拟合得到HS-PVP1在乙醇溶液中接枝于材料表面的质量约为2.03μg/cm2。说明了HS-PVP在材料表面的接枝过程,随着时间的变化,HS-PVP接枝于材料表面的质量也会随着变化。目的是展现HS-PVP在材料表面的接枝过程中质量变化过程。2.03μg/cm2是通过石英晶体微天平(QCM0-D)自带软件QTools拟合得到的,该值说明HS-PVP接枝于材料表面的接枝密度。
实施例2
一种利用可控接枝技术提高材料表面血液相容性的方法,其步骤如下:
(1)称量单体NVP(4ml,0.0371mol),RAFT试剂(0.1201g,3×10-4mol),4ml溶剂乙腈置于安培瓶中,最后加入0.014g引发剂AIBN,混合均匀,对烧瓶进行液氮除氧三次,在80℃的恒温油浴中反应,反应24h,将安培瓶放入液氮骤冷终止反应;
(2)将步骤(1)烧瓶中的产物加入无水乙醚进行沉淀;放在常温真空干燥箱至恒重,得到的PVP-COOH样品;
(3)称取样品1g PVP-COOH、0.0606g DCC和0.0372g NHS置于两口烧瓶中,在氮气氛围下加入10ml干燥的二氯甲烷,在冰水浴条件下反应1h,然后0.0225g巯基乙胺,常温下避光反应12h,将溶剂蒸发干净,得到粗制样品;
(4)将步骤(3)得到的粗制样品溶于水,在避光下使用去氧水透析,然后冷冻干燥得到最终样品HS-PVP2;
(5)将1×1cm金片表面放入食人鱼洗液进行处理15min;
(6)取10ml乙醇,溶解30mg的HS-PVP2;
(7)取5ml配制好的HS-PVP溶液置于PE管中,将步骤(5)得到的直径1cm金片放入,放置150min后取出,利用去离子水和乙醇充分清洗,得到具有抗蛋白吸附的、具有优异血液相容性的材料表面。
图3‐2和图4‐2为材料表面对人体血液白蛋白(HSA)和纤维蛋白原(Fg)的吸附量柱状图,图3‐2和图4‐2的测试方式与实施例1相同。只是实施例2使用了另一种分子量的HS‐PVP(HS‐PVP2)。从图3‐2和图4‐2测试结果可以看出,PVP成功修饰于材料表面,且相比空白样,改性后的材料表面可以减少88.31%的人血白蛋白和78.97%的纤维蛋白原在其表面的粘附。
实施例3
一种利用可控接枝技术提高材料表面血液相容性的方法,其步骤如下:
(1)称量单体NVP(4ml,0.0371mol),RAFT试剂(0.0601g,1.5×10-4mol),4ml溶剂乙腈置于安培瓶中,最后加入0.010g引发剂AIBN,混合均匀,对烧瓶进行液氮除氧三次,在80℃的恒温油浴中反应,反应36h,将安培瓶放入 液氮骤冷终止反应;
(2)将步骤(1)烧瓶中的产物加入无水乙醚进行沉淀;放在常温真空干燥箱至恒重,得到的PVP-COOH样品;
(3)称取样品1g PVP-COOH、0.0303g DCC和0.0186g NHS置于两口烧瓶中,在氮气氛围下加入10ml干燥的二氯甲烷,在冰水浴条件下反应1h,然后0.0113g巯基乙胺,常温下避光反应24h,将溶剂蒸发干净,得到粗制样品;
(4)将步骤(3)得到的粗制样品溶于水,在避光下使用去氧水透析,然后冷冻干燥得到最终样品HS-PVP3;
(5)将1×1cm金片表面放入食人鱼洗液进行处理15min;
(6)取10ml乙醇,溶解50mg的HS-PVP3;
(7)取5ml配制好的HS-PVP3溶液置于PE管中,将步骤(1)得到的直径1cm金片放入,放置150min后取出,利用去离子水和乙醇充分清洗,得到具有抗蛋白吸附的、优异血液相容性的材料表面。
图3‐3和图4‐3为材料表面对人体血液白蛋白(HSA)和纤维蛋白原(Fg)的吸附量柱状图,图3‐3和图4‐3的测试方式与实施例1相同。与实施例1相似,本实施例3使用了另一种分子量的HS‐PVP(HS‐PVP3)。从测试结果可以看出,PVP成功修饰于材料表面,且相比空白样,改性后的材料表面可以减少81.21%的人血白蛋白和75.23%的纤维蛋白原在其表面的粘附,且细胞相容性实验结果表明,98%的细胞可以存活。
本发明控制接枝密度是通过控制HS-PVP与材料表面的接触时间实现,而控制接枝链长则是通过控制HS-PVP的分子量实现,不同的分子量接枝于材料表面得到不同分子量聚乙烯基吡咯烷酮修饰的材料表面。
表1
表1是实施例1-3所用的HS-PVP的分子量以及分子量分布,说明本发明可以通过制备不同的分子量的样品进行接枝实验来控制接枝分子(即接枝链)的长度。
图3-1、图3-2、图3-3、图4-1、图4-2和图4-3为不同接枝分子量修饰的材料表面对人血白蛋白和纤维蛋白原的吸附性能柱状图,从这些图可以明显看出经过HS‐PVP修饰的材料表面对蛋白的吸附量相比于空白样Au明显减少,达到75%以上,对人血白蛋白和纤维蛋白原的非特异性吸附明显减少,表明制备的样品具有优异的血液相容性。
从实施例1‐3可以说明本发明可以控制接枝分子的接枝链长,可以得到不同接枝分子量修饰的材料表面,并且制备的材料表面可以有效抑制人血白蛋白和纤维蛋白原在其表面的粘附,使其具有优异的血液相容性。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种接枝视黄醇聚合物及采用其作为载体的喜树碱化合物的制作方法与工艺
- 星形聚合物接枝多肽和聚乙烯亚胺的基因载体及制备方法与流程
- 一种木质纤维接枝丙烯酰胺聚合物及其制备方法与流程
- 棉织物用聚合物/Ag掺杂纳米ZnO长效抗菌防霉整理剂及其制备方法与流程
- 含橡胶接枝聚合物粉体、以及含有其的太阳能电池用密封材料和夹层玻璃用中间膜的制作方法与工艺
- 一种抗菌纳米碳溶胶、纳米石墨辐照接枝改性锦纶单丝滤布及其制备方法与流程
- 附接到可降解的聚合物区的支撑件的制作方法与工艺
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 角蛋白接枝水性聚氨酯聚合物皮革复鞣填充材料的制备方法与流程