从含锂溶液中经济地提取锂的方法与流程
本申请是申请日为2011年7月8日,申请号为201180039418.8,发明名称为“从含锂溶液中经济地提取锂的方法”的发明专利申请的分案申请。
本发明涉及从含锂溶液中提取锂的方法。
背景技术:
目前锂的应用扩展到了各种工业,包括可再充电电池、玻璃、陶瓷、合金、润滑剂和制药工业。锂可再充电电池作为混合动力和电动汽车的主要能源近来受到关注,并且预期用于汽车的锂可再充电电池的市场会持续增长到用于手机和笔记本的传统小型电池市场的大约100倍。
此外,趋向更严格环境规则的全球性运动可能不仅扩展锂的应用到混合动力和电动汽车产业,还扩展到电子、化学和能源领域。因此,预期对锂的国内和国外需求都会显著地增加。
锂的主要来源可为矿物、盐水和海水。虽然例如锂辉石、透锂长石和锂云母等矿物包含大约1%至1.5%的相对大量的锂,但是其提取涉及复杂的工艺,例如浮选、高温煅烧、粉碎、酸混合、提取、纯化、浓缩和沉淀。这些工艺需要高的能量消耗,被认为不符合成本效益,并且在锂提取中酸的使用还会引起环境污染。
已报道大约2.5×1011吨的锂溶于海水中。虽然大多数技术包括插入含吸收剂的提取装置到海水中,以便在有选择地吸收锂之后通过用酸处理来提取锂,但由于包含在海水中的锂的浓度不超过0.17ppm,所以从海水中直接提取锂的效率非常低,并且非常不经济。
由于上述缺点,目前从天然盐湖生产的盐水中提取锂,但是例如mg、ca、b、na、k、so4的盐也溶于盐水中。
此外,包含在盐水中的锂的浓度为约0.3g/l至1.5g/l,并且包含在盐水中的锂通常以具有约13g/l的溶解度的碳酸锂的形态提取。即使假设包含在盐水中的锂完全转变成碳酸锂,盐水中的碳酸锂的浓度限于1.59~7.95g/l(li2co3的分子量为74,并且锂的原子量为7。如果锂的浓度乘以5.3(74÷14≒5.3),则可估计碳酸锂的浓度)。由于多数情况下碳酸锂的浓度低于碳酸锂的溶解度,提取的碳酸锂再次溶解,因此存在锂提取的收率极低的问题。
通常,为从盐水中包含的锂中提取碳酸锂,将从天然盐湖中泵出的盐水储存在蒸发塘中,然后经过长时间的室外自然蒸发,例如约一年,以数十倍地浓缩锂。然后,将例如镁、钙、硼的杂质进行沉淀以去除,所述方法需要大于溶解度的碳酸锂的量以进行沉淀。
例如,中国专利公开号1626443记载了提取锂的方法,其中,在太阳热能下蒸发和浓缩盐水,然后将浓缩液进行反复的电渗析,以便获得包含浓缩的锂并具有低含量镁的盐水。
这种传统方法需要蒸发和浓缩盐水,费时且不具生产性,尤其在雨季更是如此。此外,当锂与其它杂质以盐的形态沉淀时,锂的损失不可避免。
技术实现要素:
技术问题
根据本发明的实施方式,可提供通过使用具有低溶解度的磷酸锂而从盐水中以高提取产率经济地提取高纯度磷酸锂的方法,该方法不需要长时间的盐水蒸发和浓缩工艺。
技术方案
根据本发明的实施方式,提供了通过向溶液中加入磷供应材料以从溶解的锂中沉淀磷酸锂从而从含锂溶液中经济地提取锂的方法。
在本发明的一个实施方式中,所述磷供应材料可为选自由磷、磷酸、磷酸盐及其混合物组成的组中的一种。
在本发明的一个实施方式中,所述磷酸锂的浓度可为0.39g/l或更大。
在本发明的一个实施方式中,所述含锂溶液中锂的浓度可为0.1g/l或更大。更具体地,浓度可为0.2g/l或更大,或0.5g/l或更大。然而由于高浓缩锂需要大量的时间,60g/l或更高的浓度可能不经济。
在本发明的一个实施方式中,所述方法可进一步包括通过过滤从所述含锂溶液中沉淀的磷酸锂而提取磷酸锂的步骤。
在本发明的一个实施方式中,所述含锂溶液可为盐水。
在本发明的一个实施方式中,所述盐水可含有包括镁、硼、钙或其混合物的杂质。
在本发明的一个实施方式中,在通过在所述盐水中加入磷供应材料而从溶解的锂中沉淀磷酸锂以前,所述方法可进一步包括通过在所述盐水中加入羟基离子而沉淀并去除在所述盐水中的包括镁、硼、钙或其混合物的杂质的步骤。
在本发明的一个实施方式中,所述通过加入磷供应材料而从溶解的锂中沉淀磷酸锂的步骤可在室温或更高温度下进行。
在本发明的一个实施方式中,所述羟基离子可为氢氧化钠负离子。
在本发明的一个实施方式中,所述通过在所述盐水中加入羟基离子以沉淀和去除所述盐水中的包括镁、硼、钙或其混合物的杂质的步骤可为通过在所述盐水中加入羟基离子以沉淀和去除所述盐水中的包括镁、硼和钙的杂质的步骤。
在本发明的一个实施方式中,所述通过在所述盐水中加入羟基离子而沉淀和去除所述盐水中的包括镁、硼和钙的杂质的步骤可进一步包括以下步骤:(a)通过在所述盐水中加入羟基离子而从所述镁生产氢氧化镁;(b)通过共沉淀镁和硼而吸收所述氢氧化镁中的硼以提取镁和硼;和(c)通过调节去除镁和硼的滤出液的ph为至少12而沉淀钙。
在本发明的一个实施方式中,所述通过在所述盐水中加入羟基离子而从所述镁生产氢氧化镁的步骤可为在保持所述盐水的ph在8.5至10.5的同时通过加入羟基离子而从所述镁生产氢氧化镁的步骤。通过共沉淀镁和硼而吸收所述氢氧化镁中的硼以提取镁和硼的步骤可通过在包含氢氧化镁且具有8.5至10.5的ph的盐水中共沉淀镁和硼而吸收所述氢氧化镁中的硼以提取镁和硼来进行。通过在所述盐水中加入羟基离子而保持所述盐水的ph在8.5至10.5的同时通过在盐水中加入羟基离子而从所述镁生产氢氧化镁的步骤,和在包含氢氧化镁且具有8.5至10.5的ph的盐水中通过共沉淀镁和硼而吸收所述氢氧化镁中的硼以提取镁和硼的步骤可同时进行。
在本发明的另一个实施方式中,所述通过加入磷供应材料而从溶解的锂中沉淀磷酸锂的步骤之后可为过滤所述沉淀的磷酸锂并将其以高纯粉末的形态提取的步骤。
在本发明的另一个实施方式中,所述通过调节去除镁和硼的滤出液的ph到至少12而沉淀钙的步骤可为通过加入羟基离子、碳酸离子或其混合物而从钙中沉淀氢氧化钙或碳酸钙的步骤。
发明的有益效果
根据本发明的一个实施方式,不需要长时间的盐水蒸发和浓缩处理,通过使用具有低溶解度的磷酸锂进行沉淀,溶解于所述盐水中的锂可以以高提取率经济地提取为锂。
附图说明
图1为描述根据盐水的ph的氢氧化镁的表面电荷变化的图。
图2为描述相对于naoh的加入量在所述滤出液中镁离子的浓度变化的图。
图3为描述相对于naoh的加入量在所述滤出液中硼离子的浓度变化的图。
图4为描述相对于naoh的加入量在所述滤出液中锂离子的浓度变化的图。
图5为描述相对于naoh的加入量在所述滤出液中钙离子的浓度变化的图。
图6为描述当从锂沉淀磷酸锂时相对于反应时间的锂的浓度的图。
图7为描述当从锂沉淀磷酸锂时相对于反应时间和温度的锂的浓度的图。
图8为描述当从锂沉淀碳酸锂时相对于反应时间在所述滤出液中磷酸锂的浓度的图。
具体实施方式
下面将参照下列附图更详细地描述本发明的一个实施方式的特征。
根据本发明的一个实施方式,可提供通过加入磷供应材料到溶液中以从溶解的锂中沉淀磷酸锂而非碳酸锂从而从含锂溶液中经济和有效地提取锂的方法。
由于碳酸锂(li2co3)的溶解度大约为13g/l,其可相对大量地溶于水中。因为0.5g/l至1.5g/l的极小量的锂的溶解浓度,难于从含锂溶液,例如盐水中提取锂。即使通过向所述含锂溶液中加入碳酸钠来生产碳酸锂,其大多数也会再溶解。
然而,磷酸锂(li3po4)的溶解度大约为0.39g/l,相对低于碳酸锂的溶解度。因此,可能提取溶解于例如盐水的含锂溶液中的甚至0.5g/l或1.5g/l的小量的锂,其可通过在含锂溶液中加入磷供应材料沉淀和分离成固体状态的磷酸锂。
在本发明的一个实施方式中,含锂溶液中锂的浓度可为0.1g/l或更大。更具体地,浓度可为0.2g/l或更大、或0.5g/l或更大。然而,由于锂的高浓缩需要大量的时间,60g/l或更大的浓度可能不经济。
将选自由磷、磷酸、磷酸盐及其混合物组成的组中的所述磷供应材料加入到含锂溶液中以生产磷酸锂。此外,为了使磷酸锂以固体状态沉淀而不再次溶解,所述浓度(即含锂溶液中的溶解浓度)应为0.39g/l或更大。
在磷供应材料为能够改变所述含锂溶液(例如磷酸)的ph的化合物的情况下,一旦溶液的ph下降,可同时使用羟离子以防止沉淀的磷酸锂再次溶解。
所述磷酸盐可为,例如但不限于,磷酸钾、磷酸钠和磷酸铵。具体地,所述铵可为(nr4)3po4,其中r独立地为氢、重氢、取代或未取代的c1至c10烷基,但不限于此。
更具体地,所述磷酸盐可为,例如但不限于,磷酸二氢钾、磷酸氢二钾、磷酸三钾、磷酸二氢钠、磷酸氢二钠、磷酸三钠、磷酸铝、磷酸锌、聚磷酸铵、六偏磷酸钠、磷酸一钙、磷酸二钙和磷酸三钙。
所述磷供应材料可溶于水。在所述磷供应材料可溶于水的情况下,与包含在含锂溶液中的锂的反应可容易地发生。
所述沉淀的磷酸锂可通过过滤所述含锂溶液而提取。
此外,通过加入磷供应材料到溶液中以从溶解的锂中沉淀磷酸锂而从含锂溶液经济地提取锂的方法可在室温下进行。更具体地,该温度可大于20℃、30℃、50℃或90℃。
本发明中,术语“室温”不限于确定的温度,其解释为没有应用外部能量的温度。因此,所述室温可根据时间和位置而变化。
[去除杂质沉淀物的步骤]
根据本发明的一个实施方式,可包含通过在含锂溶液(例如盐水)中加入羟基离子而去除盐水中包含镁、硼或钙的杂质,然后进行沉淀的步骤。
羟基离子可为,例如但不限于,氢氧化钠、氢氧化钾和氢氧化铵。具体地,所述铵可为(nr4)3po4,其中r独立地为氢、重氢、取代或未取代的c1-c10烷基,但不限制于此。更具体地,所述氢氧化物可为氢氧化钠的阴离子。
更具体地,由于氢氧化物盐的阳离子具有高溶解度,在提取锂的过程中所述羟基离子可为作为副产物得到的氢氧化物盐的阴离子。
在本发明的一个实施方式中,通过在含锂溶液(例如盐水和下文中假设为盐水的溶液)中加入羟基离子而沉淀和去除盐水中包含镁、硼或钙的杂质的步骤可为通过在盐水中加入羟基离子而沉淀和去除盐水中包含镁、硼和钙的杂质的步骤。
在本发明的一个实施方式中,通过在所述盐水中加入羟基离子而沉淀和去除所述盐水中包含镁、硼或钙的杂质的步骤可进一步包括步骤:(a)通过在所述盐水中加入羟基离子而从所述镁中生产氢氧化镁;(b)通过共沉淀镁和硼而吸收所述氢氧化镁中的硼以提取镁和硼;和(c)通过调节去除镁和硼的滤出液的ph至至少12而沉淀钙。
根据镁的量,通过在所述盐水中加入羟基离子而从所述镁中生产氢氧化镁的步骤(a),和通过共沉积镁和硼而吸收所述氢氧化镁中的硼以提取镁和硼的步骤(b)可单独或同时进行。
换句话说,如果生产足够量的氢氧化镁,并且所生产的氢氧化镁能够吸收大多数的硼,步骤(a)和步骤(b)可同时进行,但是如果生产的镁的量不充足,上述步骤可分别进行。
在本发明的一个实施方式中,例如,通过加入羟基离子(例如naoh)到包含镁、硼和钙的含锂盐水中,所述镁可生产为氢氧化镁。
具有加入的羟基离子(例如naoh)的盐水的ph可调节到8.5至10.5,然后,通过吸收所述氢氧化镁中的硼可以共沉淀镁和硼。
所述步骤可同时进行。
为了提高所述盐水的ph到8.5至10.5的范围内,通过加入羟基离子(例如naoh)可使溶解于盐水中的镁沉淀为氢氧化镁。氢氧化镁的特征在于具有0.009g/l的低溶解度,并具有在具有8或更大ph的碱性溶液中易于沉淀的趋势。
此外,通过保持盐水的ph在8.5至10.5之间,硼(例如硼离子)可在生产的氢氧化镁的表面被吸收以共沉淀镁和硼。
在这方面,所述氢氧化镁的表面电荷可被利用。
通常,氢氧化镁的表面电荷受溶液ph的巨大影响。当氢氧化镁的表面电荷是正的时,以负离子形态存在的硼离子,例如h2bo3-或hbo32-在氢氧化镁中被吸收,并且溶解在含锂溶液中的镁和硼可通过同时提取而被去除。然而,当氢氧化镁的表面电荷是负的时,带负电荷的硼离子不能在氢氧化镁中被吸收。
如果盐水的ph低于8.5,由于相对低的ph导致由溶解于盐水中的镁离子沉积的氢氧化镁的量不足,镁的去除效率将下降。另一方面,如表1所示,如果所述ph超过10.5,氢氧化镁的表面电荷将为负电荷,由此其上不能吸收硼离子。因此,盐水中存在的带正电荷的锂离子的吸收将导致锂的大量损失。
为了通过沉淀同时提取镁和硼,可以分阶段向盐水中加入羟基离子(例如naoh),这样可以保持盐水的ph在8.5至10.5之间。
向具有几乎中性ph的盐水中加入足够量的羟基离子(例如naoh)以调节ph在8.5至10.5的范围内。这允许在氢氧化镁的表面电荷上吸收硼(例如硼离子)以共沉淀溶解于盐水中的大多数镁和硼。
为了在大部分镁和硼沉积后再次共沉淀在滤出液中存在的剩余的镁和硼,可加入另外的羟基离子(例如naoh)到滤出液中以调节ph至8.5和10.5之间,然后沉淀剩余的镁和硼。
由于如果立刻加入大量的羟基离子来沉淀溶解于盐水中的镁和硼,盐水的ph不可能保持在8.5和10.5之间,并且因此镁和硼的共沉淀效率可能下降,导致锂的损失,因此优选分阶段加入羟基离子(例如naoh)。
为了从盐水中分离吸收了硼的沉淀的氢氧化镁,进行过滤以同时提取镁和硼,并获得产生的滤出液。
可通过加羟基离子或碳酸盐离子(例如naoh、碳酸盐或其混合物)到镁和硼被提取的滤出液中以调节ph至12或更高来沉淀钙。
根据使用的羟基离子或碳酸离子的类型,可沉淀氢氧化钙或碱式碳酸盐。
如果省略从盐水中分离吸收了硼的沉淀的氢氧化镁的过滤步骤,并且调节ph至12或更高以除去钙,由于盐水的ph偏离8.5至10.5的范围,氢氧化镁的表面电荷将转变成负的。在这种情况下,氢氧化镁中吸收的硼将被释放,作为替代,正锂离子将被吸收,同时导致锂的损失和硼提取率的降低。
当ph为12或更高时,具有非常低的溶解度的氢氧化钙和碳酸钙易于沉淀。因此,优选保持滤出液的ph为12或更高。
在本发明的一个实施方式中,例如,可加入碱和碳酸盐的混合物。
所述碱选自由naoh、koh、ca(oh)2、nh4oh、r4noh·5h2o及其混合物组成的组中,其中,r独立地为c1~c10烷基,例如甲基、乙基、丙基或丁基。
因为由碱(例如naoh)的加入提供的oh-在氢氧化钙的产生中被用尽,加入大量的碱(例如naoh)以便保持含锂溶液的ph水平到至少12。当单独加入碳酸钙或与碱(例如naoh)结合加入时,即使碱的量可能相对减少,也可经济地保持ph到至少12。
所述碳酸盐选自由na2co3、k2co3及其混合物组成的具有高溶解度的组中,并且包含在碳酸盐中的钠和钾溶解于滤出液中。从剩余的滤出液中分离沉淀的氢氧化钙或碳酸钙,然后提取钙。
[沉淀磷酸锂的步骤]
磷供应材料可加入到杂质被去除的剩余的滤出液中以从盐水含有的锂中沉淀磷酸锂。
从含锂的盐水中沉淀磷酸锂的步骤可在室温或更高、或在40℃或更高的温度下进行。更具体地,所述步骤可在50℃或更高、60℃或更高、70℃或更高、80℃或更高、或90℃或更高的温度下进行。
所述磷供应材料可选自由磷、磷酸、磷酸盐及其混合物组成的组中。
为了使以固体状态沉淀的磷酸锂不被再次溶解,浓度(即在含锂溶液中的溶解浓度)应为0.39g/l或更大。
所述磷酸盐可为,例如但不限于,磷酸钾、磷酸钠和磷酸铵。具体地,所述铵可为(nr4)3po4,其中r独立地为氢、重氢、取代或未取代的c1-c10烷基,但不限于此。
更具体地,所述磷酸盐可为,例如但不限于,磷酸二氢钾、磷酸氢二钾、磷酸三钾、磷酸二氢钠、磷酸氢二钠、磷酸三钠、磷酸铝、磷酸锌、聚磷酸铵、六偏磷酸钠、磷酸一钙、磷酸二钙和磷酸三钙。
所述磷供应材料可为水溶性。在磷供应材料为水溶性的情况下,与包含在所述含锂溶液中的锂的反应可容易地发生。
此外,在加入磷供应材料后,在室温下或在40~200℃、50~200℃、60~200℃、70~200℃、80~200℃或90~200℃的温度范围内煅烧滤出液10至15分钟。
虽然为了生产磷酸锂的目的,延长煅烧时间和提高温度是有利的,但是如果煅烧时间超过15分钟或者如果煅烧温度超过200℃,磷酸锂的生产率会达到饱和。
[提取磷酸锂的步骤]
在由溶解于盐水中的锂沉淀磷酸锂后,可进行提取从滤出液过滤的沉淀的磷酸锂的步骤。
经过这种过滤,所述提取的磷酸锂可被清洗以获得高纯度的磷酸锂粉末。
下面的实施例涉及优选的实施方式,且不应解释为对本发明范围的限制,本发明将通过下列实施例进行进一步的说明。
[实施例1]
向包含镁离子20,000ppm、硼离子900ppm、钙离子350ppm和锂离子900ppm的盐水中加入naoh以沉淀氢氧化镁。在调节盐水的ph的同时,测量沉淀的氢氧化镁的表面电荷。结果显示于图1中。
如图1所示,当加入到盐水中的naoh的ph范围是8.5至10.5时,所述氢氧化镁的表面电荷保持为正电荷。因此,具有负电荷的硼离子易于被吸收在氢氧化镁上,并且防止带正电荷的锂离子被吸收。这使锂的损失最小化,并且有效地从盐水中同时提取镁和硼。
[实施例2]
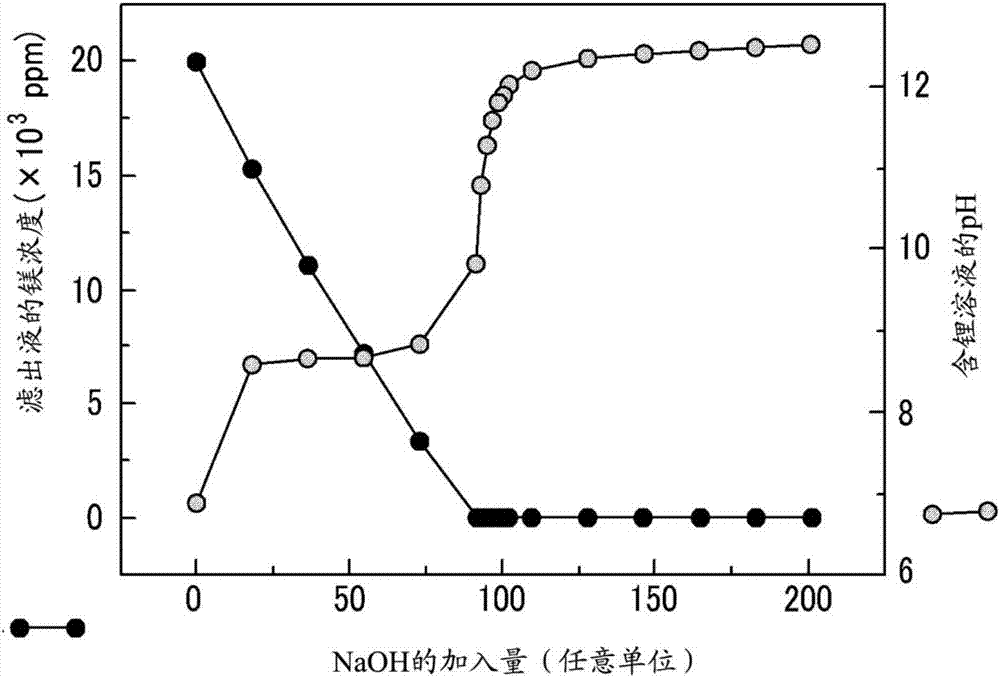
在改变ph的同时,从包含镁离子20,000ppm、硼离子900ppm、钙离子350ppm和锂离子900ppm的盐水中沉淀氢氧化镁。然后,进行过滤以从盐水中分离沉淀的氢氧化镁。收集滤出液以测量镁、硼和锂的量。结果分别显示于图2、3和4中。
如图2所示,因为oh-离子用于产生氢氧化镁,开始时加入的naoh的量的增加对盐水的ph无显著地影响。然而,naoh的量的持续增加逐渐降低滤出液中镁的量,并且由于oh-离子增加,一旦盐水的ph达到9.8,镁的量就会降低至4ppm。这表明溶解在盐水中的99.8%的镁离子被提取。
此外,如图3所示,随着加入的naoh的量的增加,溶解在盐水中的硼离子的量首先减小。这可通过开始时naoh的加入可显著地影响ph变化,并且从具有10.5或更低ph值的盐水中沉淀的氢氧化镁的表面电荷为正电荷的事实来解释。因此,滤出液中存在的带负电荷的硼离子当其在氢氧化镁的表面被吸收的同时而被沉淀。
如图4所示,滤出液中存在的锂离子的量最初不受加入的naoh的量的影响。这可通过由于开始时氢氧化镁的表面电荷具有正电荷,所以含锂溶液中存在的带正电荷锂离子不在氢氧化镁中被吸收的事实来解释。然而,如果加入过量的naoh,盐水的ph就会超过10.5。然后,氢氧化镁的表面电荷转变成负电荷,并且带负电荷的硼离子不被吸收到表面。结果,存在于滤出液中的硼离子的浓度显著增加。相反,当锂离子被吸收到氢氧化镁的表面时,存在于滤出液中的带正电荷的锂离子的浓度迅速下降。
因此,这些结果表明,必须控制加入的naoh的量以保持盐水的ph在8.5和10.5之间,以便使从盐水中锂的损失最小化的同时,同时提取镁和硼。
[实施例3]
向包含镁离子20,000ppm、硼离子900ppm、钙离子350ppm和锂离子900ppm的盐水中加入naoh以从包含钙离子的溶液中沉淀氢氧化钙。然后,进行过滤以从盐水分离沉淀的氢氧化钙。收集产生的滤出液以测量钙的量。结果显示于图5中。
如图5所示,当加入的naoh的量增加时,滤出液中钙的量逐渐降低。当盐水的ph达到12时,钙的量降低到6.5ppm,并且溶解在盐水中的98%的钙离子被提取。因此,优选地提高含锂溶液的ph到至少12,以便提高盐水中的钙离子的提取率。
然而,当盐水的ph开始时过早地调节到至少12时,沉淀的氢氧化镁的表面电荷具有负电荷。这阻止了硼离子的吸收,并且由于带正电荷的锂离子的吸收导致了锂的损失。通过加入naoh来提取钙之前,调节盐水的ph至8.5和10.5之间,以便沉淀具有正电荷的氢氧化镁以阻止锂离子的吸收。一旦硼离子被吸收,就进行镁和硼的同时提取。然后,将镁和硼已被提取的剩余的滤出液的ph调节到至少12以从钙沉淀氢氧化钙。
[实施例4]
从盐水中去除包含镁、钙和硼的杂质,并且向其中溶解的锂离子的浓度为0.917g/l的剩余的滤出液中加入7.217g/l的磷酸钠。在提高温度至90℃的同时,保持所述滤出液进行反应15至60分钟。
一旦反应完成,通过过滤分离沉淀的磷酸锂,并且收集剩余的滤出液以测量锂的浓度。结果显示于图6中。
如图6所示,当磷酸钠加到盐水中时,滤出液中锂的浓度首先显著减小。反应15分钟之后,滤出液中锂的浓度达到小于50mg/l。这表明溶解于盐水中的超过95%的锂沉淀并分离为磷酸锂。
由于磷酸锂的溶解度大约为0.39g/l,显著低于碳酸锂的溶解度,所以在盐水中加入例如磷酸钠的含磷的材料而从少量的溶解在盐水中的锂中以固体形态沉淀磷酸锂。此外,从图7中可看出,如果煅烧温度超过90℃,则在反应10分钟后,锂的提取率超过90%,并且在反应15分钟后,提取率大于95%。
[对比例1]
从盐水中去除包含镁、钙和硼的杂质,并且向其中溶解的锂离子的浓度为0.917g/l的剩余的滤出液中加入7g/l的磷酸钠。在提高温度至90℃的同时,保持所述滤出液进行反应15至60分钟。
一旦反应完成,通过过滤分离沉淀的碳酸锂,并且收集剩余的滤出液以测量锂的浓度。结果显示于图8中。
如图8所示,即使碳酸钠加入到含锂溶液并且反应15至60分钟,滤出液中锂的浓度几乎与反应前盐水中锂的浓度相同。
换句话说,由于碳酸锂大约13g/l的高溶解度,其可大量溶解于水中。因此,提取以碳酸锂的形态溶解于盐水中的少量锂将极其困难,除非通过盐水的蒸发和浓缩提高碳酸锂沉淀的量。
通过用具有低溶解度的磷酸锂沉淀溶解在盐水中的锂,不需要盐水的蒸发及浓缩工艺,并且可能使锂的损失最小化的同时,以高提取率经济地提取锂。
在上述说明书中,已经说明了本发明的具体的实施方式。然而,本领域技术人员将认识到在不背离如在上述讨论的各种实施方式中提出的本发明的精神和范围的情况下,可做出各种修改和变化。因此,应认为说明书和附图为说明性而非限制性意义,并且所有这类变化应包含在本发明的范围内。各种益处、优点、问题的解决方案、以及任何可导致任何益处、优点或解决方案出现或变得更显著的要素不应被解释为如上所述的关键的、必需的或实质性的特征或要素。
- 还没有人留言评论。精彩留言会获得点赞!