磷酸提铀制程的制作方法
本发明有关于一种提铀制程;更详而言之,特别是关于一种能提升第一循环反应反萃段效率以及降低第二循环反应反萃段严重乳化现象的磷酸提铀制程。
背景技术:
首先,第一循环反应反萃段发现还原酸b-73亚铁离子(fe2+)过低时,还原酸不仅无法将有机相的铀萃下,且还原酸的铀反而被有机萃取剂带走,虽然根据以往的经验知道补充亚铁离子(fe2+)但是每当碰到异常时才再补充亚铁离子(fe2+)会导致耗费人力,因此解决第一循环反应反萃段效率不佳是有其必要性。
接着在进行第二循还反应时发现反萃段产生严重的乳化现象,使得有机和碳酸铵液无法澄分,因此必须要停机清理乳化物再将乳化物储存在50加仑桶中保存,并将机台内的液位补足后重新开机运转,但隔日又因产生严重乳化而被迫再度停机清理,而经过数次开开关关清理乳化物后,仍无法从设备上去改善乳化问题,只好将v-205、v-209两槽内的有机物泵入第一循环重新配制d2d(0.4mold2ehpa、0.1moldbbp-kerosene),并将重新配制的d2d泵入v-205中再次开机运转,但运转3小时后仍旧产生乳化,然查阅以往现场纪录发现第二循还反萃段的乳化问题早已存在,但因先前进行第二循还反应中所使用的药剂量小且更换容易,固一直未彻底改善。
又第一循环反应与第二循还反应成连锁关,固须同时改善第一循环反应与第二循还反萃效率不佳的问题是有其必要性。
技术实现要素:
有鉴于此,本发明的目的在于提供一种磷酸提铀制程。
为了达到上述的目的,本发明提供一种磷酸提铀制程,其包含有第一循环反应以及第二循环反应;
所述第一循环反应包含有萃取段以及反萃段,其中,反萃段所使用的d2t(0.5m的双(2-乙基己基)磷酸酯(d2ehpa)与的三辛基氧化膦-煤油(0.125mtopo-kerosene)混合)浓度须维持在定值,还原酸p2o5浓度也须控制在定值,一旦还原酸浓度不足须立刻补充,且b-73(fe3+/fe2+)的比值须控制在定值,并降低b-62(fe2+)以减少铁在第二循环中与双氧水(h2o2)的用量和产品的杂质;
所述第二循环反应包含有萃取段以及反萃段,其中,反萃段使用d2d或是d2t做为萃取剂,而d-45的铀要维持在高含量,脱洗用的碳酸铵浓度也须维持在定值,且需定时排放沉淀于反应池池底的aq,并使含有高浓度铀的萃取剂以稳定的速度进料,且org:aq的比例须维持在定值。
进一步地,其中该第一循环反应反萃段中d2t的浓度为0.5m,所述d2t由0.5m双(2-乙基己基)磷酸酯和0.125m三辛基氧化膦-煤油混合而成。
进一步地,其中该第一循环反应反萃段中还原酸p2o5浓度为30%。
进一步地,其中该第一循环反应反萃段中b-73(fe3+/fe2+)的比值介于1.0-2.5之间。
进一步地,其中该第二循环反应反萃段中萃取剂d2d的浓度为0.4m。
进一步地,其中该第二循环反应反萃段中d-45的铀含量为10g/l以上。
进一步地,其中该第二循环反应反萃段中碳酸铵的浓度为2m。
进一步地,其中该第二循环反应反萃段中org:aq的比例为2:1。
本发明具有以下有益效果:
本发明所提供的磷酸提铀制程,其将fe3+/fe2+的比值控制在定值借此来克服第一循环反应反萃段效率不佳的情况,以提升第一循环反应反萃段的效率;还可减少第二循环反应中反萃段产生严重乳化现象,增加第二循环反应反萃段中有机铀的含量,使产品的含铁量减少,进而增加产品的纯度。
附图说明
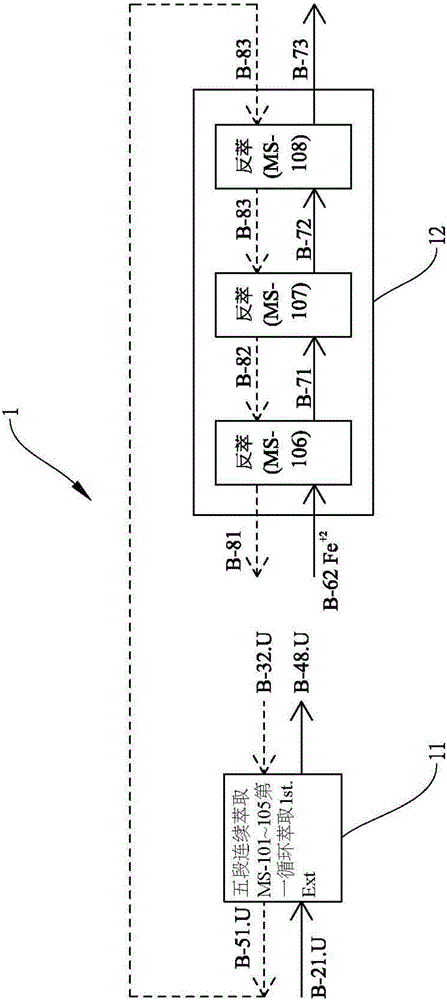
图1:本发明磷酸提铀制程第一循环反应流程图;
图2:本发明磷酸提铀制程第二循环反应流程图。
其中,
1-第一循环反应;11-第一循环萃取段;12-第一循环反萃段;
2-第二循环反应;21-第二循环萃取段;22-第二循环反萃段。
具体实施方式
下列实施例将进一步说明本发明的其它特征和优点,但该等实施例仅为示例而用,并非对本发明的限制。
首先请同时参阅图1以及图2,图1为本发明磷酸提铀制程第一循环反应流程图,图2为本发明磷酸提铀制程第二循环反应流程图。
本发明磷酸提铀制程,其包含有第一循环反应以及第二循环反应。
所述第一循环反应包含有萃取段以及反萃段,其中,第一循环反应萃取段主要萃取六价铀,其化学反应式为:
而反应式中该hx为二(2-乙基己基)磷酸(di(2-ethylhexyl)phosphate,d2ehpa),该topo为三正辛基氧膦(tri-n-octylphosphineoxide,topo);另外第一循环反应反萃段主要利用还原酸将六价铀(u6+)反萃成四价铀(u4+),其化学反应式为:
而为了探讨第二循环反应反萃段产生乳化的原因本申请发明人先进行现场采样,而采样结果如下表(一)所示。
表(一)
其中,b-83铀的采样仅于每日的08:30采取一次样品,且当b-51铀的浓度小于b-83铀的浓度时,还原酸并无法进行b-51铀的反萃,反而会被萃取剂带走使得b-73铀的浓度逐渐下降。
而为了探讨第一循环反应反萃段效率差的原因本申请发明人针对现有操作方法、原料浓度、设备、化学反应物进行分析,分析结果如下列所示:
探讨原料浓度及化学反应与反萃效率的关系:
由上述表(一)中第三天08:30所检测到的b-51u浓度为315μg/ml=0.315g/l,若b-51u要被还原酸完全反萃b-73u的浓度应为
但b-73settlerfe2+的含量仅有2.7g/l,且b-72的fe2+含量为12.4g/l并以每小时7.2l的速度泵入b-73mixer,同时b-73mixer内有500l/hr的循环酸泵入。
固由上述信息来试算b-73mixerfe2+的理论值应为
因此若fe2+的含量逐渐降低,铀的含量也就相对的降低,固若是要将b-51铀进行高效率反萃,b-73的fe2+含量就必须维持在定值以上。
探讨操作方法及设备因素与反应效率的关:
假设b-51(u:0.3g/l)以250l/hr的速度泵入ms-108中与环原酸b-73进行反萃,因此每小时泵入的铀总量为0.3x250=75g,而这些铀则需要
而理论上即b-72的fe2+以7.2l/hr的速度不断的注入ms-108中,藉此来补充b-73的fe2+消耗量(假设fe2+不会被o2氧化),反萃就能达到高效率,若b-72没有持续下料而b-73的fe2+连续每小时消耗35.3g,而使fe2+含量逐渐降低导致b-51铀没有完全被反萃,进而使整体反萃效率变差,因此操作时须注意有机萃取剂和还原酸流量要正确且要保持正常进料,以及b-73fe2+浓度要随时保持在定值以上若没达标就需补充,最后若进料泵、管路、储存槽有漏气应立即密封处理,以避免fe2+被大气中的o2氧化。
探讨fe3+/fe2+比值与反萃效率的关系:
而利用fe2+进行反萃的化学反应式为:
表(二)
由上述表(二)可知fe3+/fe2+比值须控制在特定的定值以下,还原酸才能正常反萃。
探讨fe3+/fe2+、u6+/u4+与反萃效率的关系,特仿照制程条件如下试验:
(1).探讨fe2+aq与u6+org的关系:
取出还原酸与b-62(u:0g/l、fe2+:32.6g/l)各100ml,并加入些许h2o2使fe2+变化后分别加入水容至60℃的b-51(u:259μg/ml)50ml,且还需在分液漏斗中震荡20分钟,震荡后经澄分取出有基酸分析,分析数具如下表(三)。
表(三)
由上述表(三)可知当还原酸未含铀时,2.7g/l的fe2+是足够将b-51铀完全反萃。
(2).取还原酸与b-62(u:0g/l、fe2+:42.3g/l)各100ml并如同上述(1).加不同量的h2o2使fe2+实化后分别加入b-51(u:207.6μg/ml、fe:118.1μg/ml)50ml反萃后,分析数据如下表(四)。
表(四)
由上述表(四)可知当还原酸未含铀时feaq2+1.0g/l应足以将b-51铀完全反萃,又feaq2+与有机fe成负相关固还原酸含fe3+越多,有机含铁量也相对增多。
(3).探讨fe3+/fe2+、u6+/u4+与化学反应的关系:
取还原酸b-72(u4+:7.59g/l、fe2+:28.4g/l)各100ml,再加入h2o2使fe2+变化后分别加入b-51(u:259μg/ml、fe:120μg/ml)50ml反萃后分析数据如下列表(五)。
表(五)
由上述表(五)可知高铀量环原酸反萃低铀量萃取剂,其fe3+/fe2+比值为
(4.)探讨fe3+/fe2+、u6+/u4+浓度与化学反应的关系:
取b-73(u4+:7.7g/l、u:7.87g/l、fe2+:10.6g/l、fe:31.4g/l)并加入h2o2使fe2+变化后分别加入b-51(u:25.9μg/ml、fe:120μg/ml)50ml反萃后分析数据如下列表(六)所示。
表(六)
由上述表(六)可知当还原酸含高铀时fe3+/fe2+比值为
(5).再度探讨fe3+/fe2+、u6+/u4+与化学反应有关:
取100ml的b-72(u4+:7.7g/l、u:7.87g/l、fe2+:10.6g/l、fe:31.4g/l)与50ml的b-51(u:207.6μg/ml、fe:118.1μg/ml)进行如同(3).、(4).所述的反萃,反萃后分析数据如下列表(七)所示。
表(七)
由上述表(七)可知当fe3+/fe2+比值为
由上述试验可知,第一循环反应反萃段中所使用的d2t(0.5md2ehpa、0.125mtopo-kerosene)浓度须维持在0.5m,还原酸p2o5浓度须控制在30%左右,一旦还原酸浓度不足须立刻补充,且b-73(fe3+/fe2+)的比值须控制在定值(1.0-2.5之间),并降低b-62(fe2+)以减少铁花与在第二循环反应中双氧水(h2o2)的用量和产品的含铁量。
自从b-73(fe3+/fe2+)的比值控制在定值后,第一循环反应反萃段异常现象情况便不再发生,而一直顺利的反萃出四价铀。
所述第二循环反应萃取包含有萃取段以及反萃段,其中,第二循环反应萃取段的化学反应式为:
采用d2t做为萃取剂的步骤一,其化学反应式为:
步骤二,其化学反应式为:
采用d2d做为萃取剂的步骤一,其化学反应式为:
步骤二,其化学反应式为:
而为了探讨第二循环反应反萃段产生严重乳化的原因本申请发明人针对现有操作方法、原料、设备、化学反应物进行分析,分析结果如下列所示:
探讨乳化与碳酸铵浓度是否关联:
试验1:将乳化的有机萃取剂与新配置浓度2m的碳酸铵以比例1:1混合并进行摇晃使乳化的有机萃取剂与碳酸铵均匀混合,经摇晃后有机相依然为乳化状态。
试验2:将乳化的有机萃取剂与新配置浓度1m的碳酸铵以比例1:1混合并进行摇晃使乳化的有机萃取剂与碳酸铵均匀混合,经摇晃后有机相依然为乳化状态。
试验3:将乳化的有机萃取剂与纯度90%以上的固态碳酸铵混合并使溶液饱和后搅拌,但经搅拌后有机相依然为乳化状态。
因此由上述试验1-3可知不同浓度的碳酸铵无法改善乳化现象,固碳酸铵浓度非影响乳化的要因。
探讨乳化与有机萃取剂浓度是否有关联:
试验4:将乳化的有机萃取剂(d2:0.44m)与煤油以比例1:1混合并进行摇晃使乳化的有机萃取剂与煤油均匀混合,经摇晃后发现混合物上层澄清但下层仍然为乳化状态。
因此再将乳化的有机萃取剂(0.44m的磷酸)用煤油稀释一倍后,乳化物的悬浮微粒数量下降,由前述可知萃取剂的浓度与乳化现象有关联。
探讨乳化与有机铀含量是否有关联:
试验5:将乳化的有机萃取剂(u:1.5g/l)与d-45(d2:0.44m、u:6g/l)以比例1:1混合并进行摇晃使乳化的有机萃取剂与d-45均匀混合,经摇晃后发现乳化物开始结团下沉而使溶液澄清。
试验6:将乳化的有机萃取剂(u:1.5g/l)与d-45(d2:0.44m、u:6g/l)以比例1:2混合并进行摇晃使乳化的有机萃取剂与d-45均匀混合,经摇晃后发现乳化物迅速的结团下沉,而且溶液澄清的速度更快。
综合上述试验可知试验5的铀总量为
探讨乳化与铀含量及萃取剂浓度的关联:
试验7:将乳化的有机萃取剂(d2:0.44m、u:1.5g/l)、d-45(d2:0.44m、u:6g/l)与d-71(2m的碳酸铵、u:2g/l)以比例1:1:2混合并进行摇晃,结果发现有机萃取剂依然产生乳化状态。
由试验7可知,总铀含量为
试验8:将乳化的有机萃取剂(d2:0.44m、u:1.5g/l)、d-45(d2:0.44m、u:6g/l)、煤油与d-71(2m的碳酸铵、u:2g/l)以比例2:3:1:3混合并进行摇晃,结果摇晃后产生黄色结晶且有机液乳化现象下降而使溶液澄清。
由试验8可知,总铀含量为
试验9:将乳化的有机萃取剂(d2:0.44m、u:1.5g/l)、d-45(d2:0.44m、u:6g/l)、煤油与d-71(2m的碳酸铵、u:2g/l)以比例2:3:1:6混合并进行摇晃,结果有机萃取剂产生乳化现象。
由试验9可知,总铀含量为
试验10:将乳化的有机萃取剂(d2:0.44m、u:1.5g/l)、d-45(d2:0.44m、u:6g/l)、煤油、d-71(2m的碳酸铵、u:2g/l)与d-45(d2:0.44m、u:6g/l)以比例2:3:1:6:6混合并进行摇晃,结果与试验8相同均产生黄色结晶且有机液乳化现象下降而使有机液澄清。
由试验10可知,总铀含量为
试验11:将乳化的有机萃取剂(d2:0.44m、u:1.5g/l)、d-45(d2:0.44m、u:6g/l)、煤油与d-71(2m的碳酸铵、u:2g/l)以比例1:2:1:2混合并进行摇晃,虽然黄色结晶产生的数量下降,但可改善有机液乳化现象而使溶液澄清。
由试验11可知,总铀含量为
试验12:取乳化的有机萃取剂(d2:0.44m、u:1.5g/l)22.5ml、d-32(d2:0.44m、u:3.5g/l)30ml、煤油15ml与d-71(2m的碳酸铵、u:2g/l)35ml混合并进行摇晃,结果使有机液产生乳化现象。
由试验12可知,总铀含量为
试验13:取乳化的有机萃取剂(d2:0.44m、u:1.5g/l)35ml、b-32(d2:0.4m、u:0.005g/l)50ml、煤油20ml与d-71(2m的碳酸铵、u:2g/l)35ml混合并进行摇晃,结果只使有机液澄清。
由试验13可知,总铀含量为
试验14:取乳化的有机萃取剂(d2:0.44m、u:1.5g/l)35ml、b-32(d2:0.4m、u:0.005g/l)50ml、煤油20ml与d-71(2m的碳酸铵、u:2g/l)53ml混合并进行摇晃,结果同样只使有机液澄清。
由试验14可知,总铀含量为
接着再以试验证明乳化现象产生的原因,并依据前述试验1-14使乳化有机液迅速恢复澄清的试验,研判产生产生乳化的原因是铀含量偏低(2-3g/l),而使碳酸铀氨(aut)结晶不完全而形成微细颗粒悬浮在有机相中,当铀含量充足时就不会产生乳化现象,固做如下试验证明:
试验15:取d-45(d2:0.45m、u:6.13g/l)50ml与d-71(2m的碳酸铵、u:2g/l)100ml混合并进行摇晃,结果产生少量黄色结晶且有机液为澄清。
由试验15可知,总铀含量为
试验16:取d-45(d2:0.45m、u:2.81g/l)30ml与d-71(2m的碳酸铵、u:2g/l)60ml混合并进行摇晃,结果有机液迅速产生乳化,且须经过久置后才能澄分。
由试验16可知,总铀含量为
试验17:取d-45(d2:0.45m、u:2.81g/l)45ml与d-71(2m的碳酸铵、u:2g/l)45ml混合并进行摇晃,结果有机液迅速产生乳化,且须经过久置后才能澄分。
由试验17可知,总铀含量为
因此综合上述试验1-17结果可整理成下列表(八)。
表(八)
由上述表(八)所表列的碳酸铀氨(aut)产品与乳化物干基分析得知,当铀含量降低时,杂质成分的含量就会增高。
因此透过前述的试验中可推论出乳化物的形成是碳酸铀铵结晶不良而成,因反应池内铀的含量不足以和2m的碳酸铵反应,使碳酸铵就比较容易洗脱有机相中的铁与磷酸塩形成碳酸铀铁铵与磷酸塩错离子化合物,且由于这些离子化合物非常细小又不易沉淀,因此会悬浮于有机相中并产生乳化现象。
而根据前述试验结果推论出乳化的原因是制程中的萃取剂不断的循环使用煤油(kerosene),在煤油(kerosene)逐渐挥发的情况下使萃取剂浓度逐渐增浓至0.44m,此时萃取剂的捉铀能力比浓度0.4m时还要来得更好,而d2t比d2d的提铀能力更强(d2t平均萃铀能力为d2d的1.6倍)且当铀含量低时,第二循环反应萃取段的有机剂除了萃取铀以外仍有余力萃取其他杂质(而萃取的杂质又以铁为最多),这些杂质在第二循环反应反萃段反萃时也会和铀一样被洗脱到碳酸铵液中,干扰碳酸铀氨(aut)产品的纯度,虽然d2d(d2ehpa+dbbp)的萃铀能力仅为d2t(d2ehpa+topo)的62.5%,但使用浓度0.4m的d2d却未发现有乳化的情况产生。
而为了避免在第二循环反应反萃段发生乳化现象,反萃段中使用0.4m的d2d或是浓度小于0.4m的d2t、反萃段所使用的d-45u要维持在10g/l以上,且须定时排放沉淀于反应池池底的aq,并使含有高浓度铀的萃取剂以稳定的速度进料,其中,org:aq的比例须维持在2:1。
依据上述改善的第二循环反应反萃段进行运转月余,发现改善后的反萃效率高达97%,且反萃出的u3o8纯度维持在96%以上,这确实证明了产品质量的改善,而反萃的过程中不再产生乳化现象,大幅的降低人力与物力的浪费。
本发明优点在于:
将fe3+/fe2+的比值控制在定值借此来克服第一循环反应反萃段效率不佳的情况。
增加第二循环反应反萃段中有机铀的含量,使产品的含铁量减少,进而增加产品的纯度。
综上所述,以上所述仅为本发明的较佳实施例,并非因此而限制本发明的专利保护范围,故举凡本发明说明书及附图所作等效变化等,皆应包括于本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!