一种氟取代核酸修饰金颗粒的制备方法
1.本发明属于化学生物领域,具体涉及一种氟取代核酸修饰金颗粒的制备方法。
背景技术:
2.核酸(nucleic acids简写:na)是脱氧核糖核酸(dna)和核糖核酸(rna)的总称,核酸具有可编程性、分子识别性和催化等特性,可以和很多的无机纳米材料相结合。已经广泛的被应用在生物传感,基因和药物递送。金纳米粒子(aunps)具有独特的物理和化学属性使得它成为了一个优秀的生物传感器支架。首先,aunps可以使用适当的配体来获得优良的生物相容性;第二,aunps的性质可以通过改变大小、形状和周围的化学环境来调整。第三,aunps具有颜色在检测方面可以通过眼睛直观的观察颜色的变化来快速、高效地检测各种的金属离子、小分子、蛋白质、核酸或者恶性细胞。第四、金颗粒具有光热效应,可以用于治疗癌症,因此,将dna和金纳米粒子进行结合构建一个生物传感系统很有必要。
3.基于金纳米颗粒(aunp)构建的球形核酸最早由mirkin及其同事于1996年提出,近年来受到了广泛关注,并在生物分析、给药和材料科学等领域得到了广泛应用。在这项开创性的研究中,通过开发一种基于金硫醇相互作用的位点特异性吸附方法来构建球形核酸。利用这种方法,成功地用巯基修饰的核酸(sna)标记上金纳米颗粒,稳定了金纳米颗粒,使其不容易在高浓度的盐离子中聚集。然而,在生理条件下,金硫键容易受到谷胱甘肽、生物硫醇、蛋白质以及一些化学物质的影响,巯基配体可能被大量的取代,造成假阳性信号出现。此外,sna探针在修饰金颗粒之前必须用二硫苏糖醇(dtt)或三(2
‑
羧基乙基)磷(tcep)进行预处理,以获得活化的sna,这也增加了时间以及成本。另外,周小明老师以及他的合作者开发了一种利用聚腺嘌呤来将无硫醇修饰dna通过冷冻的方法接在金颗粒上,但是这种方法接的dna数量有限,并且在只能在低盐浓度(0.3 m的氯化钠)下稳定。
4.为了克服金硫键假阳性信号和聚腺嘌呤dna修饰的不稳定性,我们发明了一种fna修饰金纳米颗粒,在核糖核酸五碳糖2修饰氟原子可以形成c
‑
h
…
f
‑
c的氢键并且在高温条件下稳定,因此在核糖核酸的碱基部分电子云就相对比较少,正电性增强,与金纳米颗粒表面作用增强。同时高温条件下电子云变化更为剧烈,加剧了碱基部分的正电性,加上分子静电引力作用;fna就在金颗粒上形成了一层核酸分子。fna修饰的金颗粒可以在高盐浓度下(0.8 m的氯化钠)中稳定存在,同时可以抵抗生物体中生物硫醇如谷胱甘肽(gsh)的干扰,在生物体中能够稳定的存在,这为金颗粒在生物体的传感、检测、基因递送以及核酸治疗都提供了一个非常好技术支持,对功能核酸的发展以及应用都有重要的科学意义。
技术实现要素:
5.本发明针对上述问题,提供一种氟取代核酸修饰金颗粒的制备方法,将氟取代核酸fna修饰到金颗粒上,制备的fna
‑
au能够在高盐条件下稳定存在,同时不受生物硫醇的干扰,从而实现高保真的生物传感。
6.为实现上述目的,本发明采用如下技术方案:
一种fna修饰金颗粒的制备方法,将氟取代核酸fna和金颗粒按一定比例混匀在缓冲液中,在高温下反应之后,分次加入氯化钠溶液,继续高温反应后,超滤离心,得到氟取代核酸fna修饰的金颗粒,金颗粒上形成一层核酸层。
7.上述方法以fna和金颗粒为原料;通过分子静电引力、电子云变化、氢键作用,fna在金颗粒上形成了一层核酸分子。
8.上述方法中所述氟取代核酸fna中的核酸为脱氧核糖核酸、核糖核酸中的一种或两种。
9.上述方法中所述氟取代核酸fna中氟修饰在核酸中五元糖环的2’位置,或者氟原子在碱基上的任意位置修饰,氟修饰个数为一个或多个。更进一步的任意位置、任意个数的氟修饰核酸衍生物均满足要求。
10.上述方法中所述金颗粒的是金纳米颗粒、金纳米棒、金纳米星、金纳米环、金纳米方块中的任意一种。
11.上述方法中所述缓冲液为ph在4
‑
13之间的任意种类缓冲液。
12.一种氟取代核酸修饰金颗粒的制备方法,包括以下步骤:(1)fna原液的制备:将fna溶解在无菌水中,室温条件下吹打均匀,形成均匀的fna原液;其浓度为100 μm;(2)fna修饰金颗粒的制备: fna原液和金颗粒原液按一定比例混匀在缓冲液中后,置于金属浴中高温反应之后,分次加入氯化钠溶液,继续高温反应,然后取出样品,冷却至室温,超滤管超滤三次,最后分散在缓冲液中。
13.上述步骤(1)中所述fna原液的浓度为100 μm。
14.上述步骤(2)中所述金颗粒原液为将金颗粒用超滤管离心浓缩,均匀分散在0.5 mg/ ml的二水合双(对磺酰苯基)苯基膦二钾盐(bspp)溶液中,得到0.5 um的金颗粒原液;所述金颗粒与fna之间的摩尔比例为1:1~2000。
15.上述步骤(2)所述金属浴中高温反应的温度为:50℃
‑
100 ℃;反应时间为:30 min
‑
2 h;氯化钠分8次加入,氯化钠的终浓度为0.2 m;继续高温反应的温度为50℃
‑
100 ℃,反应时间为:1 h
‑
5 h。
16.上述方法制备所得fna修饰的金颗粒在生物技术中的应用。
17.本发明的有益效果在于:本发明公开了一种氟取代核酸修饰金颗粒的制备方法,该方法简单、绿色、价格低廉,具有广泛的通用性。其中所用的fna是可编程的功能核酸。另外fna修饰的金颗粒在高盐条件下和生物硫醇中稳定,能广泛的应用在生物的传感、检测、基因递送以及核酸治疗,为核酸的应用提供了一个更好的参考。
附图说明
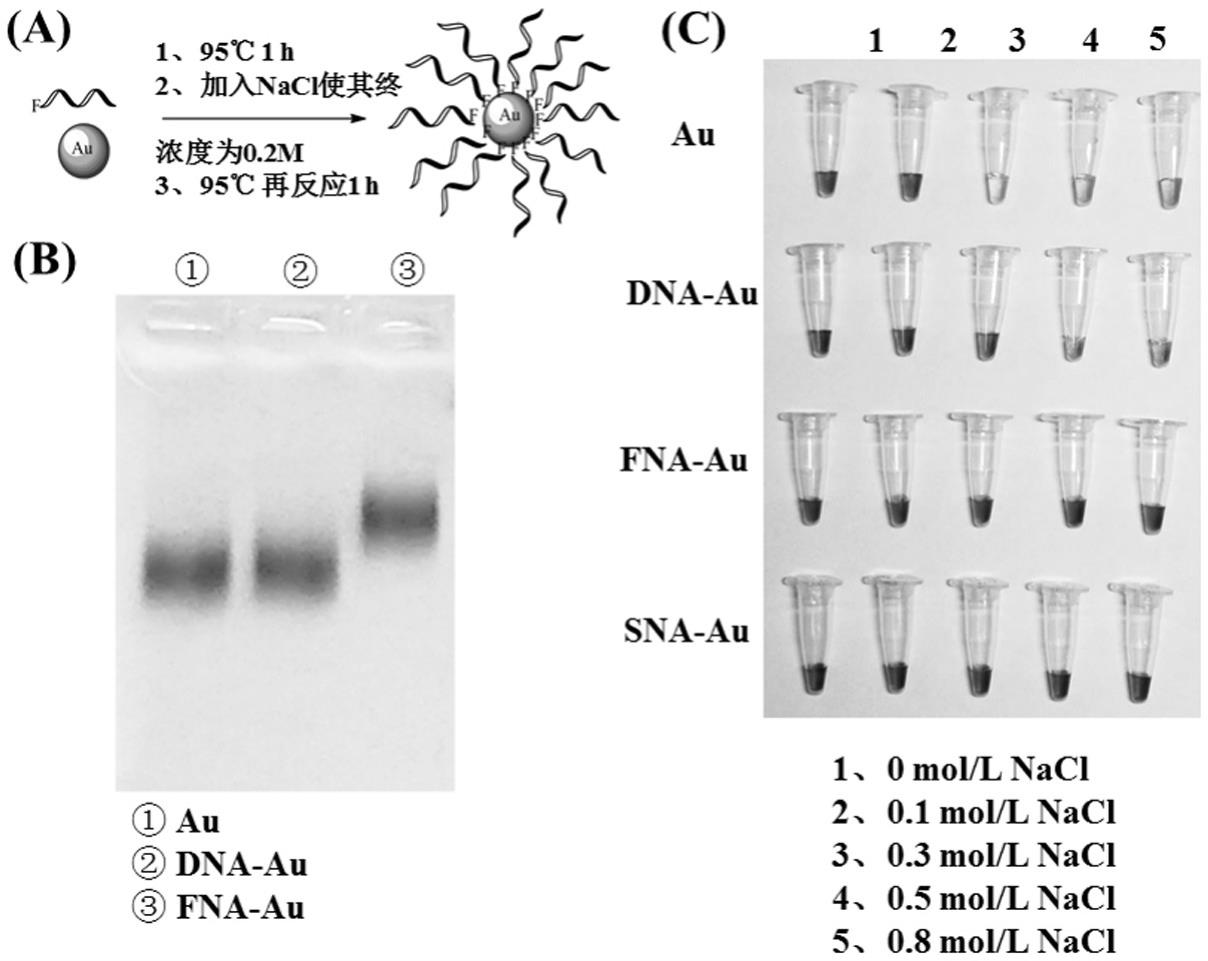
18.图1为实施例制备fna
‑
au的反应流程图(a)、琼脂糖电泳图(b)和在不同盐浓度下的实物图(c)。
19.图2为实施例制备的fna
‑
au的透射电镜图(a)、粒径分布图(b)。
20.图3为实施例制备frna
‑
au的反应流程图琼脂糖电泳图(a)、在不同盐浓度下的实物图(b)。
21.frna
‑
au的透射电镜图(c)、粒径分布图(d).图4为实施例制备的fna纳米耀斑的性能试验测试结果图,其中(a)为fna纳米耀斑和sna纳米耀斑在gsh条件的稳定性试验结果,(b)为fna纳米耀斑细胞毒性实验图,(c)为fna纳米耀斑在有无gsh条件下靶向序列的信噪比情况图,(d)为sna纳米耀斑在有无gsh条件下靶向序列的信噪比情况图。
22.图5为实施例制备的为fna纳米耀斑和sna纳米耀斑分别在l02和mcf
‑
7细胞共培养下的情况图。
具体实施方式
23.为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
24.实施例1fna
‑
au的制备:本实施例序列如下(5'
‑
3'):fna(序列:a(f)aaaaaaaccctatagcttatcagact一个氟原子修饰在腺嘌呤a的五元糖环2’位置上);sna(序列:hs
‑
aaaaaaaaccctatagcttatcagact)dna(序列:aaaaaaaaccctatagcttatcagact)以上序列购买于上海生物工程有限公司制备过程如图1所示,具体包括以下步骤:(1)将5od的fna溶解在278μl的无菌水中,室温条件下吹打,使核酸分散均匀,形成100μm的fna原液,
‑
20℃保存;将5od的sna溶解在258μl的无菌水中加入20ul140mm的三(2
‑
羧基乙基)磷(tcep)活化,室温条件下吹打,使核酸分散均匀,形成100μm的sna原液,
‑
20℃保存;(2)室温条件下,将10nm的金颗粒(购买于英国bbisolutions公司)用100kda的超滤管离心浓缩,分散在0.5mg/ml的二水合双(对磺酰苯基)苯基膦二钾盐(bspp)中充分分散均匀,得到0.5um的au
‑
10nm原液,4℃保存。
25.(3)将50μl的fna原液和100μl的au
‑
10nm原液(fna与au
‑
10nm的摩尔比为100:1)和750μl的1
×
tbe缓冲液(ph=8.0)混合,然后置于金属浴,95℃反应1h,然后分8次加入2mol/l的氯化钠每次间隔时间为10min,每次加入12.5ul,氯化钠加完之后再95℃反应1h,将样品取出冷却至室温,再用30kda超滤管将多余的未反应的fna离去,pbs洗两次,得到fna
‑
au。
26.将50μl的sna原液和100μl的au
‑
10nm原液(sna与au
‑
10nm的摩尔比为100:1)和750μl的二次水充分混合,室温下震荡1h,然后分8次加入2mol/l的氯化钠每次间隔时间为30min,每次加入12.5ul,氯化钠加完之后再震荡过夜,用30kda超滤管将多余的未反应的sdna离去,pbs洗两次,得到sna
‑
au。
27.将50μl的100μm的dna原液和100μl的au
‑
10nm原液(dna与au
‑
10nm的摩尔比为100:1)混合16h之后,加入终浓度为10mmph=7.4的磷酸盐缓冲液中和终浓度为0.1m氯化钠,室温下静止40h,用30kda超滤管将多余的未反应的dna离去,ph=7.4的磷酸盐缓冲液洗两次,得到dna
‑
au。
28.(4)取14 μl au
‑
10 nm浓度为50 nmol/l的au、dna
‑
au、fda
‑
au分别加入6 μl的50 %v/v的甘油混合均匀之后在3 wt %的琼脂糖凝胶中以5 v/cm的电压跑30 min。
29.(5)取10 μl au
‑
10 nm浓度为50 nmol/l的au、dna
‑
au、fda
‑
au分别加入20 μl、19 μl、17 μl、15 μl、12 μl的水中,然后分别加入0 μl、1 μl、3 μl、5 μl、8 μl的3 m 氯化钠,使得每一管的最终体积为30 μl。用于观察金颗粒的抗盐能力(图1c)。
30.从图1b看出fna修饰上了金颗粒,所以在琼脂糖电泳图中停留时间增加了,同时图1c看出金颗粒的抗盐能力得到了大大的提升,在0.8mol/l的氯化钠中仍然稳定。图2为制备得到的fna
‑
au的透射电镜图(图2a)、和粒径分布图(图2b)。从图中可以观察到,fna
‑
au在高温反应下金颗粒的形貌没有发生变化,同时由于fna的修饰金颗粒的水合粒径增大了。
31.实施例2 frna
‑
au的制备本实施例序列为rna 序列(5'
‑
3'):a(f)aaaaaaacccuauagcuuaucagacu(一个氟原子修饰在腺嘌呤a的五元糖环2’位置上)制备步骤(3)中fna
‑
au;其余步骤同实施例1中的fna制备和表征过程。
32.从图3a看出frna修饰上了金颗粒,在琼脂糖电泳图中停留时间增加了,同时图3b看出修饰了frna的金颗粒的抗盐能力得到了大大的提升,在0.8 mol/l的氯化钠中仍然稳定。图3c为制备得到的frna
‑
au的透射电镜图和粒径分布图(图3d)。从图中可以观察到,frna
‑
au在高温反应下金颗粒的形貌没有发生变化,同时由于frna的修饰金颗粒的水合粒径增大了。实施例3 fna
‑
au的制备制备步骤(3)中fna与au
‑
10 nm的摩尔比为1:1;其余步骤同实施例1。
33.实施例4fna
‑
au的制备制备步骤(3)中fna与au
‑
10 nm的摩尔比为2000:1;其余步骤同实施例1。
34.实施例5性能试验测试实施例1制备所得的fna修饰金颗粒的性能。
35.本发明的fna修饰金颗粒上的fna保留了核酸的功能,核酸可以根据碱基互补配对原则进行互补序列的杂交。因此,我们通过碱基互补配对的方法,在fna上杂交了一条修饰花菁染料的互补序列,制备了纳米耀斑。同时对纳米耀斑的性能进行测试。
36.1. fna纳米耀斑和sna纳米耀斑的制备取200 nm的fna
‑
au或sna
‑
au样品100 μl,加入50 μl浓度为100 μm的5’端末端修饰了花菁染料的com
‑
cy5(序列:tcaacatcagtctgataagctataggg
‑
cy5)(参考文献:qing zhihe,luo guoyan,xing shuohui et al. pt
‑
s bond
‑
mediated nanoflares for high
‑
fidelity intracellular applications by avoiding thiol cleavage.[j] .angew chem int ed engl, 2020, 59: 14044
‑
14048.)(cy5,激发波长650 nm,发射波长665 nm)在37℃ ph=7.4的pbs中孵育12 h后,用30 kda超滤管将多余的未反应的com
‑
cy5离去,pbs洗两次,得到fna纳米耀斑或sna纳米耀斑。
[0037]
2. 取20 nm的fna纳米耀斑或sna纳米耀斑样品30 μl,分别加入含有不同浓度(0、100、500、1000、5000、10000、20000、50000 μmol/l)的gsh(谷胱甘肽) 60 μl,然后加入510 μl的pbs,孵育24 h,后测定665 nm的荧光峰。
[0038]
3. 以乳腺癌细胞系mcf
‑
7为验证模型。将mcf
‑
7细胞接种在96孔板中,孵育24 h,用pbs清洗三次。分别加入含有不同浓度(0、0.5、1、2、3、4、5、6 nmol/l)fna纳米耀斑或sna
纳米耀斑的培养基100 μl,孵育24 h。然后取出上清,用pbs清洗三次,加入含有cck
‑
8(cell counting kit
‑
8,碧云天)的培养基100 μl,孵育1h,用酶标仪测定450 nm的吸收值。
[0039]
4. fna纳米耀斑或sna纳米耀斑在有无gsh条件下对靶向mirna
‑
21序列(target mirna
‑
21:tagcttatcagactgatgttga)(参考文献:qing zhihe,luo guoyan,xing shuohui et al. pt
‑
s bond
‑
mediated nanoflares for high
‑
fidelity intracellular applications by avoiding thiol cleavage.[j] .angew chem int ed engl, 2020, 59: 14044
‑
14048.)的信噪比情况图。取20 nm的fna纳米耀斑或sna纳米耀斑样品30 ul,分别加入含有不同浓度(0、20 mmol/l)的gsh 60 μl,然后加入60 μl浓度为600 nmol/l的靶向mirna
‑
21序列,在加入450 μl的pbs,孵育24 h,后测定665 nm的荧光峰。
[0040]
5. 以在人正常细胞l02和乳腺癌细胞mcf
‑
7共培养为模型。将l02和mcf
‑
7细胞以1:1的比例接种在荧光板中,孵育24 h,用pbs清洗三次。然后,分别加入含有2 nmol/l的fna纳米耀斑或sna纳米耀斑的培养基1 ml,共同孵育4 h。细胞用pbs清洗三次。加入dapi染核10 min,细胞用pbs清洗三次。用共聚焦显微镜拍照cy5通道的荧光。
[0041]
图4为性能试验测试结果图,其中(a)为fna
‑
au在gsh条件的稳定性试验结果。由图中可见,由于fna不受gsh的影响,fna
‑
纳米耀斑荧光没有恢复,而au
‑
s受到gsh的影响,荧光恢复明显;(b)为fna
‑
纳米耀斑细胞毒性实验图,图中可以看出fna
‑
纳米耀斑细胞毒性小;(c)为fna
‑
纳米耀斑在有无gsh条件下靶向序列的信噪比情况图,可以看出fna
‑
纳米耀斑在有无gsh条件下靶向序列的信噪比没有太大变化,而(d)sna纳米耀斑受到gsh的影响,在gsh存在的条件下信噪比变小了。
[0042]
图5为人正常细胞l02和乳腺癌细胞mcf
‑
7共培养模型下fna
‑
纳米耀斑特异的识别出肿瘤细胞mcf
‑
7。正常细胞l02和乳腺癌细胞mcf
‑
7细胞中都含有gsh,但是乳腺癌细胞mcf
‑
7还高表达mirna
‑
21,fna
‑
纳米耀斑只有在mirna
‑
21存在的时候才会有荧光。而sna纳米耀斑在gsh存在的时候就能荧光恢复,这导致了 sna纳米耀斑不能准确的区分出正常细胞和癌细胞。
[0043]
由上述试验可见,所制备的fna纳米耀斑在生物硫醇的存在条件下,能够高保真的检测靶向序列mirna
‑
21,能够在混合的细胞体系中特异的识别出癌细胞。
[0044]
总之,本发明公开了一种fna修饰金颗粒的制备方法,本发明以fna和金颗粒为原料;通过分子静电引力、电子云变化、氢键作用,fna在金颗粒上形成了一层核酸分子。本发明制备的fna修饰金颗粒与传统的金硫键修饰方法相比,方法更简单、绿色、成本更低廉,与和聚腺嘌呤dna修饰方法相比可以在更高盐浓度下(0.8 mol/l的氯化钠)中稳定存在,应用更广泛,并且本发明的fna修饰的金颗粒可以抵抗生物体中生物硫醇如谷胱甘肽(gsh)的干扰,在体内肿瘤区域过表达gsh的条件下不会降解,从而获得高保真的目标信号。更重要的是,我们能够在混合的正常细胞和肿瘤细胞体系中将癌细胞区分出来,展现出肿瘤的特异性识别能力。
[0045]
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1