金属混合溶液的制造方法以及混合金属盐的制造方法与流程
1.本说明书公开与金属混合溶液的制造方法以及混合金属盐的制造方法有关的技术。
背景技术:
2.近年来,从资源的有效利用的观点出发,广泛研讨了从因产品寿命或制造不合格等理由而废弃的包含锂离子二次电池的正极材料的锂离子电池废弃物等,通过湿式处理回收其中所包含的钴、镍这样的有价金属。
3.在从例如锂离子电池废弃物回收有价金属的工艺中,通常,将经过焙烧等规定的工序而得到的电池粉等添加至酸中进行浸出,得到溶解有其中可能包含的钴、镍、锰、铁以及铝等的浸出后液。
4.然后,从浸出后液分离除去铁等,并进一步通过多阶段的溶剂萃取,分离液中的各金属离子。在多阶段的溶剂萃取中,具体而言,首先将锰离子以及铝离子萃取至溶剂中而除去。接着,在对钴离子进行萃取及反萃取之后,对镍离子进行萃取及反萃取。针对通过各反萃取所得到的包含钴离子的溶液以及包含镍离子的溶液分别进行电解,将钴以及镍分别以金属的状态回收(参照例如专利文献1)。
5.在先技术文献
6.专利文献
7.专利文献1:日本特开2014-162982号公报
技术实现要素:
8.发明要解决的课题
9.然而,在上述那样的金属的回收工艺中,如果能够将钴、镍以及锰以溶解有它们中的两种或三种金属的较高纯度的金属混合溶液、或者包含它们中的两种或三种金属的各金属盐的较高纯度的混合金属盐的状态进行回收,则有可能能够将其直接用作锂离子电池的正极材料的制造原料等。例如,在得到了溶解有钴、镍以及锰这三种金属的较高纯度的金属混合溶液、或者包含这三种金属的各金属盐的较高纯度的混合金属盐的情况下,有可能能够将其直接用作锂离子电池的三元系正极材料的制造原料等。在该情况下,能够省略前述的电解等处理,从而能够期待工序的简化、成本的大幅削减。
10.在此,在前述的金属的回收工艺中,在最初的溶剂萃取中,不仅萃取铝离子还萃取锰离子,因此由于锰的欠缺或不足,无法得到以适当地比例含有锰的两种或三种金属的金属混合溶液、混合金属盐。但是,如果铝未被充分萃取除去,则存在作为杂质包含于金属混合溶液、混合金属盐而使纯度降低的担忧。
11.在本说明书中,公开一种能够有效地制造包含锰离子、钴离子以及镍离子中的至少一种的较高纯度的金属混合溶液或者混合金属盐的金属混合溶液的制造方法以及混合金属盐的制造方法。
12.用于解决课题的手段
13.本说明书公开的金属混合溶液的制造方法是制造包含钴离子及镍离子中的至少一种、和锰离子的金属混合溶液的方法,其中,所述金属混合溶液的制造方法包括:al除去工序,在该al除去工序中,针对将锂离子电池废弃物的电池粉供给至浸出工序所得到的、至少包含钴离子及镍离子中的至少一种、锰离子、和铝离子的酸性溶液,将所述酸性溶液中的锰离子的至少一部分残留于水相,同时将铝离子萃取至溶剂而除去;以及金属萃取工序,在该金属萃取工序中,针对通过所述al除去工序所得到的萃取残液,使用包含羧酸系萃取剂的溶剂使平衡ph为6.5~7.5,将萃取残液中的钴离子及镍离子中的至少一种、和锰离子萃取至该溶剂,之后从该溶剂反萃取钴离子及镍离子中的至少一种、和锰离子。
14.本说明书公开的混合金属盐的制造方法是制造包含锰的金属盐、和钴及镍中的至少一种的金属盐的混合金属盐的方法,其中,所述混合金属盐的制造方法包括:析出工序,在该析出工序中,从通过上述的金属混合溶液的制造方法所得到的金属混合溶液,析出包含锰的金属盐、和钴及镍中的至少一种的金属盐的混合金属盐。
15.发明效果
16.根据上述的金属混合溶液的制造方法、混合金属盐的制造方法,能够有效地制造包含钴离子及镍离子中的至少一种、和锰离子的较高纯度的金属混合溶液或者混合金属盐。
附图说明
17.图1是示出包括一实施方式的混合金属盐的制造方法的工艺的一例的流程图。
18.图2是示出表示使用了包含羧酸系萃取剂(va-10)的溶剂的萃取中的各金属的萃取率相对于ph的关系的萃取曲线的一例的图表。
具体实施方式
19.以下,对上述的金属混合溶液的制造方法、混合金属盐的制造方法的实施方式进行详细说明。
20.一实施方式的金属混合溶液的制造方法是制造包含锰离子、钴离子以及镍离子中的至少一种的金属混合溶液的方法,其包括:al除去工序,针对将锂离子电池废弃物的电池粉供给至浸出工序而得到、且至少包含锰离子及铝离子、以及钴离子及镍离子中的至少一种的酸性溶液,将所述酸性溶液中的锰离子的至少一部分残留于水相,并且将铝离子萃取至溶剂而除去;以及金属萃取工序,针对在所述al除去工序中得到的萃取残液,使用包含羧酸系萃取剂的溶剂使平衡ph为6.5~7.5,将萃取残液中的钴离子及镍离子中的至少一种和锰离子萃取至该溶剂中,之后从该溶剂反萃取钴离子及镍离子中的至少一种、和锰离子。
21.该实施方式例如能够应用于图1所例示那样的从锂离子电池废弃物回收金属的工艺。在此,根据图1,接下来进行详细说明。
22.(锂离子电池)
23.作为对象的锂离子电池废弃物是至少包含钴和/或镍和锰作为正极活性物质、且能够在移动电话等各种电子设备等中使用的锂离子二次电池,且由于电池产品的寿命、制造不合格或者其他理由而被废弃了的废弃物。从资源的有效利用的观点出发,优选从上述
那样的锂离子电池废弃物回收有价金属。另外,在此,目的在于,能够以高纯度回收作为有价金属的钴和/或镍和锰、并将其再次用于锂离子二次电池的制造。
24.锂离子电池废弃物具有作为将其周围包裹的外装的、包含铝的框体。作为该框体,例如存在仅由铝构成的框体、包含铝以及铁、铝层压板等的框体。另外,锂离子电池废弃物有时在上述的框体内包含正极活性物质或铝箔(正极基材),该正极活性物质由选自由锂、镍、钴以及锰构成的组的一种单独金属氧化物或两种以上的复合金属氧化物等构成,该铝箔(正极基材)是利用例如聚偏氟乙烯(pvdf)等有机粘合剂等涂敷并固着有正极活性物质而成的。另外,除此以外,锂离子电池废弃物中有时包含铜、铁等。而且,在锂离子电池废弃物中,通常在框体内包含电解液。作为电解液,例如有时使用碳酸乙烯酯、碳酸二乙酯等。
25.对于锂离子电池废弃物,大多情况下进行前处理工序。前处理工序中有时包括焙烧处理、粉碎处理以及筛分处理。由此,得到电池粉。
26.在焙烧处理中,对上述的锂离子电池废弃物进行加热。该焙烧处理例如以使锂离子电池废弃物中所包含的锂、钴等金属变化为容易溶解的形态的目的而进行。在焙烧处理中,优选进行将锂离子电池废弃物在例如450℃~1000℃、优选地600℃~800℃的温度范围内保持0.5小时~4小时的加热。在此,能够使用回转窑炉等各种炉、在大气气氛下进行加热的炉等各种各样的加热设备来进行。
27.在焙烧处理后,能够进行用于从锂离子电池废弃物的框体取出正极材料以及负极材料的粉碎处理。粉碎处理是为了对锂离子电池废弃物的框体进行破坏、并且从涂敷有正极活性物质的铝箔选择性地分离正极活性物质而进行的。
28.在粉碎处理中,能够使用各种公知的装置或设备,但特别优选使用能够一边切断锂离子电池废弃物一边施加冲击来进行粉碎的冲击式的粉碎机。作为该冲击式的粉碎机,能够举出样本磨机(sample mill)、锤磨机(hammer mill)、针磨机(pin mill)、翼磨机(wing mill)、旋风磨机(tornado mill)、锤式粉碎机(hammer crusher)等。需要说明的是,可以在粉碎机的出口设置筛网,由此,锂离子电池废弃物在被粉碎至能够通过筛网的程度的大小时,从粉碎机通过筛网排出。
29.在通过粉碎处理将锂离子电池废弃物粉碎之后,例如处于除去铝的粉末的目的,进行使用适当的网眼的筛子进行筛分的筛分处理。由此,能够在筛上残留铝、铜,在筛下得到一定程度除去了铝、铜后的电池粉。
30.电池粉中包含锰、及钴和/或镍,例如有时以0质量%~30质量%包含钴,以0质量%~30质量%包含镍,以1质量%~30质量%包含锰。此外,电池粉中可能包含铝、铁、铜等。
31.(浸出工序)
32.电池粉被供给至浸出工序。在浸出工序中,将上述的电池粉添加至硫酸等酸性浸出液来进行浸出。浸出工序可以在公知的方法或条件下进行,但优选将ph设为0.0~2.0,将氧化还原电位(orp值,银/氯化银电位基准)设为0mv以下。
33.需要说明的是,也可以根据需要,在基于上述的酸性浸出液的浸出之前,预先使电池粉与水接触,仅将锂离子电池废弃物中所包含的锂而使其分离。在该情况下,将使电池粉与水接触而浸出锂后的水浸出残渣添加至上述的酸性浸出液来进行酸浸出。
34.通过酸浸出,得到溶解有规定的金属的浸出后液。在此所说的规定的金属包括钴、
镍、锰、铝。规定的金属有时还包括锂、铁等。需要说明的是,有时包含于电池粉中的铜不通过酸浸出而溶解,而能够残留于酸浸出残渣中进行除去。需要说明的是,在铜被浸出并溶解于浸出后液中的情况下,也可以在后述的中和工序之前进行通过电解除去铜的工序。
35.例如,有时浸出后液中的钴浓度为0g/l~50g/l,镍浓度为0g/l~50g/l,锰浓度为1g/l~50g/l,铝浓度为0.010g/l~10g/l,铁浓度为0.1g/l~5g/l。有时锂浓度为例如0g/l~7.0g/l。有时钙浓度为例如0g/l~1.0g/l。
36.(中和工序)
37.接着,能够对浸出后液进行中和工序。在中和工序中,首先,向浸出后液添加氢氧化钠等碱,以成为规定的ph的方式进行中和。由此,浸出后液中溶解的铝的一部分沉淀。然后,通过使用了压滤机、浓缩器等的固液分离,能够将包含该铝的一部分的残渣除去。
38.在此,更优选通过碱的添加而使ph成为4.0~6.0。另外,在此,浸出后液的氧化还原电位(orpvsag/agcl)优先设为-500mv~100mv。液温优选设为50℃~90℃。
39.之后,添加氧化剂,并且将ph调整至3.0~4.0的范围内,由此能够使液中的铁沉淀。通过氧化剂的添加而液中的铁从2价向3价氧化,3价的铁以比2价的铁低的ph作为氧化物或者氢氧化物沉淀。多数情况下,铁成为氢氧化铁(fe(oh)3)等固体而沉淀。沉淀的铁能够通过固液分离而除去。
40.为了使铁沉淀,氧化时的orp值优选设为300mv~900mv。需要说明的是,在氧化剂的添加之前,为了使ph降低,例如能够添加硫酸、盐酸、硝酸等酸。
41.氧化剂只要能够将铁氧化则没有特别限定,例如能够使用二氧化锰。用作氧化剂的二氧化锰可以是试剂,也可以是是将包含二氧化锰的正极活性物质、正极活性物质浸出而得到的含锰浸出残渣。
42.在氧化剂的添加后,能够添加氢氧化钠、碳酸钠、氨等碱以将ph调整至规定的范围。
43.在中和工序后,得到作为中和后液的酸性溶液。酸性溶液至少包含钴离子和/或镍离子、锰离子和铝离子。酸性溶液有时还包含选自由镁离子、钠离子、锂离子以及钙离子构成的组的一种以上的金属离子。
44.例如,有时酸性溶液中的钴浓度为0g/l~50g/l,镍浓度为0g/l~50g/l,锰浓度为1g/l~50g/l。铝浓度优选为0.010g/l~1g/l,更优选为0.010g/l~0.5g/l。有时镁浓度为例如0g/l~0.1g/l。有时钠浓度为例如0g/l~40g/l。有时锂浓度为例如0g/l~7.0g/l。有时钙浓度为例如0g/l~1.0g/l。
45.(al除去工序)
46.在中和工序后,进行将上述的酸性溶液中的铝离子萃取至溶剂以将其除去的al除去工序。在此,将酸性溶液中的锰离子残留于萃取残液(水相),同时将铝离子萃取至溶剂(有机相)。由此,铝离子被除去,得到至少包含钴离子和/或镍离子、和锰离子的萃取残液。在此,al除去工序后所得到的萃取残液中的钴离子的含量和/或镍离子含量、和锰离子的含量分别以质量基准优选为中和后液(酸性溶液)中的各离子的含量的80%以上,更优选为90%以上。
47.在al除去工序中,如果锰离子几乎不被萃取而铝离子被萃取,则能够使用磷酸酯系萃取剂、羧酸系萃取剂等各种萃取剂,与此相应地在萃取时设为适当的平衡ph。
48.作为能够在al除去工序中使用的羧酸系萃取剂,可举出例如新癸酸、环烷酸等。其中,从尽可能地不萃取锰离子而萃取铝离子这样的观点出发,优选新癸酸。羧酸系萃取剂优选包含碳原子数8~16的羧酸。具体而言,能够使用shell化学公司制的versatic acid 10(也称作“va-10”。)等。在该情况下,萃取时的平衡ph优选设为4.0~5.0,更有选设为4.3~4.7。在过低的平衡ph下,有可能铝离子未被充分地萃取至溶剂而大量地残存于酸性溶液中。另一方面,在过高的平衡ph下,铝被氢氧化而成为固体的氢氧化铝,无法被溶剂萃取,此外,如能够从图2所掌握的那样,钴离子、镍离子、锰离子有可能被萃取至溶剂。如果使用包含羧酸系萃取剂的溶剂、且设为上述那样的平衡ph,则能够将几乎全部的铝离子除去、同时将绝大多数的钴离子和/或镍离子、和锰离子残留于萃取残液(水相)。在此,图2是针对表1所示的组成的酸性溶液,作为萃取剂使用包含va-10的溶剂,进行将平衡ph在ph3.0~ph7.5的范围内变更了的平衡ph的条件不同的多个萃取试验,绘制在这些萃取试验中分别得到的各金属的萃取率(基于表1的酸性溶液中的各金属的量以及萃取残液中残留的各金属的量而计算出)而制成的图表。
49.[表1]
[0050] nicomnmgcaal浓度(g/l)31.369.9810.380.01640.450.49
[0051]
在使用萃取剂的情况下,典型地利用烃系有机溶剂稀释而得到溶剂。作为有机溶剂,可举出芳香族系、石蜡系、环烷系等。例如,有时溶剂中的磷酸酯系萃取剂的浓度设为20体积%~30体积%,另外,溶剂中的羧酸系萃取剂的浓度设为20体积%~30体积%。但是,并不局限于此。需要说明的是,o/a比有时设为1.0~5.0。
[0052]
上述的萃取能够基于通常的方法来进行。作为其一例,使溶液(水相)与溶剂(有机相)接触,典型地通过混合器将它们搅拌混合例如5~60分钟,使离子与萃取剂反应。萃取时的温度设为常温(15~25℃左右)~60℃以下,根据萃取速度、分相性、有机溶剂的蒸发的理由而优选在35~45℃下实施。之后,通过沉降器,利用比重差将混合后的有机相与水相分离。后述的金属萃取工序的萃取也能够在实施上同样地进行。
[0053]
在上述那样的al除去工序后所得到的萃取残液中,例如有时钴浓度为0g/l~50g/l,镍浓度为0g/l~50g/l,锰浓度为1g/l~50g/l,铝浓度为0.001g/l以下。
[0054]
(金属萃取工序)
[0055]
针对al除去工序后的萃取残液,进行对其中包含的钴离子和/或镍离子、和锰离子中的两种或者三种金属离子一并进行萃取以及反萃取的金属萃取工序。由此,使有时包含于萃取残液的钠离子、钙离子、锂离子、镁离子等杂质残留于水相而从该两种或者三种金属离子分离,得到包含该两种或者三种金属离子的作为反萃取后液的金属混合溶液。
[0056]
在金属萃取工序中,为了萃取上述的三种金属离子,使用包含羧酸系萃取剂的溶剂,且将平衡ph设为6.5~7.5。如果平衡ph处于该范围内,则根据图2所例示的萃取曲线可知,能够有效地萃取钴离子和/或镍离子、和锰离子,并且能够使杂质残留于水相。平衡ph更优选设为6.8~7.2。
[0057]
关于羧酸系萃取剂,与上述内容同样地,可以是环烷酸等,但优选包含新癸酸,另外优选包含碳原子数8~16的羧酸,特别优选va-10。在使用了包含新癸酸的羧酸系萃取剂时,能够不萃取其他金属离子,而有效地萃取钴离子和/或镍离子、和锰离子。
[0058]
羧酸系萃取剂可以用芳香族系、石蜡系、环烷系等有机溶剂稀释而成为溶剂。溶剂中的羧酸系萃取剂的浓度优选设为20体积%~30体积%。由此,能够使杂质的大部分残留于水相,同时充分地萃取锰离子、以及钴离子和/或镍离子。o/a比优选设为1.0~1.5。如果o/a比处于该范围内,则几乎不萃取杂质,而充分地萃取锰离子、以及钴离子和/或镍离子。
[0059]
在将钴离子和/或镍离子、和锰离子萃取至溶剂后,对该溶剂进行反萃取,将钴离子和/或镍离子和锰离子转移至水相。具体而言,使溶剂与硫酸或盐酸等反萃取液混合,通过混合器等搅拌例如5~60分钟。作为反萃取液,优选使用硫酸。在使用了硫酸的反萃取液的情况下,反萃取后液即金属混合溶液成为硫酸溶液。为了有效地反萃取溶剂中的锰离子、以及钴离子和/或镍离子,反萃取液的酸浓度优选调整为0.05g/l~200g/l(ph:-0.6~3.0),更优选调整为1.5g/l~15g/l(ph:0.5~1.5)。反萃取的温度可以设为常温~60℃以下,根据反萃取速度、分相性、有机溶剂的蒸发的理由而优选在35~45℃下实施。
[0060]
金属混合溶液中包含钴离子和/或镍离子、和锰离子。例如,有时反萃取后液中的钴浓度为0g/l~50g/l,镍浓度为0g/l~50g/l,锰浓度为1g/l~50g/l。反萃取后液有时包含作为杂质的钠、钙、镁,但该杂质的合计浓度优选为1.0g/l以下。
[0061]
(析出工序)
[0062]
在析出工序中,从通过上述的金属萃取工序所得到的金属混合溶液(反萃取后液)析出包含钴和/或镍以及锰的各金属盐的混合金属盐。
[0063]
在此,例如,向金属混合溶液添加氢氧化钠等碱,将ph设为9.0~10.0,使钴和/或镍和锰沉淀。此时的orp值(银/氯化银电位基准)能够设为例如0mv~600mv。液温能够设为60℃~90℃。
[0064]
在作为通过之后的固液分离所得到的中和残渣的混合金属盐中可能混合地包含钴和/或镍和锰的各金属盐、例如氢氧化钴和/或氢氧化镍和氢氧化锰等。另外,中和残渣有时包含各金属的氧化物co3o4、mn3o4、mn2o3、ni3o4等。
[0065]
需要说明的是,也可以根据需要,在利用水等对上述的中和残渣进行清洗之后,使其溶解于硫酸酸性溶液,并对其进行加热浓缩或冷却,从而得到包含硫酸钴和/或硫酸镍和硫酸锰的混合金属盐。
[0066]
在上述那样的包含钴和/或镍和锰的各氢氧化物或者各硫酸盐等的混合金属盐中,例如有时钴的含量为0质量%~60质量%,镍的含量为0质量%~60质量%,锰的含量为1质量%~60质量%。另外,在混合金属盐中,优选作为杂质的钠的含量为60质量ppm以下,钙的含量为10质量ppm以下,镁的含量为10质量ppm以下。
[0067]
上述那样的混合金属盐与钴、镍以及锰的各金属相比能够以低成本容易地回收,并且有可能适合用于锂离子电池的制造。
[0068]
实施例
[0069]
接下来,试验性地实施了上述的混合金属盐的制造方法,因此以下进行说明。但是,在此的说明仅以例示为目的,而并不旨在限定于此。
[0070]
(实施例1)
[0071]
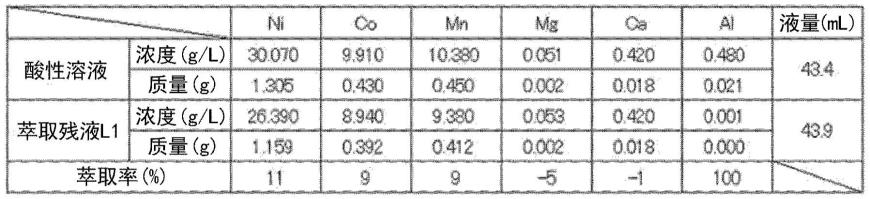
针对表2所示的组成的酸性溶液43.4ml,作为萃取剂使用包含va-10的溶剂217ml(萃取溶剂s1)并使平衡ph成为5.0,进行了铝的萃取
·
除去。溶剂中的va-10的浓度设为25%,o/a比设为1.0。在此,镍离子、钴离子、锰离子的大部分未被萃取,铝离子的大部分被
萃取。将根据酸性溶液中的各金属浓度和萃取残液(萃取残液l1)中的各金属浓度、以及酸性溶液中的各金属的含量和萃取残液(萃取残液l1)中的各金属的含量计算出的萃取率示于表2。铝离子被100%萃取。另一方面,镍离子的萃取率为11%,钴离子的萃取率为9%,锰离子的萃取率为9%,均能够保持在10%左右。需要说明的是,在本试验中使用分液漏斗进行了试验,但在操作中通过以多级逆流的方式进行萃取,可期待能够萃取铝离子,不萃取镍离子、钴离子、锰离子。
[0072]
[表2]
[0073][0074]
针对28.0ml的上述的萃取残液l1,在作为萃取剂而使用包含va-10的溶剂155ml(萃取溶剂s2)使平衡ph为7.0的条件下,将钴离子、镍离子以及锰离子萃取至该溶剂,将其他元素残留于水相(萃取残液l2)。溶剂中的va-10的浓度设为25%,o/a比设为1.0。将萃取残液l2中的各金属浓度、基于供给至试验的萃取残液l1中的各金属的含量和萃取残液l2中的各金属的含量计算出的溶剂中的金属量以及萃取率示于表3。镍离子的萃取率为100%,钴离子的萃取率为100%,锰离子的萃取率为99%,均能够萃取几乎全部量。另一方面,关于镁,能够萃取45%,将剩余的55%残留于水相。
[0075]
[表3]
[0076][0077]
针对进行了上述的萃取后的155ml的上述的萃取溶剂s2,使用硫酸浓度为1.5g/l且ph为1.5的反萃取液155ml(o/a比=1)进行了反萃取。由此,得到作为反萃取后液的金属混合溶液。将通过该反萃取所得到的金属混合溶液(反萃取后液)中的各金属浓度以及含量示于表4。其结果是,镍离子、钴离子、锰离子能够通过反萃取而将全部量回收至水相,另一方面,镁未被反萃取而能够残留于溶剂。
[0078]
[表4]
[0079][0080]
根据上述的结果,通过在上述的各工序中对酸性溶液进行处理,从而酸性溶液中所包含的铝被除去全部量,能够将镍离子、钴离子、锰离子的90%左右回收至金属混合溶液。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1