一种制备高纯四氧化三锰和高纯氧化镁的方法
1.本发明涉及湿法冶金技术领域,特别涉及一种制备高纯四氧化三锰和高纯氧化镁的方法。
背景技术:
2.四氧化三锰作为一种重要的无机功能材料,被广泛的用于催化活性成分、电磁材料、电化学以及空气净化等领域。近年来,随着新能源领域的发展,动力锂离子电池的需求也在不断上升,作为limn2o4制备的优质原料,高纯mn3o4的需求也随之激增。目前,mn3o4的制备方法可以根据原材料的不同分为一下几种:电解金属锰悬浮液催化氧化法、还原法、焙烧法和锰盐水热氧化法等,主要以金属锰、二氧化锰、硫酸锰和碳酸锰等锰系产品为原料,存在能耗高、成本高、产品杂质含量高等问题。
3.采用锰矿为原料,将锰矿浸出液净化后,制备高纯四氧化三锰,可以有效地节约能源和试剂消耗。中国专利申请cn101049971a公开了一种以软锰矿为原料制备高纯四氧化三锰的方法,将软锰矿通过稀酸浸泡、二氧化硫还原、化学除杂后,在碱性条件下采用空气氧化,制备得到高纯四氧化三锰。中国专利申请cn110697786a公开了一种四氧化三锰的制备方法,以碳酸锰矿为原料,通过浸出、中和、除重金属、除钙镁、净化、水解沉淀和氧化过程,制备得到高纯四氧化三锰。
4.由于我国锰矿石以低品位矿石为主,以锰矿直接制备四氧化三锰,仍存在着四氧化三锰存在纯度不高,质量稳定性差等缺点。另一方面,现有的沉淀除杂工艺,虽然可以有效地去除重金属离子,但未能去除镁离子,不仅影响四氧化三锰的质量,而且造成了镁资源的浪费。因此,亟需一种环境友好,经济效益好的新工艺解决目前高纯四氧化三锰生产方法中存在的能耗高、质量稳定性差和伴生资源未得到合理利用的问题。
技术实现要素:
5.为了解决现有技术中存在的上述技术问题,本发明提供了一种制备高纯四氧化三锰和高纯氧化镁的方法。
6.为了达到上述目的,本发明的实施例提供了一种制备高纯四氧化三锰和高纯氧化镁的方法,所述方法包括如下步骤:
7.s1:将锰矿石破碎后,用酸性溶液连续浸出,得到浸出渣和浸出液,过滤;
8.s2:向所述浸出液中添加氧化剂氧化,加入碱,调节浸出液ph至4~6,沉淀,再加入sdd去除重金属杂质,过滤,得到净化液和沉淀渣;
9.s3:采用有机相萃取所述净化液中的锰,得到负载有机相和萃余液,用所述净化液对所述负载有机相进行洗涤,得到富含锰负载有机相和洗涤液,所述洗涤液返回净化液中循环;
10.s4:用碱性溶液对所述富含锰负载有机相进行反萃,分离,得到反萃溶液和再生有机相,所述再生有机相返回步骤s3中进行循环使用;
11.s5:将所述反萃溶液进行固液分离,烘干,得到四氧化三锰和滤液,所述滤液返回至步骤s1中进行循环使用;
12.s6:将所述萃余液中添加碱性溶液进行沉淀,经固液分离得到氢氧化镁和硫酸铵溶液,所述氢氧化镁经洗涤煅烧得到氧化镁;
13.s7:将所述硫酸铵溶液进行蒸发结晶,得到硫酸铵和蒸发溶液;
14.所述四氧化三锰纯度为70.50%~71.34%(以mn计),d
50
为2.86~9.97μm;
15.所述氧化镁纯度为99.51%~99.85%(以mgo计),堆积密度0.406~0.435g/cm3。
16.进一步的,所述有机相由经皂化剂皂化的萃取剂和稀释剂组成,萃取剂在有机相中的浓度为50~500g/l;所述萃取剂为α-羟基-2-乙基己基次膦酸、α-羟基-2-乙基-2-己烯次膦酸、正癸酸或新癸酸中的至少一种,萃取剂的皂化率为5%~50%;所述稀释剂为磺化煤油、航空煤油、260号溶剂油、escaid110、c8~c
13
的高碳醇中的至少一种,所述皂化剂为氢氧化钠溶液、碳酸钠溶液、碳酸氢钠溶液、氨水、碳酸铵溶液、碳酸氢铵溶液、氢氧化镁悬浮液中的至少一种,浓度为20%~30%。
17.进一步的,所述酸性溶液为硫酸和/或所述步骤s5中滤液滤液,所述酸性溶液和锰矿石的液固体积质量比为1.2~5:1,所述硫酸使用量为188~620kg/t原矿;浸出液ph为1~7。
18.进一步的,所述步骤s2中氧化剂为二氧化锰和/或双氧水,所述碱为碳酸锰矿石、碳酸锰、碳酸镁、氧化钙、一氧化锰、氧化镁、氢氧化钠、氢氧化钾中的至少一种。
19.进一步的,所述萃取为多级逆流萃取,所述多级逆流萃取级数为2~10级,所述有机相与水相的体积比(o:a)为1~6:1。
20.进一步的,所述反萃为多级逆流反萃取,所述多级逆流反萃取级数为1~5级,所述有机相与水相的体积比(o:a)为1~5:1。
21.进一步的,所述煅烧温度为500~1000℃。
22.进一步的,所述步骤s4中碱性溶液为氢氧化钠溶液、氨水、氢氧化钾溶液、氢氧化锂溶液中的至少一种,所述碱性溶液的浓度为0.5~2mol/l。
23.进一步的,所述净化液ph为3~7。
24.进一步的,所述步骤s6中碱性溶液为氨水和/或所述步骤s7中蒸发溶液。
25.本发明通过浸出和除杂工艺得到含硫酸锰和硫酸镁的溶液;通过萃取得到负载锰的有机相和含镁萃余液,实现锰镁的高效分离;通过碱液对负载有机相进行反萃,直接得到再生有机相和四氧化三锰;萃余液通过碱液沉淀得到氢氧化镁沉淀,将氢氧化镁洗涤后煅烧得到高纯氧化镁产品。
26.上述方案的具体反应原理如下:
27.锰矿石中一般除了含有锰和镁外,还伴生铁、铜、铝、镍、铅等杂质。使用酸性溶液对锰矿石进行连续逆流浸出,锰矿石中碳酸锰和碳酸镁与酸反应,以锰离子和镁离子的形式进入溶液中,同时杂质金属也以离子的形式进入溶液中,得到浸出液和浸出渣。
28.浸出液中铁一般为fe
2+
,需要使用氧化剂将其氧化为fe
3+
,通过加入碱调节溶液ph为5~6,可以将杂质fe
3+
和al
3+
沉淀完全。沉淀铁、铝离子后,加入sdd螯合剂,通过螯合作用沉淀铅、铜、镍等重金属离子;本除杂工序中,低价铁离子在氧化剂作用下生成高价(+3价)铁离子,铝离子、高价铁离子与碱反应生成氢氧化物沉淀,铅、铜、镍等重金属离子与sdd螯
合剂发生螯合作用生成螯合沉淀;除杂后固液分离,得净化液,经除杂工序后,净化液中富含锰离子以及镁离子,锰离子含量为20~50g/l,镁离子含量为1~10g/l,铁、铝、镍、铜、铅等杂质离子浓度低于1mg/l;
29.采用有机相协同萃取净化液中的锰,得到负载有机相和萃余液,负载有机相中富含锰以及杂质镁,使用净化液对负载有机相进行洗涤,脱除附在有机相中的杂质镁,得到富含锰负载有机相以及净化液,用于洗涤后的净化液可直接返回净化液中进行循环;
30.反萃工序使用碱性溶液作为水相对富含锰负载有机相进行反萃,将锰离子与有机相分离,生成含四氧化三锰沉淀的水相和再生有机相,含四氧化三锰沉淀的水相经固液分离得到高纯四氧化三锰和滤液,滤液返回至s1步骤中重复使用,而再生有机相可循环用于萃取工序;针对负载锰有机相使用碱性溶液直接进行反萃,主要在于使用碱中oh-替换与锰络合的酸性萃取剂生成氢氧化锰沉淀,氢氧化锰被空气氧化生成四氧化三锰,同时酸性萃取剂与碱液中的阳离子络合实现再生,达到使萃取剂皂化的目的,实现有机相循环使用;
31.萃余液中添加氨水溶液进行沉淀,经固液分离后得到氢氧化镁和硫酸铵溶液,氢氧化镁经洗涤后煅烧得到高纯氧化镁产品;溶液中的镁离子与碱性溶液中的oh-反应氢氧化镁沉淀,硫酸铵存在于溶液中,通过固液分离实现氢氧化镁沉淀和硫酸铵溶液的分离,然后使用纯水对氢氧化镁沉淀进行洗涤,在高温条件下氢氧化镁分解为氧化镁和水,向硫酸铵溶液中添加硫酸调节至中性,通过蒸发结晶得到硫酸铵产品和母液。
32.步骤s1中,若所述锰矿石为氧化锰矿,需进行湿法还原浸出工艺,所用还原剂为二氧化硫、硫化铁矿、硫化亚铁、铁、草酸、过氧化氢、酚类及芳胺类、甲醇,以及葡萄糖等糖类有机物中的至少一种;若所述锰矿石为其他锰矿石如碳酸锰矿等,可直接通过酸性溶液浸出。
33.步骤s2中,氧化剂为二氧化锰、双氧水、氯酸钠、空气、氧气、二氧化硫中的至少一种,为了避免浸出液中加入过多杂质,优选选用二氧化锰和/或双氧水,二氧化锰反应后生成锰离子可直接用于生产电解锰,双氧水反应后生成水,可用于循环进出,没有其他杂质生成;所述氧化剂的加入量为其反应过程理论摩尔量的1.0~1.2倍;所述碱为碳酸锰矿石、碳酸锰、碳酸镁、氧化钙、一氧化锰、氧化镁、氢氧化钠、氢氧化钾中的至少一种,反应后所得净化液ph为1~7。
34.步骤s5中的反萃溶液中氢氧化锰沉淀氧化不完全时通入空气进行氧化,固液分离后,沉淀经洗涤、干燥后得到高纯四氧化三锰,滤液返回至步骤s1中进行循环使用。
35.步骤s6中添加的氨水浓度为10%~25%,添加氨水调节萃余液ph值为10左右,搅拌均匀静置沉淀后通过固液分离得到氢氧化镁沉淀和硫酸铵溶液,使用纯水对氢氧化镁沉淀进行洗涤,烘干后进行煅烧得到高纯氧化镁产品,所述煅烧温度为500~1000℃。
36.步骤s7中添加硫酸调节至ph为7左右,使用蒸发系统进行蒸发,得到硫酸铵结晶和母液,硫酸铵结晶经150℃烘干3h后得到硫酸铵产品,母液返回蒸发系统循环使用。
37.本技术通过萃取完成锰镁的高效分离,实现锰矿中两种金属资源的高效回收利用。另外,通过碱液反萃负载有机相直接制备四氧化三锰,工艺简单,节能环保,萃余液用于制备高纯氧化镁和硫酸铵产品,高附加值利用,且环境友好。
38.本发明的上述方案有如下的有益效果:
39.(1)本发明的高纯四氧化三锰和氧化镁的制备方法引入萃取和反萃环节,通过浸
出、除杂、萃取、碱液反萃、萃余液回收镁氨的整体生产工艺实现以锰矿石为原料直接制备高纯四氧化三锰,同时联产高纯氧化镁、硫酸铵产品。该工艺能够同时实现对两种金属资源的高附加值回收,达到比常规锰矿石处理工艺更高效、清洁利用的效果,联产硫酸铵产品实现氨氮废水的回收利用,保证了较高的资源利用率和产品纯度,实现了节能环保和清洁生产。
40.(2)本发明使用碱液反萃直接制备高纯四氧化三锰,通过碱性溶液对负载锰有机相直接进行反萃,使用碱中oh-替换与锰络合的酸性萃取剂生成氢氧化锰沉淀,氢氧化锰被空气氧化生成四氧化三锰,同时酸性萃取剂与碱液中的阳离子络合实现再生,达到使萃取剂皂化的目的,实现有机相循环使用。本发明避免了传统反萃工艺中加酸反萃、加碱中和沉淀、空气高温氧化等繁琐制备操作,减少了操作步骤,节约了试剂消耗和能耗,具有工艺简单、成本低、节能环保的优点。
41.(3)本发明所使用的α-羟基-2-乙基己基次膦酸、α-羟基-2-乙基-2-己烯次膦酸萃取剂,其分子结构中有次膦酸基、羟基两种功能基,还含有支链结构,分子内部的空间位阻效应、分子之间的缔合等因素,使其比传统萃取剂具有更好的结合能力、更高的选择性和稳定性。同时,通过有机膦酸类萃取剂和癸酸萃取剂的协同萃取,可提高萃取剂的萃取动力学性能,萃取过程分相更快,耗时更短,更节能、更高效。
42.(4)本发明所提供的高纯四氧化三锰和氧化镁的制备方法以原生锰矿为原料,相比于传统方法以金属锰、二氧化锰、硫酸锰和碳酸锰等锰系产品为原料,能够大幅降低成本和能耗,提高经济效益,同时能够实现对我国低品位锰矿的的高效利用,同时具有经济和环保效益。
附图说明
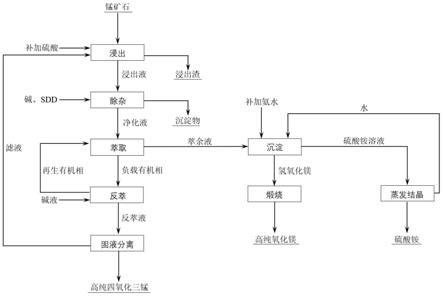
43.图1是本发明实施例制备的高纯四氧化三锰和氧化镁的流程图;
44.图2是本发明实施例1制备的高纯四氧化三锰的xrd分析结果;
45.图3是本发明实施例1制备的高纯四氧化三锰的粒度分析结果;
46.图4是本发明实施例1制备的高纯氧化镁的xrd分析结果。
具体实施方式
47.为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合附图及具体实施例进行详细描述。
48.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
49.本发明下述实施例中所使用的锰矿石为碳酸锰矿石,来自贵州,锰品位为11.65%,镁的品位为3.04%;下述实施例所使用的药剂,如无特别说明,均为市购。
50.本发明针对现有的问题,提供了一种制备高纯四氧化三锰和高纯氧化镁的方法。
51.如图1所示,本发明的实施例提供了一种制备高纯四氧化三锰和高纯氧化镁的方法的工艺流程图。
52.实施例1
53.一种电解锰的生产方法
54.包括浸出、除杂、萃取、反萃及氨氮和镁回收的工序,具体如下:
55.s1、浸出:将18.23g浓硫酸用水稀释至95ml,然后加入30g破碎后的锰矿石粉末,在90℃下搅拌浸出3h,过滤得到浸出液和浸出渣,其中,浸出终点ph为1.53,锰的浸出率为96.34%,浸出液中,各元素浓度为:mn 35.44g/l、mg 9.14g/l、fe 2.96g/l、na 0.38g/l、ca 0.33g/l、al 0.11g/l;
56.s2、除杂:向步骤s1所得浸出液中加入二氧化锰氧化低价铁,二氧化锰加入的物质的量与浸出液中低价铁的物质的量之比为0.5:1,接着加入氢氧化钠调节ph值至5.47,沉淀fe和al离子,然后加入sdd进行反应生成螯合沉淀,sdd添加量为0.53kg/吨原矿,过滤得到杂质金属沉淀物和净化液,其中,净化液中各金属离子浓度分别为:mn 35.33g/l,mg 9.11g/l,fe<1mg/l、al<1mg/l,ni<1mg/l,cu<1mg/l;
57.s3、将步骤s2所得净化液与皂化率30%的有机相进行二级逆流萃取得到负载有机相和萃余液,经检测有机相锰浓度为9.65g/l,镁浓度为0.79g/l,负载有机相采用硫酸锰溶液在ph 5.0~5.5下进行洗涤,脱除负载有机相中的杂质镁,得到富含锰负载有机相和洗涤液,洗涤液返回净化液中进行循环。经检测,有机相中锰浓度为10.44g/l,镁浓度为0.0025g/l。其中,有机相由萃取剂和稀释剂组成,萃取剂为α-羟基-2-乙基己基次膦酸,浓度为300g/l,稀释剂为260号溶剂油;有机相中的萃取剂先经30%氨水溶液皂化处理,皂化率30%;逆流萃取过程中控制o:a=1.7:1;
58.s4、使用0.76mol/l氨水溶液对步骤s3中富含锰负载有机相进行反萃,o:a=2:1,得到反萃溶液和再生有机相,分离反萃溶液和再生有机相。
59.s5、反萃溶液通过固液分离得到沉淀和水相,使用纯水洗涤沉淀3次,然后在80℃下烘干4h,得到纯度为70.69%的高纯四氧化三锰产品。所制备的高纯四氧化三锰的xrd分析结果如图2所示,粒度分析结果如图3所示。
60.s6、向萃余液(mg 6.24g/l、mn 0.34g/l)中添加少量氨水,调节溶液ph至7.8,搅拌10min,静置1h沉淀溶液中的杂质锰。通过固液分离杂质锰得到含硫酸铵和硫酸镁溶液(其中mn 0.003g/l),向其中继续添加氨水至ph为10,搅拌时间为20min,溶液中的镁以氢氧化镁的形式沉淀,搅拌结束后静置1.5h,分离得到氢氧化镁沉淀和硫酸铵溶液。使用纯水洗涤氢氧化镁沉淀3次,在80℃下烘干4h,然后在900℃煅烧2h得到纯度为99.51%的高纯氧化镁产品。所制备的高纯氧化镁的xrd分析结果如图4所示。
61.s7、向硫酸铵溶液中添加硫酸溶液调节溶液ph为7。使用蒸发结晶器对溶液进行蒸发,离心分离出结晶,分离后的母液返回系统继续蒸发浓缩结晶。在120℃对结晶烘干4h得到硫酸铵产品。
62.实施例2
63.一种电解锰的生产方法
64.包括浸出、除杂、萃取、反萃及氨氮和镁回收的工序,具体如下:
65.s1、浸出:将18.19g浓硫酸用水稀释至130ml,然后加入30g破碎后的锰矿石粉末,在50℃下搅拌浸出5h,过滤得到浸出液和浸出渣,其中,浸出终点ph为1.53,锰的浸出率为97.41%,浸出液中,各元素浓度为:mn 26.19g/l、mg 6.83g/l、fe 2.19g/l、na 0.28g/l、ca 0.24g/l、al 0.08g/l;
66.s2、除杂:向步骤s1所得浸出液中加入双氧水氧化低价铁,双氧水加入的物质的量与浸出液中低价铁的物质的量之比为0.5:1,接着加入氢氧化钠调节ph值至5.26,沉淀fe和al离子,然后加入sdd进行反应生成螯合沉淀,sdd添加量为0.53kg/吨原矿,过滤得到杂质金属沉淀物和净化液,其中,净化液中各金属离子浓度分别为:mn 26.15g/l,mg 6.76g/l,fe<1mg/l、al<1mg/l,ni<1mg/l,cu<1mg/l;
67.s3、将步骤s2所得净化液与皂化率30%的有机相进行二级逆流萃取得到负载有机相和萃余液,经检测有机相锰浓度为9.74g/l,镁浓度为0.81g/l,负载有机相采用硫酸锰溶液在ph 5.0~5.5下进行洗涤,脱除负载有机相中的杂质镁,得到富含锰负载有机相和洗涤液,洗涤液返回净化液中进行循环。经检测,有机相中锰浓度为10.55g/l,镁浓度为0.0026g/l。其中,有机相由萃取剂和稀释剂组成,萃取剂为α-羟基-2-乙基-2-己烯次膦酸,浓度为300g/l,稀释剂为磺化煤油;有机相中的萃取剂先经30%氨水皂化处理,皂化率30%;逆流萃取过程中控制o:a=1.3:1;
68.s4、使用1.15mol/l氨水溶液对步骤s3中富含锰负载有机相进行反萃,o:a=3:1,得到反萃溶液和再生有机相,分离反萃溶液和再生有机相。
69.s5、反萃溶液通过固液分离得到沉淀和水相,使用纯水洗涤沉淀4次,然后在120℃下烘干2h,得到纯度为71.34%的高纯四氧化三锰产品。
70.s6、向萃余液(mg 4.50g/l、mn 0.25g/l)中添加少量氨水,调节溶液ph至7.7,搅拌15min,静置1.5h沉淀溶液中的杂质锰。通过固液分离杂质锰得到含硫酸铵和硫酸镁溶液(其中mn 0.0028g/l),向其中继续添加氨水至ph为9.5,搅拌时间为25min,溶液中的镁以氢氧化镁的形式沉淀,搅拌结束后静置2h,分离得到氢氧化镁沉淀和硫酸铵溶液。使用纯水洗涤氢氧化镁沉淀4次,在120℃下烘干2h,然后在500℃煅烧3h得到纯度为99.85%的高纯氧化镁产品。
71.s7、向硫酸铵溶液中添加硫酸溶液调节溶液ph为6.5。使用蒸发结晶器对溶液进行蒸发,离心分离出结晶,分离后的母液返回系统继续蒸发浓缩结晶。在150℃对结晶烘干3h得到硫酸铵产品。
72.实例3
73.本实施例的电解锰的生产方法与实施例1的相同,区别在于,步骤s3中,采用新癸酸作为萃取剂,航空煤油为稀释剂,浓度为400g/l,使用质量分数为30%的氢氧化钠溶液进行皂化至皂化率为20%,调节净化液ph为4,逆流萃取过程中控制o:a=1:1,将步骤s2所得净化液与皂化率20%的有机相进行二级逆流萃取得到负载有机相和萃余液,经检测有机相中锰浓度为8.79g/l,镁浓度为0.73g/l,负载有机相采用硫酸锰溶液在ph 5.0~5.5下进行洗涤,脱除负载有机相中的杂质镁,得到富含锰负载有机相和洗涤液,洗涤液返回净化液中进行循环。经检测,有机相中锰浓度为9.52g/l,镁浓度为0.0023g/l。
74.实例4
75.本实施例的电解锰的生产方法与实施例1的相同,区别在于,步骤s3中,采用新癸酸和α-羟基-2-乙基-2-己烯次膦酸作为协同萃取剂,escaid110为稀释剂,萃取剂浓度为300g/l,其中新癸酸浓度为150g/l,α-羟基-2-乙基-2-己烯次膦酸浓度为150g/l,使用质量分数为30%的氢氧化钠溶液进行皂化,皂化率为30%,调节净化液ph为5,逆流萃取过程中控制o:a=1.7:1,将步骤s2所得净化液与皂化率30%的有机相进行二级逆流萃取得到负载
有机相和萃余液,经检测有机相锰浓度为9.76g/l,镁浓度为0.81g/l,负载有机相采用硫酸锰溶液在ph 5.0~5.5下进行洗涤,脱除负载有机相中的杂质镁,得到富含锰负载有机相和洗涤液,洗涤液返回净化液中进行循环。经检测,有机相中锰浓度为10.58g/l,镁浓度为0.0026g/l。实验过程中还发现,相比单一萃取剂,协同萃取剂中新癸酸的加入使其在萃取动力学上表现更好,萃取速度更快,分相快,而α-羟基-2-乙基-2-己烯次膦酸中次膦酸基、羟基两种功能基的存在使其具有较好的结合能力和稳定性。
76.以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1