一种金纳米花及其制备方法和应用
1.本发明属于生物医学工程材料技术领域,具体涉及一种金纳米花及其制备方法和应用,该金纳米花兼具催化和光动力/光热协同抗菌特性。
背景技术:
2.细菌感染已成为一个世界范围内危及人们生命的重大公共卫生问题。细菌感染性疾病的普遍疗法是抗生素治疗,但是耐药细菌可以通过各种途径保护自身免受抗生素的杀灭,并且细菌耐药性的产生远远超过了新抗生素的发展速度。据估计,耐药细菌引起的疾病每年导致约70万人死亡,预计到2050年死亡人数将增加到1000万人。因此,迫切需要开发更有效的抗菌剂来对抗耐药细菌。此外,最近的研究证实,人体天然防御系统中的几个生物催化剂参与了细菌抑制和生物膜破坏。例如,生物体中的天然过氧化物酶(pod)和氧化物酶(oxd)可以催化一系列底物产生许多活性氧物种(ros),以对抗细菌入侵,由于其更显著的催化活性和对特定底物的较强选择性,酶被认为是抗生素的最佳替代品;然而,天然酶具有制造成本高、生产条件困难、催化稳定性有限等固有缺点,严重限制了其作为抗菌剂的潜力。近年来,人工纳米酶被广泛研究以解决这一问题,它在物理环境中显示出比天然酶更高的催化活性。纳米酶的活性、敏感性/特异性受到其纳米尺度特征的影响,如纳米尺寸、丰富的形态、较大的比表面积等。与较大的对应物相比,较小尺寸的纳米酶不仅可以更好地与相应的底物结合,而且很容易渗透到细菌细胞膜中。纳米酶的形状也可以极大地影响它们的催化活性和抗菌能力,比表面积大、具有尖刺形状的纳米酶与细菌的黏附能力更强,催化活性和杀菌能力更强。更重要的是,由于纳米酶可以通过诱导形状、大小和组成从而改变催化活性,使其比普通酶具有更强的功能性。这些独特的物理化学性质为开发多功能抗菌剂提供了可能性。
3.金纳米花作为一种优良的纳米酶,可以催化细菌感染微环境中存在的h2o2,生成许多活性氧物种(ros),如羟基自由基,从而达到抗菌效果。合成金纳米花的方法有很多,包括模板法、自下而上的化学还原、光还原、电还原、生物还原和自上而下的化学蚀刻等。其中,共聚模板法由于能够实现定义明确和尺寸可调的纳米结构以及相对简单的合成步骤而被广泛应用于金纳米花的合成。然而,采用该方法制备金纳米花需要通过添加还原剂和表面活性剂进行额外的还原反应,合成步骤繁琐,且会造成金纳米花表面残留对人体有毒性的表面活性剂,不利于进一步应用。
4.因此,有必要探究一种新的制备该纳米酶的方法,以克服目前存在的问题。
技术实现要素:
5.本发明的目的在于解决现有制备金纳米花过程中需额外添加还原剂以及表面活性剂,合成步骤繁琐,且残留表面活性剂的不足之处,而提供一种金纳米花及其制备方法和应用。
6.为实现上述目的,本发明所提供的技术解决方案是:
7.一种金纳米花的制备方法,其特殊之处在于,包括以下步骤:
8.1)将具有还原性的两亲性嵌段共聚物p(fam
m-b-amn)-g-sato模板溶解在n,n-二甲基甲酰胺dmf溶液中,得到还原性模板溶液;其中,m的取值为15~50,n的取值为80~115;
9.2)将步骤1)得到的还原性模板溶液滴加到haucl4溶液中进行反应;
10.3)待步骤2)反应完成后,将反应液离心,收集残渣并水洗,得到金纳米花。
11.进一步地,步骤1)中,具有还原性的两亲性嵌段共聚物p(fam
m-b-amn)-g-sato模板的制备方法如下:
12.s1)采用可逆加成-断裂链转移raft聚合方法将单体甲基丙烯酸2-((4-甲酰基苯氧甲酰基)氨基)乙酯(2-((4-formylphenoxycarbonyl)amino)ethylmethacrylate)fam和单体丙烯酰基吗啉(4-acryloylmorpholine)am合成含醛基两亲性嵌段共聚物p(fam
m-b-amn);其中,m的取值为15~50,n的取值为80~115;
13.s2)将步骤s1)得到的含醛基两亲性嵌段共聚物p(fam
m-b-amn)与苯甲酰硫代羟胺sbtha在四氢呋喃溶液中混合均匀,加入催化剂三氟乙酸进行反应,得到具有还原性的两亲性嵌段共聚物p(fam
m-b-amn)-g-sato,分子结构式为:
[0014][0015]
其中,m的取值为15~50,n的取值为80~115。
[0016]
进一步地,s1中,使用的引发剂为偶氮二异丁腈、偶氮二异丁酸二甲酯、过氧化苯甲酰或过氧化苯甲酸叔丁酯中的一种;链转移剂为4-氰基戊酸二硫代苯甲酸、二硫代苯甲酸氰基异丙酯或2-[十二烷硫基(硫代羰基)硫基]-2-甲基丙酸中的一种;
[0017]
s2中,p(fam
m-b-amn)和sbtha的摩尔比是1:120~240,p(fam
m-b-amn)的摩尔浓度为5~10mm(即溶解在四氢呋喃溶液后该物质的摩尔浓度),三氟乙酸的摩尔浓度为5~10μm。
[0018]
进一步地,步骤1)中,模板溶液中p(fam
m-b-amn)-g-sato的质量浓度为5~20mg/ml;
[0019]
步骤2)中,haucl4溶液的摩尔浓度为0.5~2.0mm;所述还原性模板溶液和haucl4溶液的体积比为0.25~1∶4;反应时间为2-3h;离心转速为11000rpm/min,离心次数至少3次,每次至少15min。
[0020]
进一步地,为了合成出的金纳米花尺寸稳定,分布均一,且具有明显的分支结构和
尖锐花瓣形状,有利于抗菌应用,步骤1)中,m取值为24,n取值为112;
[0021]
p(fam
24-b-am
112
)和sbtha的摩尔比是1∶240;
[0022]
p(fam
24-b-am
112
)的浓度为8mm;
[0023]
三氟乙酸的浓度为8μm;
[0024]
模板溶液中p(fam
24-b-am
112
)-g-sato的质量浓度为10mg/ml;
[0025]
步骤2)中,haucl4溶液的浓度为1.0mm;
[0026]
所述还原性模板溶液和haucl4溶液的体积比为1∶4;
[0027]
反应时间为2h。
[0028]
同时,本发明还提供采用上述方法制得的金纳米花,其分支结构丰富、具有尖锐花瓣形状,兼具催化和光动力/光热抗菌协同特性。
[0029]
其一是作为h2o2分解催化剂;
[0030]
其二是用于制备抑制细菌生长的药物。
[0031]
一种h2o2分解催化剂,其特殊之处在于:其成分为上述方法制备的金纳米花。
[0032]
一种抑制细菌生长的药物,其特殊之处在于:其有效成分为上述方法制备的金纳米花。
[0033]
本发明的构思与机理:
[0034]
本技术研究团队考虑到现有模板法制备金纳米花需通过添加还原剂和表面活性剂进行额外的还原反应,因此结合模板法本身所具有的优势,拟采用本质上可还原的聚合物模板进行制备,如此,不仅可以简化制备过程还能使金纳米花具有良好的生物相容性。本发明选择具有还原性的含s-芳酰硫肟(sato)基团的两亲性嵌段共聚物p(fam
m-b-amn)-g-sato作为模板,基于p(fam
m-b-amn)-g-sato模板上sato的还原性,将haucl4溶液还原为单质金。首先p(fam
m-b-amn)-g-sato模板自组装成核壳结构,金原子先在还原性核心部位沉积,之后金原子随着模板亲水链向外延伸,在外部形成尖刺形状,最终得到分支结构丰富,具有尖刺花瓣形状的金纳米花。同时通过共聚物模板的嵌段比例,模板和haucl4溶液的浓度比例来控制金纳米花的尺寸和形貌,使其可以在光热和持续催化条件下协同生成ros,以克服细菌感染挑战。
[0035]
本发明的优点:
[0036]
1.与现有的技术相比,本发明利用p(fam
m-b-amn)-g-sato模板还原性和两亲性,与haucl4溶液进行还原同时实现对金原子的有效负载,得到了分支结构丰富(比表面积大),具有尖刺花瓣形状金纳米花,克服了制备金纳米花过程中添加额外还原剂和表面活性剂的缺点;并且通过本发明共聚物模板法能够控制金纳米花的尺寸和形貌,在近红外光作用下可以催化细菌感染微环境中过氧化氢,持续生成许多活性氧物种ros,如羟基自由基等,并且发生光热转换,使其可以在光热和持续催化条件下协同生成ros。
[0037]
2.本发明所制备的金纳米花具有较好的生物相容性、较低的溶血率和细胞毒性,在近红外光照射下具有良好的协同光热/光动力效应和持久的催化效果,为制备可控的金纳米花提供了一种简单、经济、绿色的方法。金纳米花+h2o2处理的mrsa和esbl-e.coli两株耐药菌的抗菌率分别为98.5%和99.9%,显示出了其具有优异的抗菌效果是临床上需要安全高效的抵抗细菌感染材料。
[0038]
3.本发明制备方法简单,无需额外添加还原剂和表面活性剂,通过带有还原基团
的两亲性嵌段共聚物p(fam
m-b-amn)-g-sato模板与haucl4溶液一步还原即可得到分支结构丰富,具有尖刺花瓣形状的的金纳米花,并且通过两亲性嵌段共聚物p(fam
m-b-amn)-g-sato模板的嵌段比例,模板和haucl4溶液的浓度比例来控制所得到的金纳米花的尺寸和形貌,可控性较高。
附图说明
[0039]
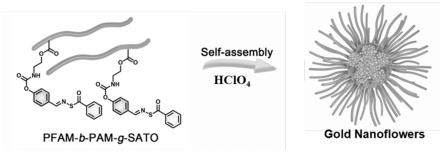
图1为本发明金纳米花的制备路线图。
[0040]
图2分别通过实施例1~3制备金纳米花的紫外-可见吸收光谱。
[0041]
图3为实施例1和实施例3制备金纳米花的tem形貌,其中,a为实施例1制备的金纳米花,b为实施例3制备的金纳米花。
[0042]
图4为通过实施例1制备金纳米花的tem形貌和eds能谱。
[0043]
图5为通过实施例1制备金纳米花的xps能谱和xps au 4f结合能谱。
[0044]
图6为通过实施例1制备金纳米花在不同质量浓度下的光热性能曲线。
[0045]
图7为通过实施例1制备金纳米花催化h2o2的定性分析、颜色辨别和紫外-可见吸收光谱。
[0046]
图8为通过实施例1制备金纳米花对h2o2和tmb的稳态动力学和催化能力分析。
[0047]
图9为通过实施例1制备金纳米花在不同质量浓度下对小鼠胚胎成纤维细胞nih3t3的细胞毒性分析。
[0048]
图10为通过实施例1制备金纳米花在不同质量浓度下的溶血率以及与金纳米花或triton x-100一起孵育的红细胞悬浮液的照片。
[0049]
图11为通过实施例1制备金纳米花在不同处理条件对两种耐药菌的抗菌率,其中,a为耐甲氧西林金黄色葡萄球菌mrsa和b为产超广谱β-内酰胺酶大肠杆菌-e.coli。
具体实施方式
[0050]
以下结合附图和具体实施例对本发明的内容作进一步的详细描述:
[0051]
以下公开了一种兼具催化和光动力/光热协同抗菌特性的金纳米花及其制备方法和应用,其中,制备路线如图1所示。
[0052]
实施例1
[0053]
一种兼具催化和光动力/光热协同抗菌特性的金纳米花的制备方法,包括如下步骤:
[0054]
1)制备p(fam
24-b-am
112
)-g-sato模板
[0055]
1.1)将单体甲基丙烯酸2-((4-甲酰基苯氧甲酰基)氨基)乙酯(fam)、链转移剂4氰基戊酸二硫代苯甲酸(cta)和引发剂偶氮二异丁氰(aibn)加入schlenk管中,并加入二氧六环溶解;其中,单体浓度为1m,[fam]/[cta]/[aibn]摩尔比为25/1/0.2;70℃加热24小时后,结束反应得到pfam
24-cta。
[0056]
1.2)将单体丙烯酰基吗啉am、pfam
24-cta和aibn在schlenk管中加入二氧六环溶解;其中,单体浓度为1m,[am]/[pfam
24-cta]/[aibn]摩尔比为125/1/0.2;70℃加热24小时后,结束反应得到p(fam
24-b-am
112
)-cta。
[0057]
1.3)在schlenk管中,加入0.032mmol p(fam
24-b-am
112)-cta和79mg aibn,溶于6ml
二氧六环中。在80℃下搅拌一夜,经乙醚沉淀、过滤、真空干燥制得p(fam
24-b-am
112
)。
[0058]
1.4)在10ml的烧瓶中加入200mg的p(fam
24-b-am
112
),288mg苯甲酰硫代羟胺sbtha,7.5μl三氟乙酸,溶于7.5ml的四氢呋喃中。反应混合物在25℃振荡12h,然后用乙醚沉淀,真空干燥,得到具有还原性的两亲性嵌段共聚物p(fam
24-b-am
112
)-g-sato。
[0059]
2)合成金纳米花
[0060]
2.1)在5ml试管中将10mg具有还原性的两亲性嵌段共聚物p(fam
24-b-am
112
)-g-sato模板和1ml dmf溶液溶解均匀,得到还原性模板溶。
[0061]
2.2)在10ml烧杯中配置4ml haucl4(1.0mm),将步骤2.1)得到的模板溶液滴加到烧杯中进行还原,反应2h;
[0062]
2.3)对步骤2.2)所得反应溶液以11000rpm/min离心3次,每次持续15分钟,下部残留物用超纯水洗涤以除去残留的dmf溶液,经冷冻干燥后可得到目标产物。
[0063]
实施例2
[0064]
一种兼具催化和光动力/光热协同抗菌特性的au纳米花的制备方法,包括如下步骤:
[0065]
1)制备p(fam
15-b-am
115
)-g-sato模板
[0066]
1.1)将单体甲基丙烯酸2-((4-甲酰基苯氧甲酰基)氨基)乙酯(fam)、链转移剂4氰基戊酸二硫代苯甲酸(cta)和引发剂偶氮二异丁氰(aibn)加入schlenk管中,并加入二氧六环溶解。其中,单体浓度为1m,[fam]/[cta]/[aibn]摩尔比为15/1/0.2;70℃加热24小时后,结束反应得到pfam
15-cta。
[0067]
1.2)将单体丙烯酰基吗啉am、pfam
15-cta和aibn在schlenk管中加入二氧六环溶解;其中,单体浓度为1m,[am]/[pfam
15-cta]/[aibn]摩尔比为125/1/0.2;70℃加热24小时后,结束反应得到p(fam
15-b-am
115
)-cta。
[0068]
1.3)在schlenk管中,加入0.032mmol p(fam
15-b-am
115)-cta和79mg aibn,溶于6ml二氧六环中。在80℃下搅拌一夜,经乙醚沉淀、过滤、真空干燥制得p(fam
15-b-am
115
)。
[0069]
1.4)在10ml的烧瓶中加入200mg的p(fam
15-b-am
115
),140mg苯甲酰硫代羟胺sbtha,7.5μl三氟乙酸,溶于7.5ml的四氢呋喃中。反应混合物在25℃振荡12h,然后用乙醚沉淀,真空干燥,得到具有还原性的两亲性嵌段共聚物p(fam
15-b-am
115
)-g-sato。
[0070]
2)合成金纳米花
[0071]
2.1)在5ml试管中将10mg具有还原性的两亲性嵌段共聚物p(fam
15-b-am
115
)-g-sato模板和1ml dmf溶液溶解均匀,得到还原性模板溶。
[0072]
2.2)在10ml烧杯中配置4ml haucl4(1.0mm),将步骤2.1)得到的模板溶液滴加到烧杯中进行还原,反应2h;
[0073]
2.3)对步骤2.2)所得反应溶液以11000rpm/min离心3次,每次持续15分钟,下部残留物用超纯水洗涤以除去残留的dmf溶液,经冷冻干燥后可得到目标产物。
[0074]
实施例3
[0075]
本实施例公开了一种兼具催化和光动力/光热协同抗菌特性的au纳米花及其制备方法和应用,包括如下步骤:
[0076]
1)制备p(fam
50-b-am
80
)-g-sato模板
[0077]
1.1)将单体甲基丙烯酸2-((4-甲酰基苯氧甲酰基)氨基)乙酯(fam)、4氰基戊酸二
硫代苯甲酸(cta)和偶氮二异丁氰(aibn)加入schlenk管中,并加入二氧六环溶解,其中,单体浓度为1m,[fam]/[cta]/[aibn]摩尔比为50/1/0.2。70℃加热24小时后,结束反应得到pfam
50-cta。
[0078]
1.2)将单体丙烯酰基吗啉am、pfam
50-cta和aibn在schlenk管中加入二氧六环溶解;其中,单体浓度为1m,[am]/[pfam
50-cta]/[aibn]摩尔比为85/1/0.2。70℃加热24小时后,结束反应得到p(fam
50-b-am
80
)-cta。
[0079]
1.3)在schlenk管中,加入0.032mmol p(fam
50-b-am
80)-cta和79mg aibn,溶于6ml二氧六环中。在80℃下搅拌一夜,经乙醚沉淀、过滤、真空干燥制得p(fam
50-b-am
80
)。
[0080]
1.4)在10ml的烧瓶中加入200mg的p(fam
50-b-am
80
),600mg苯甲酰硫代羟胺sbtha,7.5μl三氟乙酸,溶于7.5ml的四氢呋喃中。反应混合物在25℃振荡12h,然后用乙醚沉淀,真空干燥,得到具有还原性的两亲性嵌段共聚物p(fam
50-b-am
80
)-g-sato。
[0081]
2)合成金纳米花
[0082]
2.1)在5ml试管中将10mg具有还原性的两亲性嵌段共聚物p(fam
50-b-am
80
)-g-sato模板和1ml dmf溶液溶解均匀,得到还原性模板溶。
[0083]
2.2)在10ml烧杯中配置4ml haucl4(1.0mm),将步骤2.1)得到的模板溶液滴加到烧杯中进行还原,反应2h;
[0084]
2.3)对步骤2.2)所得反应溶液以11000rpm/min离心3次,每次持续15分钟,下部残留物用超纯水洗涤以除去残留的dmf溶液,经冷冻干燥后可得到目标产物。
[0085]
为了确定较为优异的工艺条件,本发明对实施例1-3制备的产物进行了比较,结果如下:
[0086]
图2为通过实施例1-3制备金纳米花的紫外-可见吸收光谱。光谱中峰的大小反映了金纳米花的大小,而峰跨越的波长范围则反映了金纳米团簇大小的均匀性,即跨度越大,金纳米花的大小越不均匀。从图中可以看出,以p(fam
15-b-am
115
)-g-sato和p(fam
50-b-am
80
)-g-sato为聚合物模板制备金纳米花在500~650之间的吸收分布较宽,且以p(fam
15-b-am
115
)-g-sato为聚合物模板制备金纳米花在650~700nm仍有较强的吸收峰;而以p(fam
24-b-am
112
)-g-sato为聚合物模板,制备的au纳米花在500~600吸收范围内吸光度分布较窄,跨度小,证实其尺寸分布相较于前两种更为均匀。
[0087]
图3的a和b分别为通过实施例1和实施例3得到的金纳米花的tem形貌,很明显,在实施例3中以p(fam
50-b-am
80
)-g-sato为共聚物模板合成出的金纳米花表面花瓣形状并不是特别明显,而在实施例1中以p(fam
24-b-am
112
)-g-sato为共聚物模板合成出的金纳米花,具有更丰富的分支结构和更清晰的花瓣边界,具有更大的比表面积,由此推断实施例1在催化和光动力/光热协同抗菌方面表现更为优异,为了验证上述推断,接下来对实施例1制备的金纳米花进行了进一步的确认与测试。
[0088]
图4为通过实施例1得到的金纳米花的(图4的a,b)tem形貌和(图4的c)eds能谱。从tem形貌分析可以看出金纳米花的花瓣形状清晰可见,分支结构丰富,尺寸为30nm左右。从eds能谱分析可以看出,金元素均匀分布在纳米花的内部,聚合物模板对haucl4的还原反应成功。
[0089]
图5为通过实施例1得到的金纳米花的xps能谱和xps au4f结合能谱。au4f的峰分别为87.71和84.01ev,表明haucl4中的au
3+
已成功还原为金单质,金纳米花已成功合成。同
时,90.03和85.83ev的au
1+
4f峰表明haucl4中的au
3+
已被还原为au
1+
的中间价态,也表明聚合物中的还原基团sato确实能够将haucl4中的au
3+
还原为au单质。此外,中间价态的存在解释了金纳米花的催化特性。
[0090]
图6为通过实施例1得到的金纳米花配置不同质量浓度后测得的光热性能曲线。在808nm的近红外光照射下,5min后金纳米花在上升到其最高温度,在浓度为100μg/ml时最高可达54℃;浓度为200μg/ml时,最高温度达到66℃,在浓度为100μg/ml以上条件均能满足光热杀菌的条件。
[0091]
图7为通过实施例1得到的金纳米花催化h2o2的定性分析、颜色辨别和紫外-可见吸收光谱。当金纳米花催化h2o2产生羟基自由基时,羟基自由基将tmb氧化成ox-tmb,氧化后的tmb呈蓝绿色。从紫外-可见吸收光谱中可以看出在652nm处也有特征吸收峰,证实了金纳米花对催化h2o2的催化作用。金纳米花催化h2o2产生的羟基自由基,对细菌的细胞膜和dna分子造成损伤,从而诱导细菌死亡。
[0092]
图8为通过实施例1得到的金纳米花对h2o2和tmb的稳态动力学和催化能力分析。用米氏方程评估催化过程的动力学,用双倒数法作图计算米氏常数km。用652nm处的吸光度和tmb氧化产物的摩尔吸收系数(39000/(cm
·
mol)/l))计算v0。通过单独调整tmb(图8的a,b)和h2o2(图8的c和d)的浓度,使用上述参数确定催化过程的米氏方程曲线。km越低,催化剂与底物的吸引力越大,v
max
越高,催化活性越好。
[0093]
图9为通过实施例1得到金纳米花在不同质量浓度下对nih3t3细胞的细胞毒性分析。结果表明,当金纳米团花的质量浓度为100μg/ml时,nih3t3细胞的存活率仍保持在90%以上,具有较好的生物相容性。但在808nm近红外光照射后,细胞存活率降低至60%,证实了其良好的光热/光动力协同作用效果。
[0094]
图10为通过实施例1得到金纳米花在不同质量浓度下的溶血率以及与金纳米花或triton x-100一起孵育的红细胞悬浮液的照片。以triton x-100处理的红细胞悬液作为对照,实验结果表明,金纳米团花的溶血率极低,在质量浓度高达250μg/ml时溶血率最高为2.1%,小于医用材料规定的5%,这表明金纳米团花具有优异的血液相容性。
[0095]
图11为通过实施例1得到的不同处理条件对耐甲氧西林金黄色葡萄球菌mrsa和产超广谱β-内酰胺酶大肠杆菌-e.coli的抗菌率。从图中可以看出,在施加808nm近红外光条件下,金纳米花处理的mrsa和esbl-e.coli两株耐药菌的抗菌率达到72%和96%,金纳米花+h2o2处理的mrsa和esbl-e.coli两株耐药菌的抗菌率分别为98.5%和99.9%。而用pbs、h2o2、辣根过氧化物酶(hrp)+h2o2三组对照对两株耐药菌的抗菌效果显著低于金纳米花和金纳米花+h2o2处理的耐药菌。证实了金纳米花可以在近红外光照射下,发挥催化和光热/光动力协同抗菌效果。
[0096]
通过上述测试,可以确定,本发明方法制备的金纳米花可以作为h2o2分解催化剂以及用于制备抑制细菌生长的药物。
[0097]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明公开的技术范围内,可轻易想到各种等效的修改或替换,这些修改或替换都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1