一种Co3O4纳米点水相法合成方法与流程
本发明涉及Co3O4纳米材料合成技术,具体涉及一种Co3O4纳米点水相法合成方法。
背景技术:
Co3O4纳米材料由于其出色的物理化学性能, 被广泛应用于锂离子电池、超级电容器、费托合成、电催化和光催化等领域。
随着研究的深入,学者们发现Co3O4纳米材料随着其颗粒尺寸的减小,其比表面增大,表面吸附性能和表面反应性能都显著增强。正是基于此,学者们不断探索如何制备出具有小颗粒尺寸的Co3O4纳米点材料。截止到目前,已开发出的制备Co3O4纳米点材料的方法有很多,将其总结归纳可大体分为水热-溶剂热法,溶胶-凝胶法,LSS法,胶束-反胶束法(包括微乳法),喷雾热解法,化学沉淀法等。虽然这些方法都基本能够实现Co3O4纳米点的制备,但是它们普遍存在几大问题:
1)生产成本较高;2)操作过程复杂;3)生产效率较低;4)产品粒径;5)部分方法大量使用有机物,其生产废物会对环境造成严重污染。
正是由于这几大问题使得目前已有的制备Co3O4纳米点的方法大部分都无法实现工业化生产。
技术实现要素:
为了克服上述现有技术的不足,本发明的目的是提供一种Co3O4纳米点水相法合成方法,实现Co3O4纳米点低成本,高效率,简单易行,且无毒无污染的制备。
为了实现上述目的,本发明采用的技术方案是:
一种Co3O4纳米点水相法合成方法,包括以下步骤:
1)配置A,B,C三种溶液:
A溶液:钴盐、醇及水的混合溶液,钴盐浓度为0.01~4 mol/L,醇与水的比例为1:1~1:100;
B溶液:碱性缓冲试剂、醇及水溶液,碱性缓冲试剂浓度为0.01-4 mol/L,醇与水的比例为1:1~1:100;
C溶液:双氧水、缓冲试剂、醇及水溶液,双氧水占总溶液体积的0.1~20%,缓冲试剂浓度根据需将C溶液pH维持在8-14之间进行配比,醇与水的比例为1:1~1:100;
2)反应过程:
首先向反应器中加入C溶液,控制反应温度维持在4-40oC之间,调节搅拌速度使得搅拌充分但不飞溅液体,将A溶液、B溶液同时缓慢滴加到C溶液中,最终A溶液滴加体积与C溶液体积比为1:2-1:100,控制B溶液滴加速度使反应过程总溶液pH始终保持不变,A,B溶液滴加时间终点保持一致;
3)产品分离
待反应结束后静置反应液半小时,产物团聚沉淀于反应器底部,分离出产品产物并洗涤去除产品纳米材料表面吸附物,离心脱水后得到泥状物,将泥状物冻结成块后冷冻干燥去除水分即可得到钴氢氧化物纳米点颗粒,将钴氢氧化物纳米点颗粒在300-500oC温度下煅烧,或在150-250oC温度下水热即可得到Co3O4纳米点材料。
所述的钴盐可以是硫酸钴,氯化钴,硝酸钴,乙酸钴中的一种或几种的任意比例混合物。
所述的A溶液、B溶液及C溶液中的醇可以是甲醇、乙醇、丙醇、丁醇、戊醇、己醇中的一种或几种的任意比例混合物。
所述的碱性缓冲试剂可以是邻苯二甲酸钠,磷酸氢二钠,磷酸二氢钠,磷酸钠,氢氧化钠,四硼酸钠中的一种或几种的任意比例混合物。
所述的缓冲试剂可以是邻苯二甲酸钠,磷酸氢二钠,磷酸二氢钠,磷酸钠,氢氧化钠,四硼酸钠一种或几种的任意比例混合物。
本发明的有益效果是:
利用本发明可以制备出粒径分布均一、颗粒尺寸较小、晶相单一、结晶度好且无杂质的Co3O4纳米点。与已有方法相比,本发明生产成本低,制备效率高,方法简单易操作,反应过程无有毒原料使用,整体能耗较低,且反应后废物、废水通过处理可重复利用对环境无污染,可以实现大规模工业化应用。
附图说明
图1为本发明实施例中产品1和产品2的XRD图谱。
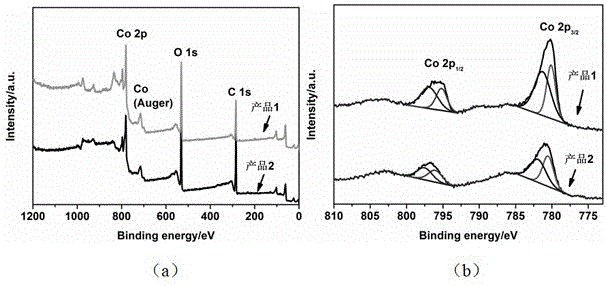
图2 为本发明实施例中产品1和产品2的XPS图谱,,其中a为宽谱,b为Co 2p窄谱。
图3为本发明实施例中产品1的TEM图谱,其中a低倍TEM图片,b为HRTEM图片,c为HRTEM图片放大图,d为粒径分布。
图4为本发明实施例中产品2的TEM图谱,其中a低倍TEM图片,b为HRTEM图片,c为HRTEM图片放大图,d为粒径分布。
图5为本发明实施例中产品1和产品2的UV-Vis图谱。
图6为本发明实施例中产品1的可见光催化分解纯水产氢产氧性能图。
具体实施方式
以下结合实施例对本发明进一步叙述,但本发明不局限于以下实施例。
实施例1
A溶液选用硫酸钴、乙醇、水混合溶液,硫酸钴浓度为1 mol/L,乙醇与水的比例为1:4。B溶液选用氢氧化钠、乙醇、水溶液,氢氧化钠浓度为4 mol/L,乙醇与水的比例与A溶液相同。C溶液选用双氧水、四硼酸钠、氢氧化钠、乙醇、水溶液,双氧水占总溶液体积分数为1%,四硼酸钠浓度为1 mol/L,调整氢氧化钠浓度使得pH为10,乙醇与水的比例与A溶液相同。
取1 L C溶液加入到带有恒温装置的反应器中,严格控制反应温度维持在5oC,调节搅拌速度为800 r/min。将A,B溶液同时缓慢滴加到C溶液中,A溶液滴加速度为15 mL/h,滴加体积为60 mL,控制B溶液滴加速度使反应过程总溶液pH始终保持在10不变,A,B溶液滴加终点保持一致。
待反应结束后静置反应液半小时,产品会团聚沉淀于反应器底部,分离出产品并洗涤去除产品纳米材料表面吸附物,离心脱水后得到泥状物,将泥状物冻结成块后冷冻干燥除水,然后在200oC下水热4 h即可得到产品1。
产品1的XRD图谱如图1所示,可以看出,产品1的XRD图谱在2θ值为31.2o,36.9 o,38.4 o,44.8 o,55.6 o,59.1o和65.1o时都存在衍射峰,这些峰位置与PDF卡片(JCPDS No. 00-001-1152)中对应的衍射峰位置完全吻合,分别对应于晶面(220),(311),(222),(400),(422),(511),(440),这说明产品1为立方相Co3O4。图2(a)和图2(b)展示了产品1的XPS图谱,从宽谱中可以看出产品1只存在Co,O,C三种元素。窄谱显示产品1在结合能为780.3, 782.1, 795.3, 797.8 eV处分别存在特征峰,查表可知这些峰分别对应于CoIII(2p3/2), CoII(2p3/2), CoIII(2p1/2)和 CoII(2p1/2)。在Co 2p1/2和Co 2p3/2特征峰后面都对应有CoII(2p3/2) shake-up卫星峰, 和CoII(2p1/2) shake-up卫星峰。通过计算我们可以看出产品1的CoII和CoIII的峰面积比例约为1: 2,这说明产品1为纯净的Co3O4。
产品1的透射电子显微镜(TEM)图像如图3所示,由图3(a)可以看出产品1是由无数个尺寸均一粒径很小的颗粒组成。图3(b)展示了产品1的高分辨电子投射显微镜(HRTEM)图像,由图中可以清晰看到产品1中每个小颗粒的晶格条纹,这说明产品1中的每个小颗粒都是一个单晶。进一步将HRTEM图像放大得到图3(c),从图中可以准确测量产品1颗粒的晶格间距约为2.0 Ȧ,与PDF卡片(JCPDS No. 00-001-1152)中的(400)晶面对应,这也再次证实了产品1为立方相Co3O4。对图3(b)中每个大小的颗粒数进行统计得到图3(d),由图中可以看出采用本发明合成的Co3O4产品颗粒大小都在2-5 nm之间,且以2-3 nm的颗粒最多,颗粒分布范围很窄。
实施例2
制备过程与制备条件均与实施例1相同,仅在C溶液中不加入双氧水制备,可以制出产品2。
产品2的XRD图谱如图1所示,可以看出,产品2的XRD图谱与产品1相似,在2θ值为31.2o,36.9 o,38.4 o,44.8 o,55.6 o,59.1o和65.1o时存在衍射峰,与PDF卡片(JCPDS No. 00-001-1152)中晶面(220),(311),(222),(400),(422),(511),(440)峰相对应,这说明产品2也为立方相Co3O4。图2(a)和图2(b)展示了产品2的XPS图谱,从宽谱中可以看出产品2也只存在Co,O,C三种元素。窄谱显示产品2也在结合能为780.3, 782.1, 795.3, 797.8 eV处分别存在分别对应于CoIII(2p3/2), CoII(2p3/2), CoIII(2p1/2)和 CoII(2p1/2)的特征峰。在Co 2p1/2和Co 2p3/2特征峰后面都对应有CoII(2p3/2) shake-up卫星峰, 和CoII(2p1/2) shake-up卫星峰。通过计算我们可以看出产品2的CoII和CoIII的峰面积比例也接近为1: 2,这说明产品2也为纯净的Co3O4。
产品2的透射电子显微镜(TEM)图像如图6所示,由图4(a)、4(b)和4(c)可以看出产品2是由较大的纳米颗粒组成,颗粒的晶面间距约为2.44 Ȧ,与PDF卡片(JCPDS No. 00-001-1152)中的(311)晶面对应这也再次证实了产品2为立方相Co3O4。同样,由图4(d)可以看出产品2颗粒大小在10-50 nm之间,且以20-30 nm的颗粒最多,颗粒分布范围很宽。
实施例3
采用BET方法来测量产品1和产品2的比表面积,我们可以得到产品1和产品2的比表面积分别为259.86 m2·g-1和7.84 m2·g-1。将产品1和产品2分别分散于水中,如图5所示,产品1可以很好地分散形成胶体,一周内不会沉淀,而产品2分散后形成悬浮液,几分钟内就沉淀分层。UV-Vis图谱来分析产品1和产品2的光学吸收特性,从图5可知,产品1和产品2均有两个吸收边,产品2的吸收边约在675 nm和950 nm,产品1的吸收边约在515 nm和815 nm处。与产品2相比,产品1的吸收边发生了明显的蓝移。
实施例4
采用100 mL 纯水作为反应溶液,对产品1和产品2可见光催化分解纯水性能进行测试。反应器选用侧面照射的130 mL Pyrex玻璃反应器,催化剂量为10 mg,照射光为180 mW cm-2带截止滤光片(λ>420 nm)的氙灯,在微分系统下测试,吹扫气为氩气,吹扫速度为1 mL min-1,反应温度保持在30oC,测试时间为500 min。通过测试我们发现产品2不具备可见光催化分解纯水产氢产氧的性能,而产品1具备可见光催化分解纯水产氢产氧的性能。图6展示了产品1的可见光催化分解纯水产氢产氧性能,从图中可以看出,在500 min反应中,产品1可见光下分解纯水产氢产氧的速率随时间变化波动幅度不是很大,速率基本保持稳定,利用线性拟合求得产品1分解水产氢气平均速率约为0.871 μmol h-1,氧气平均产生速率约为 0.466 μmol h-1,氢气氧气实际平均产出速率比率为1.87:1,接近于2:1,这说明产品1具有无负载可见光催化分解纯水同时产氢产氧的性能。
- 还没有人留言评论。精彩留言会获得点赞!