通过络合法制备高纯六氟磷酸锂的方法与流程
本发明涉及锂离子电池电解液的制备方法,具体涉及六氟磷酸锂的制备方法,更具体而言,本发明涉及通过络合法制备高纯六氟磷酸锂的方法。
背景技术:
六氟磷酸锂是商品化锂离子电池中使用最广泛的电解质锂盐,具有优良的电化学性能,离子导电性好,在有机溶剂中的溶解性好,具有极好的应用与环境性质。
目前,国内外六氟磷酸锂制备方法主要采用HF溶剂法,该工艺最大不足是残留在产品中的HF以配合物LIPF6·HF的形式存在于产品中,一般方法极难将产品中的HF含量降至10ppm以下,国内外大量生产的六氟磷酸锂中HF含量一般在55-68ppm,很难达到小于10ppm的水平。由于残留的HF会腐蚀电池材料,从而影响电池电性能,再者,该工艺对设备的防腐措施和材质要求以及生产的安全措施要求均比较高,还有该工艺为深冷工艺,能耗大,其投资额也很高。现有技术(田明明等,“吡啶络合法制备六氟磷酸锂”,《无机盐工业》,第46卷第6期,2014年6月)还提出了一种吡啶络合法制备六氟磷酸锂的方法,该方法采用两步反应法制备六氟磷酸锂,周期较长,经济性较差。因此需要一种简易、高效且经济的方法生产高纯度六氟磷酸锂。
技术实现要素:
本发明的目的是提供一种简单的六氟磷酸锂制备方法,既可以满足制备大型锂离子电池电解液的质量要求,同时由于能够规模化生产,大幅降低了生产成本,得到高纯度六氟磷酸锂,也为降低制备大型锂离子动力电池的成本提供了可能。
本发明提供一种制备六氟磷酸锂的方法,所述方法包括以下步骤:
1)采用吡啶或乙腈为络合剂,由六氟磷酸与氢氧化锂进行离子交换反应,得到稳定的六氟磷酸锂络合物,其分子式分别为LiC5H5NPF6和Li(CH3CN)4PF6;
2)将步骤1)中得到的六氟磷酸锂络合物过滤,并将过滤后的产物进行真空干燥得到固体产物;
3)将步骤2)中得到的固体产物溶于碳酸酯类溶剂中,过滤得到滤液;以及
4)将步骤3)中得到的滤液进行浓缩结晶、过滤、真空干燥,得到高纯六氟磷酸锂。
通过上述方法得到的高纯六氟磷酸锂中的金属杂质、水分、游离HF含量均小于10ppm。
在一个实施方式中,在步骤1)中,六氟磷酸锂以浓度为60重量%-70重量%,更优选为65重量%的六氟磷酸锂水溶液提供。
在一个实施方式中,在步骤1)中,六氟磷酸水溶液与氢氧化锂的重量比优选为2-10:1,更优选为6:1,六氟磷酸水溶液与吡啶或乙腈的重量比优选为2-10:1,更优选为2.5:1。
在一个实施方式中,在步骤1)中,反应温度优选为30-70℃,更优选40-60℃,甚至更优选为45℃;反应时间优选为2-8小时,更优选3-6小时,甚至更优选为4小时。
在一个实施方式中,在步骤2)中,固体络合物在20-60℃下真空干燥10-30小时,优选在20℃,压力1Pa的条件下干燥24小时,得到六氟磷酸锂固体。
在一个实施方式中,在步骤3)中,所述碳酸酯类溶剂可以为选自碳酸二甲酯(DMC)、碳酸二乙酯(DEC)、碳酸乙烯酯(EC)和碳酸丙烯酯(PC)中的一种或多种,所述碳酸酯类溶剂优选为EC:DMC=1:1(重量比)或EC:DEC=1:1(重量比)的混合溶液,并且六氟磷酸锂在所述碳酸酯类溶剂中的浓度优选为5重量%-20重量%,更优选为15重量%。
在一个实施方式中,在步骤3)中,可根据需求添加所需的溶剂和六氟磷酸锂,得到的滤液可为含不同浓度的六氟磷酸锂的六氟磷酸锂产品。
在一个实施方式中,在步骤4)中,所述真空干燥在10-60℃下进行10-30小时,优选地,在20℃,压力1Pa的条件下,干燥24小时。
本发明制备方法与现有技术相比,具有如下优势:
(1)本发明通过稳定的六氟磷酸锂络合物,避免了六氟磷酸锂生产过程中,因其化学性质不稳定性造成的分解,用比较简单的方法,生产出高纯度六氟磷酸锂产品。
(2)本方法不使用高腐蚀性的原料HF、PCl3,使其生产设备易于制造,投资较低,避免因设备管道腐蚀带来的各种杂质。
(3)可使有害杂质含量降到最低,其中HF<10ppm,水分<10ppm,金属离子<10ppm,为生产高品质电池打下良好基础。
(4)生产过程不采用深冷工艺,无压操作,提高了安全性。同时降低了能耗,为清洁化生产开辟了新途径。
(5)反应过程不产生副产品氟化氢和氯化氢,操作温度20-70℃,易于控制,为一种简单快速的高纯六氟磷酸锂生产方法。
附图说明
图1为实施例1中得到的吡啶六氟磷酸锂的核磁共振氢谱图;
图2为根据实施例1制备的六氟磷酸锂的红外光谱图;
图3为标准六氟磷酸锂的红外光谱图;
图4为实施例2中得到的乙腈六氟磷酸锂的FT-IR光谱图:
图5为白油的FT-IR光谱图;
图6为根据实施例2制备的LiPF6分散于白油中的FT-IR光谱图;
图7为标准六氟磷酸锂分散于白油中的FT-IR光谱图。
具体实施方式
以下实施例仅用于说明本发明,而不应当理解为限制本发明的范围和实质。
除非特别说明,本申请实施例中采用的材料、方法和设备为本领域常规的材料、方法和设备。
实施例1:
在1L的密闭设备中加入吡啶50g、氢氧化锂21g,缓慢滴加65%六氟磷酸水溶液125g,在1小时内加完,在45℃条件下反应4小时,经过滤得吡啶六氟磷酸锂固体,将此固体在20℃,压力1Pa条件下,干燥24小时,将干燥后固体溶于500g碳酸酯溶剂中(EC:DMC=1:1),经过滤除去杂质,将滤液浓缩、结晶、过滤得固体,在20℃、压力1Pa的条件下真空干燥24小时,经检测,得到的产物六氟磷酸锂中的杂质金属含量为8.5ppm,水分含量为8.1ppm,HF含量为6.8ppm。
采用核磁共振氢谱法和红外光谱法分别对中间产物(吡啶六氟磷酸锂,图1)和最终产物(图2和图3)的结构进行分析。分析结果如下:
从图1可以看到,谱图中3组峰的强度比为2:1:2,结合分子式可推算出含5个H。吡啶六氟磷酸中含有4种不同类型的共6个H,应该是4组峰。说明N-H+键通过锂交换反应消失(转化为N-Li键),符合吡啶六氟磷酸锂。
图2为根据实施例1制备的产品的红外光谱图;图3为标准六氟磷酸锂(市售)的红外光谱图。图2和图3的特征峰位置和强度都基本相同,如560.77和831.87cm-1处都出现了特征峰,对应的是F-P键伸缩振动和弯曲振动形成的峰,这也与文献报道中的820~860cm-1和550~565cm-1相符。图2中3443.88cm-1处的特征峰是LiPF6样品在测定过程中吸收了少量水蒸气造成。由此证明,实施例1所制产品为LiPF6。
实施例2:
在1L的密闭设备中加入乙腈50g、氢氧化锂21g,缓慢滴加65%六氟磷酸水溶液125g,在1小时内加完,在45℃条件下反应4小时,经过滤得乙腈六氟磷酸锂固体,将此固体在20℃,压力1Pa条件下,干燥24小时,将干燥后固体溶于500g碳酸酯溶剂中(EC:DMC=1:1),经过滤除去杂质,将滤液浓缩、结晶、过滤得固体,在20℃、压力1Pa的条件下真空干燥24小时,经检测,得到的产物中的杂质金属含量为8.1ppm,水分含量为6.8ppm,HF含量为5.9ppm。
采用FT-IR法对中间产物(乙腈六氟磷酸锂,图4)和最终产物(图5至图7)的结构进行分析。分析结果如下:
从图4中可以看到,在3450cm-1、1645cm-1、847cm-1和559cm-1四处发现了强吸收峰,这与预测的该配合物会同时出现乙腈和PF6-的特征吸收峰是一致的。其中3450cm-1和1645cm-1两处特征吸收峰与乙腈的红外吸收特征峰相对应,在847cm-1和559cm-1处的两个强特征吸收峰与PF6-的红外特征吸收峰是一致的,由此判定该无色透明晶体为Li(CH3CN)4PF6。
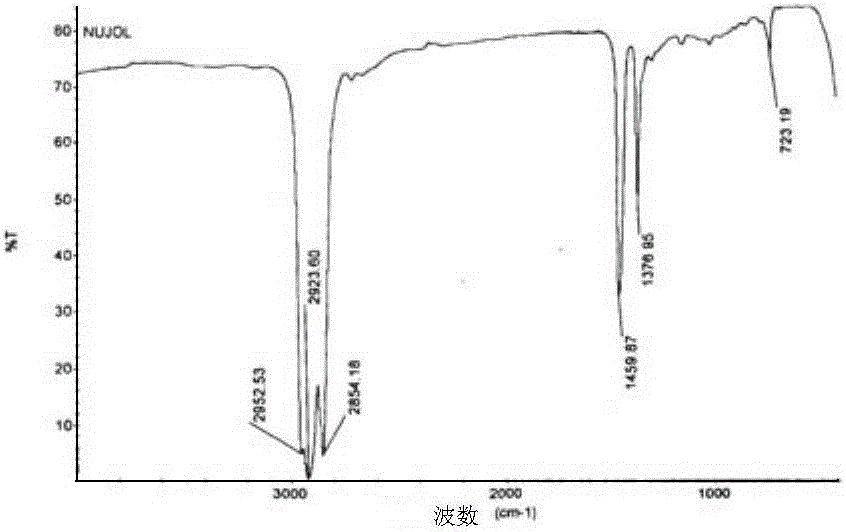
图5为白油的FT-IR光谱图;图6为实施例2制备的LiPF6分散于白油中的FT-IR光谱图;图7为标准六氟磷酸锂(市售)分散于白油中的FT-IR光谱图。
六氟磷酸盐应该在820~860cm-1和550~565cm-1处有两个强吸收峰,图6中扣除空白后仅在837cm-1和569cm-1两处发现了LiPF6的强吸收峰,与理论分析一致。故判断实施例2制备的LiPF6和标准LiPF6结构一致。
- 还没有人留言评论。精彩留言会获得点赞!