玻璃前体凝胶的制作方法
本公开涉及一种用于制备玻璃制品的玻璃前体凝胶,且更特别地,涉及一种当受热时快速转化成熔融玻璃的玻璃前体凝胶。
公开背景和内容
长期以来,玻璃制品由预先配制的原料(有时也称为玻璃配料)制成,其被装入玻璃熔炉中并熔融以产生熔融玻璃,以便随后形成为所需的玻璃制品。典型的原料包括原始(virgin)原材料,和任选地,工业上被称作“碎玻璃”的回收玻璃材料的物理混合物。原始原材料含有石英砂(结晶sio2)和其它成分,例如用于钠钙硅玻璃的如苏打灰(na2co3)和石灰石(caco3),并且碎玻璃主要含有来自先前形成的消费或商业玻璃制品的玻璃的碎片。原料的碎玻璃组分可以基于实践的玻璃形成过程和最终玻璃制品的期望特性(例如颜色,透明度等)而变化。然而,在许多情况下,原料可以含有至多约80重量%的碎玻璃,其余的是原始原材料,其除了以上所列成分之外,还可以包括或可以不包括小百分比的其它成分,包括玻璃网络形成剂、网络改性剂、着色剂、脱色剂、澄清剂和氧化还原剂,仅举几例。
常规玻璃原料在玻璃熔炉中的停留时间相对较长。这可以归因于几个因素。首先,原始原材料的最大组分——石英砂,和通常一些其它原始原材料成分(例如钠钙硅玻璃的苏打灰和石灰石)是结晶材料。它们的晶体结构,包括中间结晶相通常在至多约1200℃下存在,因为这些材料的熔融和溶解不会即刻发生。第二,玻璃原料在熔融后需要通过对流分散和均匀混合,以制备熔融玻璃,这是一个耗时的过程。特别地,石英砂由于其缓慢的溶解速率和在玻璃熔体内聚集成称为“帘线(cord)”的富含sio2的区域的倾向而花费最长时间分散。帘线的存在表明玻璃的不均匀性,并且可能导致成品玻璃制品中的瑕疵或缺陷。第三,一些原始原材料成分(例如钠钙硅玻璃的苏打灰和石灰石)是含碳酸盐的材料,其在熔融时释放二氧化碳(co2)。原料熔融过程中二氧化碳的释放在所得到的熔融玻璃中引入气泡,这转而可导致成品玻璃制品中的薄点或气泡缺陷。任何此类气泡通常在称为“精制玻璃”的过程中从熔融玻璃中除去。为了解决与熔融和均质化结晶原材料相关的挑战,以及除去由二氧化碳释放所引起的气泡,除其它因素之外,常规玻璃原料通常在玻璃熔炉中经受高温和24小时或更长的加热时间,以便获得适当精制和化学均质化的熔融玻璃。
如果在原料中一些原始原材料被碎玻璃替代,则可以使玻璃原料的熔融较少费力。与全部含有原始原材料的原料相比,碎玻璃加速原料的熔融并降低熔炉的能量消耗。碎玻璃具有这种作用是因为它已经被熔融、混合并形成为玻璃制品,并且当被再熔融时不会释放二氧化碳,因为它不是固有的含碳酸盐的材料。但是,碎玻璃在一些地区作为商品并非广泛可获得,并且即使它是广泛可获得的,大量购买回收材料也会遭受颜色和其它特性的巨大变动,这可能限制玻璃制造的选择。消费后碎玻璃也具有被金属、胶水和其它有机物污染的倾向,并且在熔融时有时难以与玻璃熔炉中的原始原材料均匀混合。此外,即使添加碎玻璃,目前的玻璃制造实践仍然通常涉及使玻璃原料熔融并在玻璃熔炉中在约1400℃或更高的温度下均质化/精制熔融玻璃至少约24小时。在高温下这样长的处理时间需要大量的能量,并减慢整个玻璃制造过程。
在本公开中阐述的一个或更多个实施方案可以实现各种目标中的任一种,所述目标包括,例如,获得玻璃前体凝胶,其在玻璃熔炉中可以不需要长的停留时间而熔融,以便获得均匀和精制的熔融玻璃。玻璃前体凝胶具有块状无定形氧化物基基质,其包括最终玻璃制品组合物的、以所需比例的主要组成氧化物和任何次要材料的均匀化学混合物。此外,当玻璃前体凝胶被加热和熔融时,由于它不包括碳酸盐的事实,它释放出仅仅可忽略量的二氧化碳。因为玻璃前体凝胶包括主要组成氧化物,以及相对少量的任何其它次要材料的已经均匀的化学混合物,并且因为它不含碳酸盐,所以它不需要漫长的精制过程;相反,它仅需要加热相对短的时间段,以获得准备好用于在下游生产成玻璃制品的均匀且无气泡的熔融玻璃。
本公开体现了可以彼此分开或彼此组合地实施的多个方面。
根据本公开的一个方面,提供了一种玻璃前体凝胶,其包含块状无定形氧化物基基质。所述无定形氧化物基基质化学均匀地混合,并且包括30mol%至90mol%二氧化硅和以下中的至少一种:(a)0.1mol%至25mol%的一种或更多种碱金属氧化物(mol%为总计)、(b)0.1mol%至25mol%的一种或更多种碱土金属氧化物(mol%为总计)、(c)1mol%至20mol%氧化硼(b2o3)、(d)5mol%至80mol%氧化铅(pbo)、或(e)0.1mol%至10mol%氧化铝(al2o3)。玻璃前体凝胶具有小于2.0g/cm3的密度。
根据本公开的另一方面,提供了制造玻璃制品的方法。该方法包括获得包含化学均匀混合的块状无定形氧化物基基质和扩展膨胀剂(extendingswellingagent)的玻璃前体凝胶。块状无定形氧化物基基质具有主要组成氧化物的无机网络。主要组成氧化物包含30mol%至90mol%二氧化硅和以下中的一种或更多种:(a)0.1mol%至25mol%的一种或更多种碱金属氧化物(mol%为总计)、(b)0.1mol%至25mol%的一种或更多种碱土金属氧化物、(c)1mol%至20mol%氧化硼、(d)5mol%至80mol%氧化铅、或(e)0.1mol%至10mol%氧化铝。该方法还包括将玻璃前体凝胶熔融成熔融玻璃并将熔融玻璃形成为玻璃制品。
根据本公开的又一方面,提供了制造玻璃制品的方法。该方法包括提供硅酸盐溶液,其包含含有na2o:sio2摩尔比的溶解的硅酸钠。将可溶性钙盐添加到硅酸盐溶液中以用氧化钙替换溶解的硅酸钠中的一些氧化钠,并获得包含na2o:cao:sio2摩尔比的湿沉淀物。然后从湿沉淀物中除去溶剂,以获得钠钙硅玻璃前体凝胶,其包含具有60mol%至85mol%二氧化硅、8mol%至18mol%氧化钠和5mol%至15mol%氧化钙的无机网络的化学均匀混合的块状无定形氧化物基基质。钠钙硅玻璃前体凝胶熔融成熔融玻璃,该熔融玻璃转而被形成为玻璃制品。
附图简述
从以下描述、所附权利要求书和附图中将最好地理解本公开以及其附加目标、特征、优点和方面,其中:
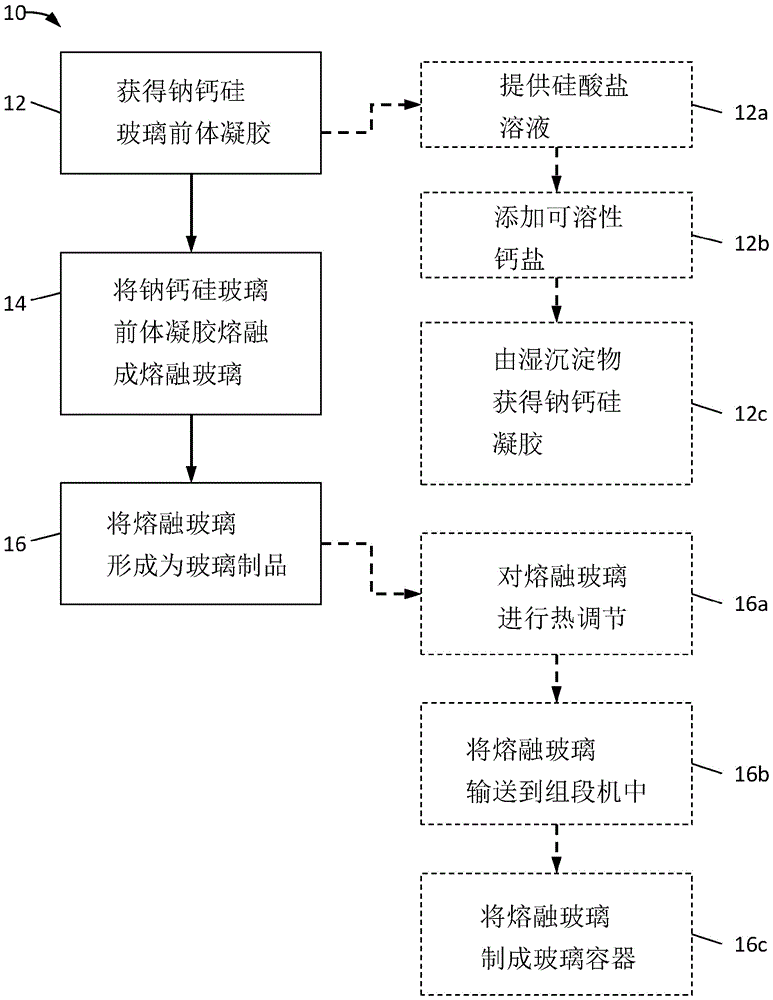
图1是描绘制备和使用玻璃前体凝胶,特别是钠钙硅玻璃前体凝胶以形成钠钙硅(“sls”)玻璃制品的方法的流程图;
图2是列出了取决于试图形成的玻璃的期望类型,玻璃前体凝胶的块状无定形氧化物基基质的几种不同可能组成的表格;和
图3是描绘由常规钠钙玻璃原料制备的商业火石玻璃以及由本公开中讨论的sls前体凝胶制备的火石玻璃的%透射率相对于波长的图。
详述
公开了可用作用于获得熔融玻璃的传统玻璃原料混合物的替代物的玻璃前体凝胶。该玻璃前体凝胶包含块状无定形(即非结晶)氧化物基基质,其特征在于,至少是最终玻璃组合物的主要组成氧化物的无机网络。主要组成氧化物以最终玻璃组合物的所需比例存在于无定形氧化物基基质中。更具体地说,无定形氧化物基基质中所包含的主要玻璃形成组成氧化物为30mol%至90mol%二氧化硅,和以下中的一种或更多种:(a)0.1mol%至25mol%的一种或更多种碱金属氧化物(mol%为总计);(b)0.1mol%至25mol%的一种或更多种碱土金属氧化物(mol%为总计);(c)1mol%至20mol%氧化硼(b2o3);(d)5mol%至80mol%氧化铅(pbo),或(e)0.1mol%至10mol%氧化铝(al2o3)。所述一种或更多种碱金属氧化物可以选自氧化锂(li2o)、氧化钠(na2o)、氧化钾(k2o)、氧化铷(rb2o)、氧化铯(cs2o)及其组合,并且所述一种或更多种碱土金属氧化物可以选自氧化镁(mgo)、氧化钙(cao)、氧化锶(sro)、氧化钡(bao)及其组合。
在一个实施方案中,无定形氧化物基基质可以包括至少60mol%至85mol%二氧化硅(sio2)、8mol%至18mol%氧化钠(na2o)和5mol%至15mol%氧化钙(cao)作为主要组成氧化物,在这种情况下,构成凝胶以制备钠钙硅玻璃。在其它实施方案中,可以构成玻璃前体凝胶以制备包括硼硅酸盐玻璃和铅封接玻璃的其它类型的玻璃。关于硼硅酸盐玻璃,取决于预期的最终用途,无定形氧化物基基质可以包括至少30mol%至85mol%二氧化硅和1mol%至20mol%氧化硼,以及以下中的至少一种:2mol%至25mol%氧化钙、或2mol%至20mol%氧化钠,作为主要组成氧化物。关于铅封接玻璃,无定形氧化物基基质可以包括至少30mol%至70mol%二氧化硅、15mol%至60mol%氧化铅,以及以下中的至少一种:3mol%至15mol%氧化钾、2mol%至10mol%氧化钠、或4mol%至10mol%氧化硼,作为主要组成氧化物。
除了主要组成氧化物之外,无定形氧化物基基质可以任选地包括通常用于玻璃制造工业中的众多次要材料。此类次要材料的实例是总计至多25mol%的其它玻璃网络形成剂、总计至多2mol%的着色剂和/或脱色剂、以及总计至多20mol%的可以影响最终玻璃制品组合物的物理性质和/或氧化还原状态的其它材料。可以添加的具体的其它玻璃网络形成剂包括氧化磷(p2o5)和氧化锗(geo2)中的一种或更多种。可以添加的具体的着色剂和脱色剂包括硒、铬、锰、铁、钴、镍、铜、铌、钼(molydenum)、银、镉、铟、锡、金、铈、镨、钕、铕、钆、铒和铀中的一种或更多种的元素形式或氧化物形式。并且可以影响玻璃的物理性质和/或氧化还原状态的具体的材料包括以下中的一种或更多种:碳(0mol%至3mol%)、硝酸盐(0mol%至3mol%)、硒(0mol%至1mol%)、氧化钛(tio2)(0mol%至5mol%)、氧化砷(as2o3)(0mol%至2mol%)、氧化钒(v2o5)(0mol%至5mol%)、氟(0mol%至2mol%)、氯(0mol%至2mol%)和硫酸盐(0mol%至2mol%)。
可以改变无定形氧化物基基质的精确组成(包括其主要组成氧化物和任选的次要材料的比例),以实现在最终玻璃制品中可能期望的各种各样的玻璃化学性质(chemistries)中的任何种。获自玻璃前体凝胶的所得玻璃的物理性质和化学性质均可受到主要组成氧化物的相对比例的变化以及在无定形氧化物基基质中包含或排除某些次要材料的影响。例如,图2中列举了不同类型成品玻璃的某些示例性玻璃化学配方。因此,为了从玻璃前体凝胶获得这些类型的成品玻璃,可以制备无定形氧化物基基质,以具有相同比例的主要组成氧化物和次要材料,使得熔融时获得可以通过标准技术形成为玻璃制品的熔融玻璃。
在无定形氧化物基基质内,主要组成氧化物和任何次要材料(其可以存在或可以不存在)化学均匀地混合。如本文所用,术语“化学均匀地混合”及其语法变异意味着凝胶的多个不同样品将具有相同的在无定形氧化物基基质中以最大量存在的三种主要组成氧化物的摩尔百分比。当各个样品中各主要组成氧化物的摩尔百分比处于如由所获取的各种样品测定的其各自的氧化物的算术平均值的±3%范围内[即,(0.97)•(平均值)<样品<(1.03)·(平均值)]时,可以说不同的样品具有相同的三种主要组成氧化物的摩尔百分比。例如,已经通过x射线荧光发现玻璃前体凝胶的五个随机的、不同的样品具有最重要的(main)三种主要组成氧化物(这里是二氧化硅、氧化钠和氧化钙)的以下摩尔百分比:
表1:样品的组成
如可以看出的,在这组样品中,如由五个样品测定的二氧化硅、氧化钠和氧化钙的算术平均值分别为72.2mol%、14.1mol%和12.3mol%。每种主要组成氧化物的算术平均值的±3%的范围随后可以计算为:二氧化硅:70.03-74.34mol%、氧化钠:13.68-14.52mol%、和氧化钙:11.93-12.67mol%。各样品中每种主要组成氧化物的摩尔百分比显然落在那些规定的范围内,并因此证实了玻璃前体凝胶的无定形氧化物基基质化学均匀地混合。
无定形氧化物基基质是轻质、多孔和吸湿性的,其允许扩展膨胀剂(例如水)被截留在氧化物的无机网络内。实际上,与碎玻璃相比,水通常以相对高的量保留在玻璃前体凝胶中。特别地,当从stp(1个大气压和20℃)开始以5℃/分钟的速率加热时,碎玻璃在高达约125℃下释放水蒸气,并且在150℃下大部分被彻底干燥,这是物理夹带的水的典型特征。另一方面,当经受相同的递增加热时,玻璃前体凝胶在125℃以上且高达400℃下继续释放水蒸气-额外的1-10重量%,且甚至可以在400℃下保留多达0.5重量%水,这表明水作为膨胀剂与无定形氧化物基基质化学结合。在一些情况下,在无定形氧化物基基质内保留的化学结合水的存在可能是有利的,这是因为它用作助熔剂(flux)以降低熔融玻璃的加工温度,特别是在低温下。并且尽管事实是玻璃前体凝胶通常包括在其无定形氧化物基基质内的化学夹带的水,玻璃前体凝胶具有小于2.0g/cm3、优选介于约1.6g/cm3和约1.85g/cm3之间的密度(包括其间的所有范围和子范围),和至少20m2/g、优选约25m2/g至约40m2/g的比表面积(surfacearea)(包括其间的所有范围和子范围),如通过氮气bet吸附测量。因此,玻璃前体凝胶的密度较碎玻璃更小,并且具有比碎玻璃更高的比表面积。
玻璃前体凝胶的组成有助于快速熔融成熔融玻璃,同时避免在玻璃熔炉中的长停留时间。玻璃前体凝胶不包含大量的结晶材料,并且最值得注意的是,无定形氧化物基基质不含任何二氧化硅的结晶前体材料,如,例如石英砂。在此值得注意的是不存在石英砂。不同于含有通常具有缓慢溶解速率的相当数量的石英砂的常规玻璃原料,该玻璃前体凝胶不必在高温下保持长时间的熔融状态以便实现令人满意的sio2溶解。无定形氧化物基基质还基本上不包含含碳酸盐的材料,并且因此,在熔融时将产生仅仅可忽略量的co2并由此在熔融玻璃内产生仅仅可忽略量的气泡。因此,由玻璃前体凝胶获得的熔融玻璃不必通过经由延长的加热时间来除去大量夹带的气泡进行精制。假设无定形氧化物基基质已经化学均匀地混合并且不含有主要组成氧化物的结晶前体材料或不含有超过非显著量的含碳酸盐的材料,玻璃前体凝胶不必被加热至高达常规玻璃原料的温度或保持在高温下长达常规玻璃原料的时间段(timeframe),以便获得适合于在下游加工成玻璃制品的熔融玻璃。
的确,如上所述,常规的钠钙硅玻璃原料通常在熔炉中熔融并保持在1400℃或更高(温度)下至少约24小时,以便获得适当精制和均质化的熔融玻璃。本公开中阐述的玻璃前体凝胶不要求(尽管它必定不排除)此类热循环需求。实际上,该凝胶可以被加热至其熔融温度以上仅仅30分钟,并仍然产生精制的、均质化的、并准备好进行进一步玻璃加工(例如,在行列机中制成玻璃容器)的熔融玻璃。例如,将钠钙硅玻璃前体凝胶加热至约1450℃仅仅30分钟至4小时足以将凝胶熔融成熔融玻璃至所需的程度。或者,如果优选较低的加热温度,则可以将钠钙硅玻璃前体凝胶加热至约1200℃持续16小时至24小时。与常规钠钙硅玻璃原料的熔融相比,这些加热选择中的每一个都构成显著的能源节约。
玻璃前体凝胶可以经化学合成。通过这样做,在低温下经由化学反应实现常规的玻璃制造的三个限速步骤——溶解石英砂、除去泡沫和均质化/混合主要组成氧化物,而不是经由其中结晶原材料(和任选的一些碎玻璃)经物理混合、熔融和保持在熔融状态以促进溶解的标准程序。具体来说,玻璃前体凝胶可以在300℃以下的温度下经化学合成,该温度远低于石英砂的熔点。并且,一旦形成,玻璃前体凝胶可以熔融成熔融玻璃,其然后可以形成为玻璃制品,如,例如玻璃容器或平板玻璃或餐具,仅举几例。玻璃前体凝胶的这种熔融可以比常规玻璃原料更快地实现,因为化学均匀混合的凝胶的化学合成通过玻璃熔炉或其它设备外部的化学反应在熔融之前进行。凝胶的低温预熔融化学合成可以最终降低熔炉能量消耗,并减少基础设施和归因于生产的每种玻璃制品的熔炉足迹(footprint)。
玻璃前体凝胶可以经化学合成,如下面将在钠钙硅前体凝胶(通过从可溶性碱金属硅酸盐沉淀出凝胶)的情况下进一步描述和证实的。通常,首先制备含有可溶性碱金属硅酸盐的硅酸盐溶液。例如,制备硅酸盐溶液的一种方法是将石英砂水热溶解在苛性含水碱金属基溶剂中。可以根据需要在溶液中调节碱金属硅酸盐中sio2与碱金属氧化物的比率。接下来,用碱土金属盐将碱金属硅酸盐从溶液中沉淀出来,以提供湿沉淀物,故意使该湿沉淀物具有与所需的最终用途玻璃组合物相同比例的主要组成氧化物。和最后,可以从湿沉淀物中除去溶剂以获得玻璃前体凝胶。
玻璃前体凝胶可以用于制造如图1中图示性显示的玻璃制品。在那里,在相应的文本中,具体地在使用一种类型的玻璃前体凝胶——即钠钙硅(“sls”)玻璃前体凝胶的情况下,例示并描述了制造玻璃制品的方法。该方法由参考数字10标示,并包括以下步骤:获得sls玻璃前体凝胶(步骤12);将sls玻璃前体凝胶熔融成熔融玻璃(步骤14);和将熔融玻璃形成为玻璃制品(步骤16)。该方法优选用于形成玻璃容器,例如瓶和罐。这些类型的容器可以包括玻璃主体,其限定用于容纳一些内容物的内部。该内部通常可从位于玻璃主体的一个轴向末端的开口进入。该开口可以构造成接收帽或盖。除了容器之外,当然可以由sls玻璃前体凝胶制成其它类型的玻璃制品。尽管参考图1显示和描述的方法集中于sls玻璃前体凝胶的制备和使用,本领域技术人员将知道并理解如何使以下教导适用于其它类型的玻璃前体凝胶,如构成以制备例如硼硅酸盐玻璃或铅封接玻璃的凝胶。
sls玻璃前体凝胶由块状无定形氧化物基基质组成,该基质至少包括二氧化硅(sio2)、氧化钠(na2o)和氧化钙(cao)作为主要组成氧化物,以及化学夹带的水作为扩展膨胀剂。例如,sls玻璃前体凝胶的无定形氧化物基基质优选包含60mol%至85mol%二氧化硅、8mol%至18mol%氧化钠、和5mol%至15mol%氧化钙。无定形氧化物基基质还可以任选包括至多约10mol%的组合的作为附加的主要组成氧化物的氧化铝、氧化镁(mgo)和/或氧化钾(k2o),和上述任何其它次要材料包括其它玻璃网络形成剂、着色剂如氧化铁(fe2o3)、其它试剂(例如氧化剂、还原剂、澄清剂等)以及玻璃工业中常见的杂质。此外,如上所述,水被化学夹带在无定形氧化物基基质内,使得当自stp(1个大气压和20℃)开始以5℃/分钟的速率加热凝胶时,水蒸气在125℃以上且高达400℃下继续释放,并且甚至可以在400℃下保留多达0.5重量%的水。如上所述,sls玻璃前体凝胶是多孔且易碎的,具有小于约2.0g/cm3的密度和大于约20m2/g的比表面积,并且构成无定形氧化物基基质的组分于在步骤14中熔融之前已经化学均匀地混合。
可以以众多方式在步骤12中获得sls玻璃前体凝胶。在一个实施方案中,如这里在图1中所描绘,sls玻璃前体凝胶通过以下步骤获得:(1)提供包含溶解的硅酸钠的硅酸盐溶液(步骤12a);(2)向硅酸盐溶液中加入可溶性钙盐以获得湿沉淀物,其与sls玻璃前体凝胶的无定形氧化物基基质具有相同比例的主要组成氧化物(步骤12b);和(3)由湿沉淀物获得sls玻璃前体凝胶(步骤12c)。下面将更详细地描述步骤12a-12c的具体实施。然而,应当理解,sls玻璃前体凝胶也可以通过未明确描述、但本领域技术人员仍然已知的其它机理获得,包括在步骤12a中提供硅酸盐溶液的替代方法,例如通过购买硅酸盐溶液或通过熔融石英砂和苏打灰的混合物和然后将所得产物溶解在水中来化学制备该溶液。
硅酸盐溶液可以在步骤12a中通过将石英砂水热溶解在苛性含水钠基溶剂中来提供。苛性含水钠基溶剂可以是强钠碱,例如氢氧化钠(naoh),其优选浓缩至大于10重量%(的钠碱),以使石英砂更易溶解。合适的强钠碱的一个实例是18重量%的naoh。石英砂的水热溶解可以在压力容器中在大气压以上的压力下实现。在那里,石英砂可以在约25℃和约300℃之间(包括其间的所有范围和子范围)、优选在约200℃和约300℃之间的温度下,和约10个大气压至约100个大气压(包括其间的所有范围和子范围)、优选约30个大气压至约50个大气压的压力下,在约3小时至约24小时(包括其间的所有范围和子范围)期间内溶解在苛性含水钠基溶剂中。在这些水热条件下形成的硅酸盐溶液含有硅酸钠的溶解的固相。所产生的溶解的硅酸钠具有化学通式na2o·xsio2,其中x在1.5至3.75范围内(包括其间的所有范围和子范围)。
可能必须调节溶解的硅酸钠中的na2o与sio2的比率,以确保sls玻璃前体凝胶的无定形氧化物基基质具有二氧化硅、氧化钠和氧化钙的适当摩尔百分比。特别地,当无定形氧化物基基质具有大约1:1:6的na2o:cao:sio2的摩尔比时(其中介于0.8:0.8:6和1.4:1.3:6之间的变动对于典型的容器玻璃而言是可接受的),以上所列的主要组成氧化物的摩尔百分比可以得到满足。然而,硅酸盐溶液中的溶解的硅酸钠通常包括2-3molna2o每6molsio2。为了调节na2o与sio2的摩尔比(如果需要),可以采用多步技术。首先,溶解的硅酸钠中的na2o与sio2的摩尔比可以用酸来降低。例如,可以以中和一些na2o的量添加硝酸(hno3)到硅酸盐溶液中,以使溶解的硅酸钠中的na2o与sio2的摩尔比降至大约2:6。硝酸将硅酸钠中和成硅酸(sih4o4)和硝酸钠(nano3)。如下文将更详细解释的,当钠被钙替换时,在步骤12(b)中实现na2o与sio2的摩尔比的进一步降低——降至大约1:6。
在步骤12a期间可以将sls玻璃前体凝胶的无定形氧化物基基质中可能需要的其它主要组成氧化物和次要材料作为固体加入硅酸盐溶液中,或者在将它们加入溶液中之前可以将它们溶解在水中。可以加入硅酸盐溶液中的一些其它材料包括氧化铝、氧化镁、氧化钾、氧化铁、氧化钛、氧化锆、氧化钡、氧化锶(sro)、三氧化硫(so3)和硒、钴、铬、锰和铅的氧化物。特别地,增强钠钙硅玻璃的化学耐久性并减小熔融玻璃中的失透倾向的氧化铝可以通过在水热条件下向苛性含水钠基溶剂中加入含氧化铝的矿物以及石英砂来引入。此时添加含氧化铝的材料导致氧化铝在石英砂的水热溶解期间化学结合到溶解的硅酸钠中。这里可以使用的含氧化铝的矿物的一些实例是霞石正长岩、细晶岩和calumite渣。氧化铝也可以呈溶解的铝酸钠的形式被引入硅酸盐溶液中。
在步骤12a期间可以引入硅酸盐溶液中的次要材料的清单比适才提及的更加广泛。可以加入着色剂和脱色剂,例如以下中的一种或更多种:铁氧化物(例如feo和/或fe2o3)、铬氧化物(例如cro或cr2o3)、钴氧化物(例如coo或co2o3)、镍、铜、硒、二氧化锰、氧化铈、钛,以及硫、铁和碳的组合。可以加入硅酸盐溶液中的另一类次要材料是澄清剂,如,例如硫酸钠(na2so4)、碳、氧化砷和氧化锑的组合。更进一步,如果需要,可以添加氧化剂或还原剂到硅酸盐溶液中,以改变由sls玻璃前体凝胶获得的熔融玻璃的氧化还原值。普通氧化剂和还原剂的实例包括硫酸钙(caso4)、硝酸钠(nano3)、硝酸钾(kno3)、黄铁矿(fes2)和石墨。
在步骤12a中已配制硅酸盐溶液之后,可以在步骤12b中将可溶性钙盐加入硅酸盐溶液中,以获得湿沉淀物,其具有sls玻璃前体凝胶的无定形氧化物基基质中所需的相同比例的主要组成氧化物(例如二氧化硅、钠和钙)。该步骤包括将可溶性钙盐加入硅酸盐溶液中,其量使得湿沉淀物中的na2o:cao:sio2的摩尔比达到大约1:1:6,这是无定形氧化物基基质的所需摩尔比,和转而由sls玻璃前体凝胶制备钠钙硅玻璃。可溶性钙盐可以包括例如硝酸钙(ca(no3)2)、氯化钙(cacl2)、氢氧化钙(ca(oh)2)或任何其它可溶性钙盐或提供钙离子源的可溶性盐的组合。当加入硅酸盐溶液中时,由可溶性钙盐提供的钙离子替换溶解的硅酸钠中的钠,从而将氧化钙引入硅酸盐中,这导致新改性的硅酸钠作为湿沉淀物从溶液中沉淀出来。并且因为每1mol钙离子(其产生相应mol的cao)替换溶解的硅酸钠中1mol的na2o,所以需要加入硅酸盐溶液中以提供具有1:1:6的na2o:cao:sio2的摩尔比的湿沉淀物的可溶性钙盐的量可以基于来自步骤12a的硅酸盐溶液中的na2o:sio2的摩尔比容易地计算出。
na2o被cao替换和湿沉淀物的沉淀优选在硅酸盐溶液尽可能浓缩的情况下进行。事实上已经发现,随着溶解的硅酸钠在硅酸盐溶液中变得更稀,湿沉淀物中的na2o的量减少,而sio2和cao的量不受类似的影响。这转而可以增加湿沉淀物中sio2和cao的各自的摩尔百分比,其可能超出可接受的范围,归因于单独的na2o的损失。因此,可以通过用浓缩的硅酸盐溶液进行步骤12来抵消在步骤12b期间意外损失na2o的可能性。适当浓缩的硅酸盐溶液可以在步骤12a结束时包含至少5重量%的硅酸钠,且更优选在步骤12a结束时包含25重量%和40重量%之间的硅酸钠。
基于硅酸盐溶液的浓度,从湿沉淀物中单独损失na2o的现象已经在简单的实验中得到证明。具体地说,用0l、1l、2l和3l水稀释了281克star级硅酸钠的四个单独样品。然后用溶解在500ml水中的34.5克硝酸钙沉淀硅酸钠的各溶液。从各样品中获得sls玻璃前体凝胶、将其熔融并形成为玻璃、进行抛光、并然后用x射线荧光分析以确定其玻璃化学组成。假设na和ca之间的离子交换效率为100%,四个玻璃样品的标称组成按照总的主要组成氧化物的mol%分数报道,应为约72.2mol%sio2、15.8mol%na2o和12.0mol%cao。但是,如下表2中所示,随着溶解的硅酸钠在使用硝酸钙进行沉淀之前变得更稀,玻璃(以及因此,形成玻璃的sls玻璃前体凝胶的无定形氧化物基基质)的na2o摩尔百分比开始下降,而未稀释的样品保留几乎所有的na2o。
表2:稀释对氧化钠含量的影响
通过除去液体溶剂,可以在步骤12c中由湿沉淀物获得sls玻璃前体凝胶。通过任何数量的分离技术可以实现液体溶剂的去除。离心、膜渗透、压滤、螺旋压榨、化学分离和/或机械复合(即挤压)是将液体溶剂从湿沉淀物中分离的方法的显著实例。然后可以将在步骤12a和12b中经化学制备以具有所需的钠钙硅玻璃的玻璃化学配方的剩余固体干燥。干燥可以在例如约100℃至约500℃的中等温度下的对流烘箱中进行,或者其可以在足以从回收的固体萃取残余溶剂的条件下以任何其它合适的方式进行。在溶剂去除和干燥之间可以任选地进行回收固体的冲洗,以洗去任何反应物和/或反应副产物。当已经令人满意地除去液体溶剂时,sls玻璃前体凝胶得以保留,并且此时凝胶准备好用作用于根据步骤14和16制备玻璃制品的原料。
在步骤14中,将sls玻璃前体凝胶熔融成熔融玻璃。与常规的钠钙硅玻璃原料相比,sls玻璃前体凝胶的熔融可以相对快速地完成,这是因为该凝胶的无定形氧化物基基质不包括大量的结晶材料(例如石英砂)或含碳酸盐的材料,并且在熔融之前其已经被化学均质化成所需的玻璃配方。在一个实施方案中,为了将sls玻璃前体凝胶熔融成适合于随后的玻璃形成操作的熔融玻璃,仅需要将该凝胶在约1450℃或更高的温度下加热约30分钟至约4小时(包括其间的所有范围和子范围)的时间段。这样的加热时间是令人满意地熔融常规玻璃原料所花费的时间的约六分之一或更小。当然,如果需要,可实施更长的加热时间,但是通常不需要更长的加热时间。作为更长的加热时间的实例,可将sls玻璃前体凝胶加热至1200℃持续约16小时至约24小时,其仍然产生均匀的、无气泡的熔体,但比熔融常规钠钙硅玻璃原料消耗的能量更少。
sls玻璃前体凝胶可以在玻璃熔炉中熔融。例如,玻璃熔炉可以是构造有气体燃烧和热辐射热源以加热容器内部的耐火砖衬里(refractorybrick-line)容器。在使用中,sls玻璃前体凝胶可以从侧面的投料口引入熔炉中并在玻璃浴的顶部。热源从顶部和/或底部加热sls玻璃前体凝胶,且玻璃浴从底部加热漂浮凝胶。sls玻璃前体凝胶最终熔融并作为熔融玻璃同化于玻璃浴中。与常规钠钙硅玻璃原料相比,对于sls玻璃前体凝胶而言,这相当快速地发生,这是由于由sls玻璃前体凝胶获得的熔融玻璃的石英砂溶解、气泡去除和均质化已经通过低温化学反应完成。因此,由sls玻璃前体凝胶获得的熔融玻璃在其准备好随后形成为玻璃制品之前不必在熔炉中停留在熔融状态下非常长的时间,如上述的热循环时间和温度所示。为此,用于熔融sls玻璃前体凝胶的熔炉可以设计成比传统的玻璃熔融熔炉小地多。
在步骤16将由sls玻璃前体玻璃获得的熔融玻璃形成为玻璃制品可以通过任何合适的玻璃形成方法来进行。例如,为了制造玻璃容器,可以对熔融玻璃进行热调节(步骤16a)、将其输送到组段机(sectionmachine)中(步骤16b)、和然后制成具有所需尺寸和形状的玻璃容器(步骤16c)。熔融玻璃优选在前炉中进行热调节,该前炉被构造成接收来自玻璃熔炉的熔融玻璃。该前炉可以包括经加热的通道,其将熔融玻璃的温度降低至约1050℃至约1200℃(包括其间的所有范围和子范围),使得熔融玻璃实现所需的热分布和粘度以便随后成型。在前炉的末端,剪切刀片可以切断熔融玻璃的精确部分,称为玻璃料滴,其转而可以通过料滴输送系统被输送到组段机的初形模(blankmold)中。优选为行列(is)机的组段机然后通过吹-吹法、压-吹法或某种其它方法将料滴制成玻璃容器。
sls玻璃前体凝胶具有产生具有良好透明度和颜色的钠钙硅玻璃的倾向,这与通常在由常规玻璃原料获得的钠钙硅玻璃中发现的蓝/绿色相反。归因于铁杂质的蓝/绿色是由在600nm至1500nm具有宽吸收峰的铁的还原态(亚铁,fe2+)引起的。将亚铁氧化成三价铁(fe3+)减少钠钙硅玻璃的感知的蓝/绿着色,因为三价铁是比亚铁弱得多的着色剂。当在步骤14中熔融sls玻璃前体凝胶时,认为发生任何铁内容物(content)从亚铁到三价铁的这种氧化,从而产生更透明的玻璃。不受理论的约束,目前据信sls玻璃前体凝胶保留了当在步骤12b中na2o被cao替换时产生的一些可溶性钠副产物。据信是硝酸钠(na(no3)2)的钠副产物是已知的氧化剂,因为当被加热时该硝酸盐分解产生氧气(o2)、一氧化氮(no)和二氧化氮(no2)。当加热凝胶时,已经显示在约450℃和约1500℃之间从sls玻璃前体凝胶中释放氧气。
图3有助于量化sls玻璃前体凝胶产生没有蓝/绿色调的火石玻璃的倾向。在那里,描绘了钠钙硅玻璃的三个样品的透射率曲线:由原始结晶原材料制备的两个商业样品和由sls玻璃前体凝胶制备的一个样品。由结晶原材料制备的两个样品(样品a和样品b)和由sls玻璃前体凝胶制备的样品(样品c)的以重量%fe2o3表示的铁含量(不是fe2+/fe3+比率的度量)通过x射线荧光测量并列在下表3中。
表3:以重量%fe2o3表示的样品的铁含量
如上表和图3中的图表所示,在600-1200nm光谱范围内,由sls玻璃前体凝胶获得的钠钙硅玻璃(其具有0.042重量%的铁,以fe2o3表示)类似于由常规结晶原材料获得的火石玻璃(其具有0.016重量%的铁,以fe2o3表示)。再次,认为由sls玻璃前体凝胶获得的玻璃(样品c)中fe2+吸收的抑制由残留的硝酸钠引起,该残留的硝酸钠或者被截留在sls玻璃前体凝胶的无定形氧化物基基质的孔中、或者化学结合至无定形氧化物基基质,尽管可能在步骤12c中进行了重复的分离、冲洗和干燥步骤。
然后玻璃容器可以在组段机中形成之后经受额外的制造和/或处理。具体来说,一旦玻璃容器从组段机出来,则可以将其冷却以保持其形状,然后在一个或更多个退火炉中再加热。玻璃容器可以在退火炉中再加热(或退火),通常在约550℃和约600℃之间的温度下进行约30分钟至约90分钟,以除去容器中的应力点。然后可以逐渐冷却玻璃容器。在检查和包装容器之前,可以将各种热端、冷端、抗反射、耐刮擦和/或玻璃强化涂层中的任何种施加至玻璃容器的外表面。
与玻璃前体凝胶相关的上述讨论虽然具体涉及钠钙硅玻璃前体凝胶的制备和使用,但是仍然可以适用于制备和使用其它情况下的玻璃前体凝胶,最显著的是制备和使用用以制备硼硅酸盐玻璃或铅封接玻璃的玻璃前体凝胶。对于硼硅酸盐玻璃和铅封接玻璃中的每一种,玻璃前体凝胶的化学合成(步骤12)基本相同,唯一显著的区别是在溶液中和在沉淀期间操控溶解的碱金属硅酸盐的组成的方式。例如,为了制造硼硅酸盐玻璃,可以将硼酸加入硅酸盐溶液中以将溶液酸化至硅酸盐的溶度极限以下(在约9.5-10的ph以下),使得湿沉淀物,和由此最终产生的玻璃前体凝胶的无定形氧化物基基质将合并b2o3。作为另一实例,为了制造铅封接玻璃,可将可溶性铅盐(例如硝酸铅)加入硅酸盐溶液中(代替可溶性钙盐),以将pbo并入湿沉淀物中,并因此并入玻璃前体凝胶的无定形氧化物基基质中。
实施例
根据本公开,以下实施例展示了玻璃前体凝胶,特别是sls前体凝胶及其制造方法的具体实施方案。
实施例1
该实施例描述了其中已经获得大约100克sls玻璃前体凝胶的一种方式。首先,从pqcorporation(位于宾夕法尼亚,马尔文的公司总部)购买硅酸盐溶液。该硅酸盐溶液含有na2o·xsio2,其中x为2.58,作为溶解固相以37.1重量%存在于溶液中。使用281克的该硅酸盐溶液而没有进一步稀释。接着,向大约200ml去离子水中加入5.75克的15.5m硝酸,并然后伴随剧烈搅拌将全部内容物加入硅酸盐溶液中。加入该硝酸以中和溶解的硅酸钠的一些氧化钠内容物。在那之后,将20.6克石灰石(碳酸钙)溶解在具有15.5m硝酸(〜37.2克)的化学计量的大约500毫升去离子水中,以将石灰石转化成可溶性硝酸钙。那时释放了二氧化碳。然后在室温下、伴随剧烈搅拌将硝酸钙溶液加入硅酸盐溶液中。立即形成白色湿沉淀物。
将具有沉淀物的硅酸盐溶液置于塑料管中并离心大约5分钟以沉积湿沉淀物。然后将上清液滗析并替换为去离子水以冲洗湿沉淀物。离心和冲洗程序再重复两次,并在最后的滗析步骤之后,不向试管中加入额外的去离子水。在那时,将湿沉淀物铺在碟上,并在120℃下的对流烘箱中干燥过夜。在干燥之后,获得具有化学均质化的化学配方的脆性、白垩的、白色大块形式的sls玻璃前体凝胶。然后将sls玻璃前体凝胶在铂坩埚中在1450℃下熔融。在30分钟之后,sls玻璃前体凝胶完全熔融且无气泡。在较低温度(具体是1200℃和1350℃)下进行额外的类似形成的sls玻璃前体凝胶的熔融,并发现在每种情况下在16小时之后都完全熔融且无气泡。
由本实施例的sls玻璃前体凝胶制备的熔融玻璃中的某些材料的目标摩尔百分比在下表4中作为“参考1”报道。如可以看出的,sio2、na2o和cao的目标摩尔百分比分别为74.0、13.6和12.4。实际上,sls玻璃前体凝胶制备的熔融玻璃所含的sio2、na2o和cao的重量百分比贴近那些主要组成氧化物的目标重量百分比。sls玻璃前体凝胶可以反复实现主要组成氧化物的这些组成,其中na2o的波动小于1mol%(即目标na2o±1.0mol%)。
实施例2
在该实施例中,硅酸盐溶液由石英砂制成,而不是像实施例1中那样购买。首先,将374克石英砂加入5.7mnaoh溶剂中。将该混合物置于搅拌的高压釜反应容器中,并在250℃下反应12小时。超过99.9mol%的石英砂溶解。所得的硅酸盐溶液含有具有化学式na2o·xsio2(其中x为约2.6)的溶解的硅酸钠。最终使用硅酸盐溶液以实施例1中阐述的相同方式制备sls玻璃前体凝胶。它也以相同的方式熔融,得到相同的结果。在通过该实施例的sls玻璃前体凝胶制备的熔融玻璃中的某些材料的摩尔百分比报道在下表4中。
实施例3
在该实施例中,将氧化铝引入硅酸盐溶液中,并最终引入sls玻璃前体凝胶中。这里,当制备硅酸盐溶液时,在搅拌的高压釜反应容器中混合853克水、218克naoh、321克石英砂和29克霞石正长岩。使混合物在250℃下反应10小时,并以na2o与sio2的目标摩尔比为1:2制备。在水热处理之后,通过#40whatman纸过滤所得的硅酸盐溶液。发现6.3重量%的原始固体不溶解。并且因为霞石正长岩占原始固体的8.3重量%,所以据信至少一些霞石正长岩溶解到硅酸盐溶液中。然后使用经过滤的硅酸盐溶液来制备如实施例1中阐述的sls玻璃前体凝胶,其中用更多硝酸调节以抵消溶解的硅酸钠中na2o与sio2的较大摩尔比。发现由本实施例的sls玻璃前体凝胶制备的熔融玻璃含有约0.5%的al2o3。该熔融玻璃中的al2o3和其它材料的摩尔百分比报道在下表4中。
实施例4
该实施例描述了将氧化铝引入硅酸盐溶液中以及最终引入sls玻璃前体凝胶中的另一种方式。这里,以与实施例1中相同的方式制备sls玻璃前体凝胶,不同的是将氢氧化铝分散在用于中和一些na2o的硝酸中。氢氧化铝不完全溶解在硅酸盐溶液中。在sls玻璃前体凝胶使用硅酸盐溶液制备之后,并在其被加热时,残余的氢氧化铝随着水的释放而转化为氧化铝。并且在1450°c下仅15分钟的sls玻璃前体凝胶的熔融之后,即使氧化铝是耐火材料,在玻璃熔体中也没有观察到氧化铝石(aluminastone)。发现通过本实施例的sls玻璃前体凝胶制备的熔融玻璃含有约1.0mol%的al2o3,如下面与熔融玻璃中其它材料的摩尔百分比一起在表4中报道的。
实施例5
这里如实施例1中所述制备sls玻璃前体凝胶,其中进行了一些改进。首先,将氧化铝引入硅酸盐溶液和sls玻璃前体凝胶中,将在溶解的硅酸钠中产生1.0mol%al2o3所需量的铝酸钠溶解在水中并与实施例1中所述的硅酸盐溶液混合。其次,使用硝酸钙和硝酸镁的混合物来使溶解的硅酸钠沉淀到湿沉淀物中,目的是添加少量的mgo以及cao。试图加入通过本实施例中的sls玻璃前体凝胶制备的熔融玻璃中的al2o3和mgo的量作为“参考2”报道在下表4中。发现通过熔融sls玻璃前体凝胶制备的熔融玻璃分别含有约0.9mol%和2.7mol%的al2o3和mgo,这也在下面与熔融玻璃中其它材料的摩尔百分比一起在表4中报道。
实施例6
如实施例1中所述制备本实施例中的sls玻璃前体凝胶,不同的是在使用硝酸钙沉淀之前,将氧化钴(coo)和氧化铬(iii)(cr2o3)加入硅酸盐溶液中。这些氧化物不溶解,但反而在沉淀之前伴随剧烈混合而分散在硅酸盐溶液中。将氧化钴和氧化铬(iii)以在湿沉淀物中分别实现25ppm和1ppm所需的量加入硅酸盐溶液中。使用该硅酸盐溶液制备的sls玻璃前体凝胶看起来与实施例1的sls玻璃前体凝胶一样。然而,在1450℃下加热本实施例的sls玻璃前体凝胶5分钟之后,获得了化学均匀且为深蓝色的熔融玻璃,其没有任何石块或有色条纹。此外,在1450℃下继续加热1小时之后,熔融玻璃无气泡。
实施例7
如实施例1中所述制备本实施例中的sls玻璃前体凝胶,不同的是将fe2o3、碳和硫酸根阴离子加入sls玻璃前体凝胶中。在溶解的硅酸钠沉淀之前,将fe2o3和碳作为不溶性化合物加入。在最终冲洗步骤之后并在干燥之前,将硫酸根阴离子以硫酸的形式加入湿沉淀物中。此时进行硫酸根阴离子添加(经由硫酸)是因为在冲洗步骤期间硫酸钠将容易被冲洗掉。本实施例中制备的sls玻璃前体凝胶在熔融时产生具有蓝绿色的熔融玻璃,这有点不同寻常,因为这里采用的添加化合物通常产生琥珀色/棕色。这里观察到的蓝绿色表明铁/硫络合物经历比通常将在由结晶原材料获得的常规熔融玻璃中发现的氧化性更强的环境。这种看法与图3中所示的透明钠钙硅玻璃的透射数据一致,并且与氧化环境是由于在sls玻璃前体凝胶中留下的残留硝酸钠副产物而产生的看法一致。
实施例8
在该实施例中,如实施例7中所述制备sls玻璃前体凝胶,不同的是添加的碳的量增加。因为碳是还原剂,所以添加的碳的增加旨在克服显然归因于sls玻璃前体凝胶中残留的硝酸钠副产物的氧化环境。由本实施例的sls玻璃前体凝胶熔融产生的熔融玻璃呈褐色。
表4:如通过x射线荧光测量的熔融玻璃的组成
因此已经公开了完全满足先前阐述的目标和目的中的一个或更多个的玻璃前体凝胶。已经结合几个说明性实施方案呈现了本公开,并且已经讨论了额外的改进和变化。鉴于前述讨论,其它改进和变化将容易浮现在本领域普通技术人员眼前。例如,为了方便起见,每个实施方案的主题都通过引用由此并入每个其它实施方案中。本公开旨在包括落入所附权利要求的精神和广泛范围内的所有此类改进和变化。
- 还没有人留言评论。精彩留言会获得点赞!