技术领域:
本发明属于生物医学材料制备领域,具体涉及一种超小缺陷氧化钨纳米粒的制备方法,该方法制备的缺陷氧化钨粒径小分散均匀,生物相容性好,可以应用到癌症治疗方面。
背景技术:
纳米技术与肿瘤医学相结合形成的纳米肿瘤医学是纳米医学中新兴的领域,也是当前各国前沿科技优先发展的核心领域。常见的肿瘤治疗方法主要包括外科手术治疗、化学治疗、放射治疗等,这些治疗理论上可以杀死所有的肿瘤细胞,但是这些方法给人体带来的伤害和强的副作用要大于癌症本身。最近光学治疗受到人们的极大关注主要是因为光学治疗成本低、特异性强、副作用小等特点。常用于光热治疗的纳米材料有金纳米材料、碳纳米材料、半导体材料等。
超小缺陷氧化钨纳米粒(wo3-x)是以纯态形式存在的一种非化学计量比的钨氧化物。它具有一些独特的性能如光致变色、近红外吸收等,所以一直是一个研究热点。但目前制备wo3-x还处于探索阶段,且大部分研究集中在制备氧化钨纳米线上。而与之相比,纳米线量子点由于其粒径小,受热均匀等特点更适合应用在生物医学方面。
目前制备缺陷氧化钨的方法主要有:化学气相沉淀法、溅射法等但这些方法对条件有较高的要求,且合成困难、成本高。而水热法制备方法简单,对反应条件要求较低,且得到的产物分散性好,力度比较均匀等优点。
技术实现要素:
:
本发明的目的是提供一种生物相容性好、粒径小的超小缺陷氧化钨纳米粒及其合成方法和在生物医学方面的应用。
一种超小缺陷氧化钨纳米粒的制备方法,利用多巴胺作为稳定剂和还原剂,氯化钨作为前驱体,在有机溶液中搅拌均匀后进行水热反应,得到分布均匀的超小缺陷氧化钨纳米粒。
所述的氯化钨选自wcl6·xh2o,x=0-6中的一种或多种。
所述多巴胺与氯化钨的摩尔比为1:1-1:8,进一步优选1:2。
所述水热反应温度为150-250℃,优选150-200℃,进一步优选180℃。
所述水热反应时间为6-30h,优选18-30h;进一步优选为24h。
所述的有机溶剂包括三乙二醇、乙二醇、丙二醇中的一种或多种,优选为三乙二醇。
上述水热反应的产物分别用水和乙醇洗涤至少3次,12000rpm离心得到产物。
一种超小缺陷氧化钨纳米粒,是由上述的方法制备得到的。
所述的超小缺陷氧化钨纳米粒用于制备治疗肿瘤的制剂。
本发明的优势主要为:(1)该方法合成的wo3-x粒径非常小;(2)具有明显的光热效应和动力学效应,可以用于肿瘤治疗。
附图说明
图1:本发明制备的wo3-x的tem图和edx能谱;
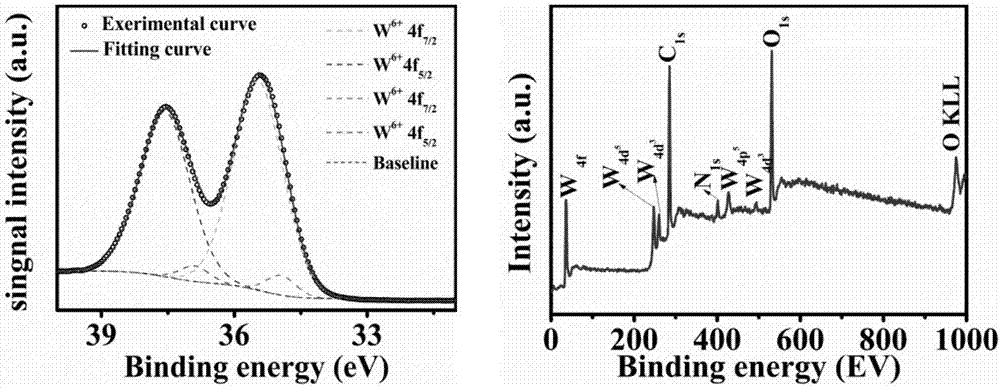
图2:本发明制备的wo3-x的xps图;
图3:(a)(b)不同浓度的本发明制备的wo3-x溶液在808nm波长光照下溶液温度随光照时间的变化图,(c)本发明制备的wo3-x溶液的光热循环图,(d)本发明制备的wo3-x溶液循环前后的紫外-可见光谱图;
图4:以dpbf为1o2的检测探针,(a)dpbf溶液在808nm波长光照过程中紫外-可见吸收光谱,(b)本发明制备的wo3-x+dpbf溶液在808nm波长光照过程中紫外-可见吸收光谱,(c)在通氧气条件下bp+dpbf溶液在808nm波长光照过程中紫外-可见吸收光谱,(d)不同条件下dpbf(410nm)吸光度变化;
图5:(a)不同浓度本发明制备的wo3-x在光照和非光照下对4t1细胞的毒性,(b)不同处理条件下活细胞和凋亡细胞染色的荧光图片,(c)细胞内1o2的荧光倒置成像;
图6:(a)808nm波长激光光照下pbs和本发明制备的wo3-x的体内光热成像图,(b)不同治疗条件下小鼠肿瘤体积增长图,(c)16天后小鼠肿瘤体积对比图,(d)治疗过程中小鼠体重变化图;
图7:不同治疗方式后小鼠主要器官和肿瘤组织的切片图。
具体实施方式
下面结合具有实施方式旨在进一步说明本发明,而非限制本发明。
实施例1
1、wo3-x的制备:
盐酸多巴胺和wcl6以摩尔比1:2溶于三乙二醇中,混合液转移到20ml的聚四氟乙烯不锈钢高压釜中,在180℃加热24h,冷却到室温后,将产物分别用水和乙醇洗涤3次,12000rpm离心得到产物。
2、wo3-x热效应和光热稳定性的测定:
透明石英瓶中加入1ml不同浓度的wo3-x溶液(0,100ppm,200ppm,300ppm,400ppm),用808nm波长激光灯照射玻璃瓶底部5min,固定激光灯功率为1wcm-2,每隔1min用红外光热成像仪对溶液进行光热成像。同样在石英瓶中加入1ml不同浓度的wo3-x溶液(0,100ppm,200ppm,400ppm,600ppm)溶液,用808nm波长激光灯照射石英瓶底部10min,固定激光灯的功率为1wcm-2。每隔30s记录溶液的温度。然后固定溶液的浓度为200ppm,先光照10min,自然冷却20min至室温,这样重复5次,同样每隔30s记录溶液温度的变化。然后分别测定5次循环前后溶液的紫外可见吸收光谱。
3、wo3-x动力学的测定:
将3mlwo3-x乙醇溶液和30ul1,3二苯基异苯并呋喃(dpbf)的乙醇溶液混合后在黑暗的条件下搅拌2h,使dbpf的吸附和解析达到平衡,用808nm波长激光照射单纯的dpbf溶液60min,每隔10min测定一次溶液在410nm处的紫外吸收;用808nm波长激光照射空气条件下dpbf和wo3-x混合溶液60min同样每隔10min测定一次溶液在410nm处的紫外吸收;1o2的产生对o2有依赖性,测定了用808nm激光光照过程中不断通入氧气的条件下同样每隔10min测定wo3-x和dpbf溶液410nm处的吸光度的变化。
4、细胞毒性的测定:
通过噻唑蓝比色法(mtt)测定wo3-x体外毒性,收集对数期的4t1细胞(小鼠乳腺癌细胞),用胰蛋白酶消化成单个分散的细胞接种到96孔板里,使每个孔的细胞密度为1x104/ml细胞,在5%co237℃的培养箱里培养过夜。贴壁后除去原培养液,换成含有不同浓度wo3-x(0、50、100、150、200、250ppm)的培养基再培养24h。其中每个浓度一半的孔黑暗条件下继续培养,另外一半的孔分别用808nm激光光照10min,光照完后每个孔里均加入10ul浓度为5mg.ml-1的3-(4,5-二甲基)-2,5-二甲基四氮唑溴盐(mtt)继续培养4h,mtt与活细胞内线粒体中的琥珀酸脱氢酶能使外源性的mtt还原成水不溶性的蓝紫色晶体甲瓒,然后用离心机离心培养板,小心将上层培养基吸去,加入200uldmso溶液溶解细胞内形成的甲瓒。最后用酶标仪测定490nm和630nm处的紫外吸收值。根据公式计算细胞的活性:
其中,od490nm为溶液在490nm处的吸光度值,od630nm为溶液在630nm处的吸光度值。
5、死活负染实验:
我们进一步用荧光成像的方法更加形象地验证了wo3-x的治疗效果。用绿色荧光染料calcein-am染活细胞,红色荧光染料pi染死细胞。收集对数期4t1细胞并接种在96孔板中,每孔的细胞密度为1x104/ml,培养过夜细胞贴壁后分别进行以下几种方式处理:a、空白对照组,b、808nm激光光照,c、wo3-x和d、wo3-x+808nm激光光照。a组不做任何处理,b组用808激光光照10min,c、d组用含有wo3-x的细胞培养液培养细胞4h,然后用808nm激光器光照10min(光功率密度固定为1w·cm–2)。光照结束后继续培养24h。用荧光染料calcein-am和pi对所有细胞染色20min,最后用pbs溶液清洗细胞,在荧光倒置显微镜下成像。
6、细胞内1o2的检测:
取对数期的4t1细胞,将消化好的细胞接种在96孔板上培养过夜,待细胞贴壁后分成a、b、c三组,先除去三组原有的培养基,向a组里加入新的培养基,b、c组加入含有wo3-x的培养基,继续培养4h。向每孔里加入20ul0.3mg/ml的h2dcfh-da培养30min后,a、c组分别用808nm波长的激光灯光照10min,除去上面的培养基,用生理盐水洗涤2次后,用荧光倒置显微镜进行成像。
7、动物实验:
肿瘤模型的建立:收集对数期的4t1细胞,离心后用生理盐水洗涤一次除去残余的培养液。在6周的雄性balb/c小鼠的背部皮下注射100ul含有4t1细胞的生理盐水,一星期后小鼠的背部有肿瘤长出,肿瘤体积的大小可以通过游标卡尺测量,v=ab2/2待肿瘤体积约为120mm3时,将小鼠随机分成4组每组3只:a、空白对照组;b、808nm波长激光照射组;c、wo3-x组;d、wo3-x+808nm波长激光照射组。a和b组分别在肿瘤内部注射20ul的生理盐水,c和d组分别进行瘤内注射20ulwo3-x(wo3-x浓度为0.5mg.kg–1)。注射2h后用808nm波长激光灯照射d组的肿瘤部位5min,激光灯的功率为1w.cm-2。在光照过程中用近红外热成像仪记录肿瘤部位的温度。每隔1天测量肿瘤的大小记录小鼠的体重,16天后通过颈椎脱节的方式处死小鼠。对小鼠进行解剖取出主要器官(心、肝、脾、肺、肾和肿瘤)进行组织切片和he染色用荧光倒置显微镜观察组织的变化。通过下面公式计算肿瘤的抑制率。
vc代表空白对照组小鼠肿瘤体积vt代表实验组小鼠肿瘤体积。
本发明的试验结果:
1、透射电子显微镜表征:
为了表征wo3-x纳米粒的形貌,对其进行透射电子显微镜分析。如图1所示,大概1-2nm的纳米粒均匀地分布在碳支持膜上,由edx图可以看出该纳米粒的主要成分是o和w。
2、x射线光电子能谱表征:
由图2可以看到在35.82ev(w6+4f7/2)和38.05ev(w6+4f5/2)处有两个强的峰,在34.72ev(w5+4f7/2)和36.82ev(w5+4f5/2)处有两个弱峰,可以说明该产物主要由w5+tow6+组成且原子比例为89:11。紫外-可见吸收光谱。
3、热力学效应:
wo3-x在808nm波长下有较强的吸收,且随着浓度的增大温度的升高值逐渐增大。为了更加形象地说明wo3-x具有很好的光热效果,用红外热成像仪对不同浓度的wo3-x溶液在808nm波长光照5min过程中进行光热成像。可以明显地看出随着wo3-x浓度的增大光热成像的照片越亮,图3a。用808nm波长激光照射600ppm的wo3-x分散液10min后,温度由开始的29℃升高到了91℃,而同样条件处理水后,温度由29℃升高到39℃左右。由此可以说明wo3-x具有很好的光热作用如图3b。在循环实验中每次用808nm波长激光灯循环照射时溶液升高的温度基本相同,每次冷却至室温所用的时间基本相同,且经过5次循环后的wo3-x溶液的紫外可见吸收峰与循环前的重合,这说明wo3-x具有很好的光热稳定性。见图3c、d
4、动力学效应:
1,3二苯基异苯并呋喃(dpbf)是应用最广泛的活性氧捕获剂,它能与1o2反应生成1,2-联苯甲酰苯(dbb),可以通过测定dpbf在410nm处的紫外吸收的降低值间接反应1o2的产生量。单纯的dpbf溶液光照60min后在410nm处的吸收峰基本没有发生变化,即可以排除光漂白作用图4a。而当加入wo3-x后,可以发现随着光照时间的延长,dpbf在410nm处的吸收峰逐渐减弱,说明在808nm激光的照射下,wo3-x能够产生1o2图4b。且将其在通氧气条件下进行,光照后dpbf在410nm的吸光度降低程度相比于空气条件下更加明显,即增大溶液中氧气的含量可以使wo3-x产生1o2的效率增强图4c。图4ddpbf在410nm处吸光度的降低值进行直观比较,单纯的dpbf光照后吸光度基本没有变化;在空气条件下含有wo3-x的dpbf溶液光照60min后吸光度值降低了20%,说明有1o2产生。氧气条件下含有wo3-x的dpbf溶液光照60min后吸光度值降低了33%,即通入氧气可以提高1o2的产率。由此可以说明wo3-x在808nm波长光照下能够产生1o2。
5、mtt毒性实验
采用mtt方法对wo3-x体外的抗肿瘤效果进行了考察。可以看出在没有光照的条件下,wo3-x的浓度高达250ppm时4t1细胞的存活率仍然保持在80%以上说明wo3-x自身的毒性较低生物相容性好。在光照时间相同的条件下,随着wo3-x浓度的增大细胞的存活率逐渐降低,当浓度为250ppm时细胞的存活率仅有30%。见图5a,说明在黑暗条件下wo3-x对细胞基本没有毒性,而在808nm激光照射下wo3-x使癌细胞死亡具有一定的毒副作用。
6、死活负染实验
为了更加形象地验证wo3-x能够使癌细胞死亡,我们用绿色荧光染料calcein-am染活细胞,红色荧光染料pi染死细胞。由图5b可以看出,在不做任何处理时,视野里的细胞均发出绿色的荧光,说明细胞状态很好。只用808nm激光灯照射或者wo3-x处理细胞时时,视野里只有零星的几个细胞发出红色荧光,说明激光照射细胞的活性基本没有影响且wo3-x生物相容性好毒性小,而用含wo3-x的培养基培养进行激光光照后,视野中的细胞大部分显示红色,说明大部分细胞已经死亡,即wo3-x在激光灯的照射下产生1o2和热使细胞死亡,其结果和mtt实验的结果一致。
7、细胞内ros的检测:
以h2dcfh-da为ros荧光探针,考察wo3-x在细胞内产生ros的能力。如图5c所示,a组用808nm激光器处理细胞时,细胞内基本看不到荧光说明ros探针在单纯光照条件下不能产生1o2;b组只用wo3-x处理细胞时细胞内也没有发出绿色荧光,而wo3-x和808nm同时处理细胞时可以看出细胞内发出绿色的而荧光,说明wo3-x在808nm激光器的照射下有1o2产生,1o2与探针结合发出绿色荧光。
8、以balb/c小鼠为动物实验对象,在小鼠的皮下建立肿瘤模型。在小鼠肿瘤内注射wo3-x后用808nm波长激光灯照射小鼠肿瘤部位5min,与此同时用热成像仪记录肿瘤部位温度的变化。由图6可以看出,没有注射wo3-x的小鼠808nm激光灯照射5min后温度仅升高到41℃。而注射了wo3-x的小鼠,光照5min后肿瘤部位温度升高到69℃,由此可以看出wo3-x具有很好的光热作用。肿瘤体积达到120mm3时,将小鼠随机分成4组:a、空白对照组b、808nm激光照射组、wo3-x组d、wo3-x+808nm激光照射组,如图6所示,a、b、c组小鼠肿瘤的体积没有发生明显的降低,d组小鼠瘤内注射wo3-x溶液808nm波长激光灯照射5min后肿瘤的生长受到明显的抑制。说明在光照的条件下wo3-x的动力学治疗和热力学治疗可以有效地抑制肿瘤的生长。在治疗过程中小鼠的体重未发生明显的降低,组织切片结果显示,小鼠的主要器官(心脏脾肺肾)未发生明显异常,说明治疗过程对小鼠没有产生明显的毒性(见图7)。