Keggin型饱和磷钼酸盐及其包覆材料的制备与光催化应用的制作方法
本发明涉及废水处理光催化材料的制备,属于环保材料技术领域,尤其涉及一种keggin型饱和磷钼酸盐及其包覆材料的制备与光催化应用。
背景技术:
在过去四十年里,多金属氧酸盐(poms)因具有多样的分子结构和独特的氧化还原特性而使得其在光催化领域备受瞩目,并且此类催化剂具有环境友好、转化率高及选择性好的特点。近年来,虽然学者在杂多酸光催化降解有机污染物方面做了较多的研究工作,然而这些工作主要集中在1:12系列饱和keggin结构磷钨酸(pw12)和硅钨酸(siw12)在紫外光条件下的光催化降解研究,还缺少对不同元素不同结构的多酸光催化剂研究实验,也缺少在太阳光条件下具有较强吸收的,能够充分利用太阳能的多酸催化剂研究工作。
亚甲基蓝(methyleneblue,缩写成mb)作为一种重要的有机染料和指示剂,结构中的苯环等属于难降解官能团,广泛应用于印染业棉麻织物的染色和高校实验室无机化学实验等方面。如果未经任何处理直接排放到水体中,染料废水和实验污水会造成严重的水污染现象,进而危害人类健康。
因此,本文拟首先通过水热合成法合成微纳米多酸pmo12,进而以纳米贵金属银颗粒为基质,合成目前少有见报道的多酸核壳包覆材料ag@pmo12。并且在模拟太阳光照射下降解亚甲基蓝染料,研究染料初始浓度、溶液ph值和外加因素h2o2对脱色降解效果的影响,确定最佳的处理条件,从而达到充分利用太阳能的目的。
技术实现要素:
基于背景技术存在的技术问题,本发明提出了一种keggin型饱和磷钼酸盐及其包覆材料的制备方法。
本发明的技术方案如下:
一种keggin型饱和磷钼酸盐的制备方法,包括以下步骤:
a、分别称取钼酸钠和磷酸,溶解在去离子水中,升温至80~90℃恒温搅拌20~35min;
b、继而加入盐酸进行酸化;随后加入氯化钴和邻菲罗啉继续恒温搅拌,用饱和碳酸钠溶液调节ph值为6.5~,7.5;
c、混合液封装入反应釜中,170~200℃下反应4~5小时;
d、冷却、离心、干燥得到饱和磷钼酸盐,记作pmo12。
优选的,所述的步骤a中,钼酸钠和磷酸的摩尔比为(10~15):1。
优选的,所述的步骤a中,盐酸酸化后,ph为2~3。
所述的反应釜为带有聚四氟乙烯内衬的不锈钢反应釜。
一种keggin型饱和磷钼酸盐包覆材料的制备方法,将keggin型饱和磷钼酸盐的制备方法中步骤a中的去离子水替换为银纳米粒子溶液即可。
优选的,所述的银纳米粒子agnps的制备方法,包括以下步骤:称量硝酸银溶解于去离子水中煮沸,进而快速向沸液中加入质量分数0.5~1.2%的柠檬酸钠水溶液,煮沸反应0.8~1.5h。随着反应进行,溶液颜色逐步经历无色—淡黄色—灰绿色的颜色变化,且逐渐由全透光经半透光后变为不透光,最终反应液为灰绿色不透明的银纳米粒子溶液。
本发明的有益之处在于:本发明的keggin型饱和磷钼酸盐的制备方法,包括以下步骤:称取钼酸钠和磷酸,溶解在去离子水中,升温后恒温搅拌;继而加入盐酸进行酸化;随后加入氯化钴和邻菲罗啉继续恒温搅拌,调节ph值至中性,混合液封装入反应釜中,高温下反应4~5小时;冷却、离心、干燥即可;其包覆材料的制备方法与其区别在于,溶解于银纳米粒子溶液而不是去离子水;经测试,该光催化材料对废水尤其是亚甲基蓝染料废水有非常好的催化降解效果。
附图说明
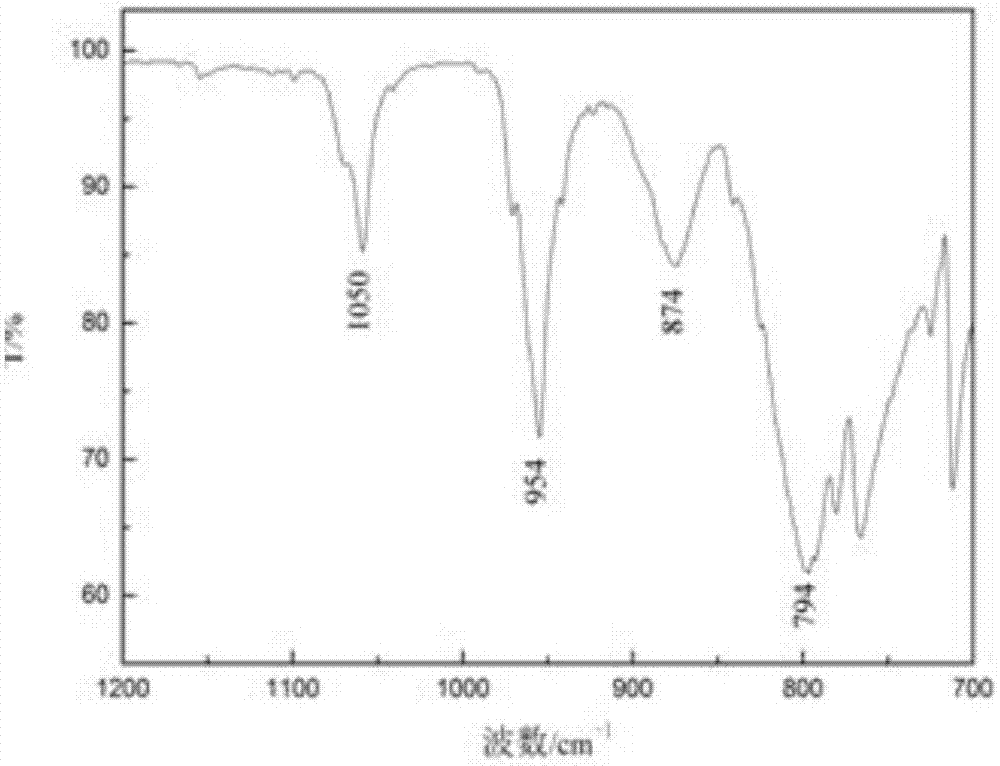
图1为实施例1-1中pmo12样品的傅里叶红外光谱图;
图2为实施例2-1中ag@pmo12样品的傅里叶红外光谱图;
图3为实施例1-1中pmo12样品的xrd谱图;
图4为实施例2-1中ag@pmo12样品的xrd谱图;
图5为实施例1-1中pmo12样品的紫外可见吸收光谱图;
图6为纳米银粒子的的紫外可见吸收光谱图;
图7为实施例2-1中ag@pmo12的紫外可见吸收光谱图;
图8为实施例1-1中pmo12样品的扫描电镜图;
图9为实施例1-1中pmo12样品的eds元素分析谱图;
图10为银纳米粒子的扫描电镜图;
图11为实施例1-1中ag@pmo12样品的扫描电镜图;
图12为实施例2-1中ag@pmo12样品的eds元素分析谱图;
图13为pmo12/h2o2降解mb实验中,h2o2添加量对染料脱色率的影响图;
图14为pmo12/h2o2降解mb实验中,亚甲基蓝初始浓度对脱色率的影响图;
图15为pmo12/h2o2降解mb实验中,亚甲基蓝溶液ph值对染料脱色率的影响图;
图16为pmo12/h2o2对照实验第一组对照实验图,其中,a光,bh2o2,cpmo12,dpmo12/h2o2,e光/h2o2,f光/pmo12,g光/pmo12/h2o2;
图17为pmo12/h2o2对照实验第二组对照实验图,其中,a光,bh2o2,cpmo12,dpmo12/h2o2,e光/h2o2,f光/pmo12,g光/pmo12/h2o2;
图18为pmo12/h2o2对照实验,降解率与降解条件的对照实验柱状图;
图19为pmo12循环利用实验效果图;
图20为pmo12光催化前后结构对比图,其中,a光催化之前,b第一次光催化后,c第二次光催化后,d第三次光催化后;
图21为pmo12降解mb实验中,染料初始浓度对脱色率的影响图;
图22为pmo12降解mb实验中,mb溶液在最佳浓度下不同时间的吸收光谱图;
图23为pmo12/h2o2降解mb实验中,不同降解条件h2o2添加量对染料脱色率的影响,其中,a光,bh2o2,cpmo12,dpmo12/h2o2,e光/h2o2,f光/pmo12,g光/pmo12/h2o2;
图24为pmo12对照实验第一组对照实验图,其中,a光,bh2o2,cpmo12,dpmo12/h2o2,e光/h2o2,f光/pmo12,g光/pmo12/h2o2;
图25为pmo12对照实验第二组对照实验图,其中,a光,bh2o2,cpmo12,dpmo12/h2o2,e光/h2o2,f光/pmo12,g光/pmo12/h2o2;
图26为pmo12对照实验降解率与降解条件的对照实验柱状图;
图27为ag@pmo12循环利用效果实验图;
图28为ag@pmo12光催化前后结构对比图;其中,a光催化之前,b第一次光催化后,c第二次光催化后,d第三次光催化后;
图29为银纳米粒子的光催化降解曲线;
图30为银纳米粒子降解mb溶液的吸收光谱图;
图31为ag@pmo12光催化降解mb的实验,染料初始浓度对染料脱色率的影响图;
图32为ag@pmo12光催化降解mb的实验,染料初始浓度对染料最优降解时间的影响;
图33为ag@pmo12对亚甲基蓝溶液的光催化降解效果实验,5mg/l染料的光催化对照实验图;
图34为ag@pmo12对亚甲基蓝溶液的光催化降解效果实验,80mg/l染料的光催化对照实验图;
图35为ag@pmo12对亚甲基蓝溶液的光催化降解效果实验,降解率与降解条件的对照实验柱状图;
图36为ag@pmo12循环利用实验效果图(染料浓度5mg/l);
图37为ag@pmo12循环利用实验效果图(染料浓度80mg/l)
图38为多酸催化前后结构对比(染料浓度5mg/l);
图39为多酸催化前后结构对比(染料浓度80mg/l);
图40为h2o2光催化亚甲基蓝实验,叔丁醇对染料脱色率的影响图;
图41为pmo12体系叔丁醇对染料脱色率的影响图;
图42为ag@pmo12体系叔丁醇对染料脱色率的影响图。
具体实施方式
实施例1为keggin型饱和磷钼酸盐的制备方法。
实施例1-1:
一种keggin型饱和磷钼酸盐的制备方法,包括以下步骤:
分别称取(1.65mmol)钼酸钠和0.12mmol浓磷酸,溶解在30ml去离子水中85℃恒温搅拌30min,继而加入盐酸进行酸化(ph2~3)。随后加入0.04g氯化钴,0.02g邻菲罗啉继续恒温搅拌,用饱和碳酸钠溶液调节ph值7,混合液封装入15ml带有聚四氟乙烯内衬的不锈钢反应釜中,180℃下反应4.5小时。冷却、离心、干燥得到饱和磷钼酸盐。
实施例1-2
一种keggin型饱和磷钼酸盐的制备方法,包括以下步骤:
分别称取(1.8mmol)钼酸钠和0.12mmol浓磷酸磷酸,溶解在30ml去离子水中80℃恒温搅拌35min,继而加入盐酸进行酸化(ph2~3)。随后加入0.04g氯化钴,0.02g邻菲罗啉继续恒温搅拌,用饱和碳酸钠溶液调节ph值6.5,混合液封装入15ml带有聚四氟乙烯内衬的不锈钢反应釜中,170℃下反应4小时。冷却、离心、干燥得到饱和磷钼酸盐。
实施例1-3
一种keggin型饱和磷钼酸盐的制备方法,包括以下步骤:
分别称取(1.2mmol)钼酸钠和0.12mmol浓磷酸磷酸,溶解在30ml去离子水中90℃恒温搅拌25min,继而加入盐酸进行酸化(ph2~3)。随后加入0.04g氯化钴,0.02g邻菲罗啉继续恒温搅拌,用饱和碳酸钠溶液调节ph值7.5,混合液封装入15ml带有聚四氟乙烯内衬的不锈钢反应釜中,200℃下反应5小时。冷却、离心、干燥得到饱和磷钼酸盐。
实施例2为keggin型饱和磷钼酸盐包覆材料的制备方法。
实施例2-1:
一种keggin型饱和磷钼酸盐包覆材料的制备方法,包括以下步骤:
分别称取(1.65mmol)钼酸钠和0.12mmol浓磷酸磷酸,溶解在30ml银纳米粒子溶液中85℃恒温搅拌30min,继而加入盐酸进行酸化(ph2~3)。随后加入0.04g氯化钴,0.02g邻菲罗啉继续恒温搅拌,用饱和碳酸钠溶液调节ph值7,混合液封装入15ml带有聚四氟乙烯内衬的不锈钢反应釜中,180℃下反应4.5小时。冷却、离心、干燥得到饱和磷钼酸盐。
实施例2-2
一种keggin型饱和磷钼酸盐包覆材料的制备方法,包括以下步骤:
分别称取(1.8mmol)钼酸钠和0.12mmol浓磷酸溶解在30ml银纳米粒子溶液中80℃恒温搅拌35min,继而加入盐酸进行酸化(ph2~3)。随后加入0.04g氯化钴,0.02g邻菲罗啉继续恒温搅拌,用饱和碳酸钠溶液调节ph值6.5,混合液封装入15ml带有聚四氟乙烯内衬的不锈钢反应釜中,170℃下反应4小时。冷却、离心、干燥得到饱和磷钼酸盐。
实施例2-3
一种keggin型饱和磷钼酸盐包覆材料的制备方法,包括以下步骤:
分别称取(1.2mmol)钼酸钠和0.12mmol浓磷酸,溶解在30ml银纳米粒子溶液中90℃恒温搅拌25min,继而加入盐酸进行酸化(ph2~3)。随后加入0.04g氯化钴,0.02g邻菲罗啉继续恒温搅拌,用饱和碳酸钠溶液调节ph值7.5,混合液封装入15ml带有聚四氟乙烯内衬的不锈钢反应釜中,200℃下反应5小时。冷却、离心、干燥得到饱和磷钼酸盐。
所述的实施例2中的银纳米粒子溶液的制备方法,包括以下步骤:称量0.09g(0.53mmol)硝酸银溶解于500ml去离子水中煮沸,进而快速向沸液中加入9ml质量分数1%的柠檬酸钠水溶液,煮沸反应1h。随着反应进行,溶液颜色逐步经历无色—淡黄色—灰绿色的颜色变化,且逐渐由全透光经半透光后变为不透光,最终反应液为灰绿色不透明的银纳米粒子溶液。
以下对实施例1-1和实施例2-1的样品进行表征。
1、红外光谱表征结果及分析
在keggin结构的杂多酸盐[xm12o40]n-中,存在四种氧原子,其中有4个氧原子连接着杂原子x,记为oa,不同三金属簇角顶共用的桥氧ob,同一三金属簇公用的桥氧oc和每个八面体的非公用端氧od。这些氧原子与杂原子x、配原子m之间分别存在四种键,即x–oa,m=od,m–ob–m和m–oc–m。对于具有keggin结构的多酸,在700~1100cm-1指纹区内会出现4个特征吸收峰分别对应这4种键。因此本文首先通过红外光谱仪表征制备材料的组成结构,具体测试结果及分析如下:
图1为700~2000cm-1范围内pmo12样品的红外光谱图,合成的样品在1050cm-1,956cm-1,874cm-1,794cm-1处出现较明显的吸收峰。与完整keggin型结构的光谱特征峰对照,可以推测出:1050cm-1归属于p–oa键伸缩振动频率,956cm-1对应mo=od键的伸缩振动频率,874cm-1是mo–ob–mo键的伸缩振动频率,794cm–1对应于mo–oc–mo的弯曲振动,表明合成的样品具有keggin结构。
图2是700~2000cm-1范围内ag@pmo12样品的红外光谱图,合成的样品在1050cm-1,954cm-1,874cm-1,794cm-1处出现较明显的吸收峰,与经典的keggin结构杂多酸相符,表明合成的包覆样品具有keggin结构骨架。
2、x射线粉末衍射表征结果及分析
对于keggin型杂多阴离子,其xrd的衍射峰位置主要集中在2θ为7-10°,16-23°,25-30°,31-43°四个区间内。因此本文通过多晶粉末x射线衍射仪表征制备材料的晶型结构和组成,具体测试结果及分析如下:
图3为合成的饱和12-钼磷酸盐样品的xrd谱图。xrd的衍射峰在2θ为7°,18°,28°,43°处有吸收,与keggin结构杂多酸的特征吸收峰基本一致,进一步说明制备的化合物具有keggin型结构。
从图4可知,ag@pmo12特征峰2θ=7°,9°,16°,26°,29°,33°,38°,44°,64°,77°。其中2θ为38°,44°,64°,77°分别对应于面心立方银纳米粒子的(111)(200)(220)(311)晶面,与银纳米粒子的标准卡片87-0597吻合,说明制备的包覆材料含有银纳米粒子。同时,包覆材料在2θ为7°,9°,16°,26°,29°,33°处具有特征衍射峰,集中在7-10°,16-23°,25-30°,31-43°四个区间内,说明经过包覆后仍具有完整的keggin型结构骨架。
3、紫外-可见吸收光谱表征结果及分析
keggin结构杂多酸盐的紫外可见吸收光谱一般有两个较强的吸收峰,能量较高的吸收峰一般出现在200nm,能量较低的吸收峰一般在260nm。因此本文通过紫外-可见吸收光谱分析所制备材料对光的响应范围和响应强度,具体结果和分析如下:
由图5可以看出,合成的pmo12样品在200nm和260nm处具有特征吸收。前者谱带较强,能量较高,属于od–w之间的跃迁。后者谱带较弱,能量较低,属于ob–w,oc–w之间的跃迁,是杂多酸的特征谱带,进一步说明制备的样品具有keggin型基本结构。同时,经典keggin结构多酸在200nm附近吸收较强,260nm后吸收较弱,450nm后几乎观察不到明显的吸收峰。本实验合成的样品相比较于经典keggin型多酸,在200nm~400nm范围内具有强吸收,具有更宽的吸收带和吸收强度,扩大了光响应范围。
从图6紫外可见吸收光谱可知,合成的银纳米粒子agnps在420nm附近出现一个较尖锐的特征吸收峰,与mie式理论得到的典型球形银纳米粒子紫外谱图基本一致。而且此紫外峰可以宽化到500nm左右,说明本论文合成的agnps在可见光区域具有特征吸收。另外,由于纳米贵金属颗粒具有表面等离子体共振吸收现象(spr)的光学性质,在宏观上表现为溶液出现特定颜色,紫外可见光谱上则是等离子共振峰位置和数量的不同。本谱图中agnps的一个衍射峰峰值可能归功于球形颗粒表面等离子体共振或者粒子横向表面对纵向表面等离子体共振产生的。扫描电子显微镜图中类似球形的银纳米粒子进一步证实了这一猜测。
由图7可知,合成的ag@pmo12样品在420nm处具有特征吸收。相比于前驱体饱和多酸pmo12,吸收带边红移至可见光区,对光吸收能力大大增强。这主要是由于多酸pmo12和银纳米粒子agnps的带隙不一致而发生重叠,导致包覆材料带隙降低,从而达到扩大光响应范围的目的。同时,包覆材料在500和540nm处出现了新的吸收峰,这可能是由于贵金属银纳米颗粒等离子共振吸收引起的,相比于纯银纳米粒子的吸收峰(420nm)产生了明显的宽化和红移现象。
4、扫描电子显微镜表征结果及分析
本文通过扫描电子显微镜(sem)表征所制备产物的形貌和结构等特征,具体结果和分析如下:
图8是饱和磷钼酸盐的sem图。多酸pmo12呈现块状,直径约为25um。由图9合成样品的eds元素分析谱图定性分析可知,谱图中出现磷元素、钼元素、碳元素、氧元素和钠元素的特征峰,表明多酸pmo12样品是由磷元素、钼元素、碳元素、氧元素和钠元素组成的。
图10是银纳米粒子扫描电镜图。柠檬酸钠在沸水中强还原所得到的银纳米粒子呈类球形,这是由于在银纳米粒子生长过程中,柠檬酸根亲和吸附于银纳米粒子的表面,且没有选择性造成的。柠檬酸钠还原所得到的agnps比较均匀,尺寸大约在100nm~200nm之间。
由图11和图12定性分析可知,多酸包覆材料中均含有银元素,表明本实验合成了多酸核壳包覆材料,前驱体纳米多酸成功将银纳米粒子包覆在其中,进一步印证了xrd实验数据结果。
以下对keggin型饱和磷钼酸盐及其包覆材料的光催化性能研究。
pmo12/h2o2光催化降解mb的实验结果及分析
1pmo12/h2o2降解mb优化实验
文献研究表明,多酸pmo12/h2o2体系对亚甲基蓝染料的降解效果取决于多个因素,主要有h2o2添加量、染料初始质量浓度和溶液ph等。本节中针对这些主要因素对多酸催化降解mb污染物的影响进行优化实验和研究分析。
(1)h2o2添加量对脱色率的影响
在亚甲基蓝溶液浓度20mg/l,光催化剂用量2g/l,ph3时,不同双氧水添加量对光催化降解效果的影响如图13所示。
由图13可知,随着h2o2添加量的增加,mb去除率先呈上升趋势后下降。当h2o2用量分别为0.1ml、0.2ml、0.3ml时,反应100min对亚甲基蓝的脱色率分别为88.62%、93.10%和91.86%。在h2o2浓度过高时,不仅可能吸收和衰减光催化过程中可利用的入射太阳光,还可能由于生成氧化性相对较弱的ho2·,减少羟基自由基的量,从而阻碍了光催化降解的程度。
(2)亚甲基蓝溶液初始浓度对脱色率的影响
在光催化剂用量2g/l,双氧水用量0.2ml,ph3的条件下进行光催化降解实验,考察染料初始浓度对脱色率的影响,结果示于图14。
从图14可以看出,反应100min后,mb初始质量浓度为5mg/l、10mg/l、15mg/l、20mg/l和25mg/l时对应的脱色率分别是98.44%、93.85%、93.14%、93.10%、91.74%。此外2mg/l染料由于浓度过低,脱色较快,测定时很快达到最优值,无法进行监测,因此不再进行研究和讨论。而且亚甲基蓝溶液浓度越大,脱色反应进行得越慢,催化降解达到最优值所需时间经历从60min到90min的过程。
(3)亚甲基蓝溶液ph值对脱色率的影响
取4份初始浓度5mg/l的亚甲基蓝溶液,加入浓度2g/l光催化剂,分别调节不同ph值进行光催化降解实验,静置,离心,取上清液测定吸光度,计算降解率,结果如图15所示。
由图15可知,在ph3~5区间多酸光催化活性最高,脱色率均达98.44%。而且当ph较低(ph<3)时,不利于自由基的产生,使得污染物去除率降低。这一现象说明杂多酸pmo12在弱酸性条件下比较稳定,有利于光催化降解。因此,恰当控制反应体系ph值,对促进催化反应效率,提高废水脱色效果是非常必要的。
2pmo12/h2o2对照实验
为了研究杂多酸对亚甲基蓝溶液的光催化效果,对照实验的具体结果和分析如下:
(1)亚甲基蓝染料在太阳光条件下照射一定时间的脱色率是30%。由图16a和17a试验数据可知,随着光照时间的增加,染料脱色率逐渐升高,当照射到40min后脱色率基本不变。结果表明没有多酸和h2o2存在的情况下,亚甲基蓝溶液可以吸收可见光,具有一定程度的直接光解。原因是反应溶液中溶解氧产生活性氧物种对染料的反应过程。同时进一步推测出在太阳光/多酸/h2o2三者共同存在的体系中,亚甲基蓝染料吸收可见光,可传递电子给多酸和h2o2。
(2)向体系中仅加入0.2mlh2o2,脱色率是14.88%。从图16b和17b实验数据可知,染料脱色率随着光照时间的增加而增大,当光照70min后脱色率基本不变。这一实验说明h2o2作为强氧化剂具有一定的氧化能力,可降解少部分染料。
(3)向体系中仅加入2g/l多酸pmo12,脱色率是98.4%。由此可以看出没有光存在的条件下,pmo12具有较高的化学活性,主要起作用的是多酸吸附作用和氧化作用。此外,多酸的吸附作用和氧化作用同时发生,很难证明催化过程中先发生吸附作用或者是先发生氧化作用。
(4)在太阳光照射情况下,加入0.2mlh2o2,脱色率是42.28%,高于只使用h2o2氧化降解的效率。实验发现采用太阳光/h2o2体系,太阳光中的微量紫外光可促使h2o2直接分解产生易得电子氧化性强的羟基自由基,即类fenton方法,这些·oh攻击并且破坏有机污染物分子,从而达到降解目的。另外,本对照实验的溶液ph值是3,对uv/h2o2工艺氧化性的发挥是最适宜的,以达到有机污染物的最高去除效果。
(5)在模拟太阳光条件下,加入饱和多酸pmo12,脱色率是99.22%,染料浓度明显降低,远高于单独h2o2的降解率。因而表明染料溶液在不加多酸只加h2o2的情况下虽有一定的降解,但远远低于投加一定量多酸时的降解率,进一步表现出在太阳光下多酸具有很高的响应活性,自身作为单独的光催化剂催化降解有机物,性质优良。而且,太阳光/pmo12光催化体系脱色率大于单独加入pmo12条件下的脱色率,说明太阳光的加入对亚甲基蓝催化降解起到了促进作用。
(6)模拟太阳光、30%h2o2、多酸pmo12共同存在的条件下,脱色率是98.44%,对有机污染物降解效果明显。同时,该体系光/pmo12/h2o2大于暗光/pmo12/h2o2体系对染料mb的降解率,由此可见多酸/过氧化氢体系在太阳光存在的情况下可以提高活性。
3pmo12/h2o2循环利用实验
在实际应用中,光催化剂的重复利用率是非常重要的。以初始浓度5mg/l的亚甲基蓝溶液为探针物,在光催化剂用量2g/l,双氧水用量0.2ml,ph3的最佳光催化降解条件下讨论多酸的回收利用问题。图19是本研究体系中多酸循环利用实验结果。经过三个实验周期后,饱和光催化剂pmo12的活性损失较小。在第三个催化降解周期结束时,对亚甲基蓝染料的降解率仍可达到78.48%。
4光催化前后pmo12的结构
对于太阳光/pmo12/h2o2体系,在不同光催化降解条件下对多酸进行取样,通过iraffinity-1型红外光谱仪表征光催化后样品的组成结构,具体测试结果及分析如下:
由图20可知,光催化前后多酸pmo12的红外光谱图吸收峰位置基本一致,因而表明多酸光催化前后组成结构不变,并且是作为催化剂参与反应的。
综上所述,本节采用制备的目标产物pmo12为光催化剂,以卤钨灯为光源,研究了其对亚甲基蓝染料废水的光催化降解效果。光催化实验以h2o2添加量、染料浓度和溶液酸度作为主要影响因素,以mb溶液在可见分光光度计测得的吸光度为实验目标,得到最优的实验条件是:在催化剂用量2g/l,h2o2添加量0.2ml,溶液ph为3,mb浓度5mg/l下,反应60min后脱色率最佳,达到98.44%。
ag@pmo12/h2o2光催化降解mb的实验结果及分析
1ag@pmo12/h2o2降解mb优化实验
在多酸pmo12降解有机污染物的优化实验中,主要研究亚甲基蓝染料初始质量浓度对脱色降解的影响。本论文固定催化剂用量为2g/l,选用溶液ph3,在不添加双氧水条件下进行光催化脱色反应100min,考察不同染料初始浓度对脱色率的影响,实验结果见图21。
从图21可知,在光照条件下催化剂分散在亚甲基蓝溶液中,随着mb浓度的升高,染料的脱色能力没有发生明显变化,脱色率大约在99.22±2%左右。表明mb几乎被完全降解。这可能是由于杂多酸在催化氧化有机染料时,反应效率与其结构和氧化性有关。而且亚甲基蓝溶液浓度越大,褪色反应进行得越慢,基本完全脱色所需时间经历从50min到80min的过程。
根据图22紫外可见吸收光谱图可以看出,在模拟太阳光照射下,随着光照时间增加,5mg/l亚甲基蓝溶液在665nm处的最大吸收峰峰值逐渐降低,即mb去除率逐渐增大。当时间延长到60min后,特征波长处吸收峰几乎消失,没有产生新吸收峰。由此可见多酸pmo12样品对5mg/l染料表现出良好的光学性能,而且没有产生新的杂质。
为了进一步考察过氧化氢对pmo12催化降解体系的影响,在不同降解反应条件(包括染料浓度和h2o2添加量)下进行光催化降解实验,反应脱色情况见图23所示。
由图23可知,不同反应体系亚甲基蓝溶液的光催化脱色率随着30%h2o2加入量的变化而变化。在光/pmo12/h2o2体系中,当h2o2添加量为0.2ml时,不同浓度染料去除率分别达到98.44%,93.85%和93.1%。当使用量低于或者超过0.2ml时,各浓度mb去除率均发生降低。因此本实验条件下,h2o2的最佳添加量是0.2ml。
同时在pmo12光催化过程中,反应100min后,mb初始质量浓度为5mg/l、10mg/l、20mg/l时对应的转化率大约是99.22±2%左右,高于光/pmo12/0.2mlh2o2体系的脱色率。上述结果表明pmo12的光催化效果好于pmo12/h2o2复合体系。因此在随后的pmo12实验测试中,选择在不添加h2o2的条件下进行,研究亚甲基蓝溶液光催化降解效果。
2ag@pmo12/h2o2对照实验
为了考察亚甲基蓝溶液直接光解情况和多酸催化剂pmo12对mb的催化降解效果,分别进行了对照实验,具体结果和分析如下:
((1)在模拟太阳光条件下,亚甲基蓝染料光催化反应进行到90min时脱色率是30%,远远低于有催化剂的体系。由此可见mb溶液可以吸收太阳光中的可见光,且具有一定程度的直接光解。同时,实验数据发现亚甲基蓝溶液在没有催化剂的条件下降解非常缓慢,这是因为mb分子本身存在一定的抗紫外光辐射性。
(2)在这一反应体系中不加太阳光只加入pmo12后发现,反应90min时5mg/l染料脱色率达到了98.4%。该结果表明暗反应pmo12对亚甲基蓝有一定的吸附作用和氧化作用。
(3)模拟太阳光照射和光催化剂同时存在的条件下,多酸对mb的光催化降解速度较快,最终脱色率达到99.22%,表明pmo12对mb溶液具有较强的催化能力。而且在没有光照条件下,亚甲基蓝的吸附和氧化降解效率低于光照时的脱色效果,说明光在催化降解反应过程中起重要作用。
3ag@pmo12/h2o2循环利用实验
本发明中通过三次目标污染物mb降解来评价多酸的催化循环能力。第一次循环后,由于本论文合成的pmo12几乎不溶于水,可通过离心将催化剂和反应染料分离,随后多酸在60℃下干燥4h。在相同实验条件下,将重新获得的催化剂用于下一次循环降解。浓度之比cf/ci对时间t作图得到的降解曲线结果如图27所示
由图27可以看出,在pmo12光催化降解mb体系中,经过三次循环后多酸pmo12催化剂活性损失较小。在第三次催化循环结束时,亚甲基蓝染料降解率达到89.87%。这一实验表明相比于pmo12/h2o2体系,单独的pmo12显示出更良好的催化脱色能力。
4光催化前后ag@pmo12的结构
对于太阳光/pmo12体系,在最佳降解条件下进行光催化实验,静置,离心,取多酸样品进行红外光谱测试以表征光催化后样品的结构,结果如图28所示。
由图28可知,光催化前后多酸pmo12的红外光谱图吸收峰位置基本一致,由此可见多酸仍保持着典型的keggin结构骨架,光催化前后结构不变。进一步说明pmo12是作为催化剂参与脱色反应的,而且降解过程中稳定性良好。
综上所述,本节以亚甲基蓝mb作为模型分子,卤钨灯为模拟太阳光光源,对所制备的多酸催化剂pmo12光催化活性进行了考察。结果表明pmo12能够有效地光催化降解亚甲基蓝染料。在催化剂为2g/l,溶液ph3,染料浓度5~20mg/l时,反应50min后降解率最大,达到99.2%左右。
agnps光催化降解mb的实验结果及分析
本论文通过光催化降解亚甲基蓝溶液来评价银纳米粒子agnps材料的光催化性能。在光催化装置中放入总体积50ml的5mg/l亚甲基蓝染料和银纳米粒子溶胶。在卤钨灯照射下通过电磁搅拌使其受光辐射均匀,从而进行光催化降解实验。每间隔一定时间取2ml悬浮液作为样本,离心机高速离心,从而测试上清液的吸光度,实验结果如图3-32和图3-33所示。
图29和图30是亚甲基蓝溶液降解率和吸光度对时间的变化曲线。从图中我们可以看出,无催化剂时,在太阳光照射一定时间下亚甲基蓝的脱色率是30%,表明mb溶液能吸收可见光,且具有一定程度的直接光解。在反应液中加入银纳米粒子溶液后,随着光照时间的增加,cf/ci比值逐渐下降,意味着mb浓度逐渐降低。经过90min后亚甲基蓝的降解率达到39.58%,显示出一定的催化活性。其光催化效果主要归因于材料颗粒的大小,对太阳光的吸收强度等。首先,agnps材料粒径小,比表面积大,对光具有一定吸收能力。其次,在入射太阳光作用下,纳米贵金属银颗粒内部自由电荷发生共振,从而产生表面等离子体共振效应,最终促进了有机污染物的降解反应。
ag@pmo12光催化降解mb的实验结果及分析
1ag@pmo12降解mb优化实验
本论文通过在模拟太阳光下对水溶液中不同浓度有机污染物亚甲基蓝的光催化降解,详细讨论ag@pmo12的光催化活性。在多酸用量2g/l的条件下,不加入30%h2o2,控制溶液ph3,反应100min,考察染料初始浓度对多酸包覆材料降解mb的影响,实验结果见图31和图32。
从图31中观察到染料浓度的变化影响着多酸光催化降解mb的活性。在模拟太阳光条件下,随着反应进行,不同浓度的亚甲基蓝溶液最终脱色率趋于接近。首先,在5~80mg/l浓度范围内,mb染料去除率几乎达到100%。随后,针对90~200mg/l染料,降解率大约在99.93±2%左右。同时催化降解较高浓度的400mg/lmb染料废水时,脱色率降低,仍达到96.60%。说明在ag@pmo12催化剂作用下亚甲基蓝溶液已经被完全降解,证明磷钼酸盐包覆材料具有非常高的光催化降解活性。所以本论文选择5~80mg/l最优浓度范围进行光催化实验。
由图32可知,在最优浓度5~80mg/l范围内,染料浓度越小,光催化反应进行得越快,完全脱色降解所需时间从60min减少到30min。这进一步表明多酸催化剂ag@pmo12在光催化降解有机污染物mb时表现出优异的光催化活性,是一种十分有效的光催化剂。
因此,相比较于pmo12和pmo12/h2o2体系的光催化效果,核壳包覆材料ag@pmo12不仅降解时间短,染料脱色率更高,几乎达到100%。另一个值得注意的优点是:在一定实验范围内,ag@pmo12降解污染物具有较广的5~200mg/l浓度适用范围。该结果表明ag@pmo12的光催化活性明显高于pmo12。
以上结果,主要原因是单独多酸受到hυ大小能量光子的激发,会产生光生电子e-和光生空穴h+,从而作为独立的光催化剂降解有机污染物。但是在光催化降解过程中,e-和h+极易发生耦合,导致光催化反应效率降低。本论文合成的微纳米多酸包覆材料ag@pmo12,多酸颗粒和纳米银颗粒均为光活性物质,并且充分利用pmo12和ag结合的协同影响作用,银纳米颗粒有效减少了多酸中光生电子和光生空穴快速复合的几率,提高了光催化性能。另外,结合微纳米多酸和纳米银颗粒的粒径小和比表面积大的特点,包覆材料的小尺寸效应使光生电子和光生空穴的耦合时间延长,导致其光催化降解活性增加。因而ag@pmo12可在短时间里使mb脱色并降解。
2ag@pmo12对照实验
为了研究杂多酸ag@pmo12对亚甲基蓝溶液的光催化降解效果,对照实验的具体结果和分析如下(参见图33-图35):
(1)在卤钨灯辐射下,直接光解5mg/l亚甲基蓝染料90min未发现其浓度明显变化,脱色率30%。然而实验条件下80mg/l染料光解体系不加入杂多酸,在反应90min后脱色率仅达到16.79%。该结果表明亚甲基蓝溶液经过模拟太阳光照射条件下具有一定程度的直接光解,而且染料浓度越小,模拟太阳光的作用越大。
(2)在无光源照射情况下,多酸分散在5mg/l和80mg/l亚甲基蓝溶液中,经过暗反应90min,对染料的降解率分别是99.9%和99.88%。
(3)相比之下,太阳光/ag@pmo12体系对亚甲基蓝溶液表现出非常高的光催化降解活性,脱色率几乎达到100%左右,降解效果明显。
3ag@pmo12循环利用实验
光催化剂对目标污染物的循环降解能力是评价多酸光催化活性的重要标准之一。在光催化反应装置中加入50ml染料,催化剂2g/l,每次反应时间90min,重复使用3次,考察催化剂稳定性对染料脱色率的影响。图36和图37给出了催化剂ag@pmo12在三次光催化降解mb过程中的活性变化。
由图36可以看出,经过3次催化降解实验,5mg/l亚甲基蓝染料去除率没有发生明显改变,多酸催化活性基本不变。由此表明ag@pmo12是一种很有应用前景的光催化材料,具有较高的研究和应用价值。而且,多酸ag@pmo12每次循环降解mb过程中对太阳光的利用率均大于pmo12和pmo12/h2o2体系。
从图37可知,反应三次结束后,80mg/l染料脱色率下降幅度较大,循环利用效果较差。上述实验结果表明ag@pmo12具有降解时间短、降解效率高、适用浓度范围广和针对低浓度染料循环能力强等优点,成为一种理想光催化剂。然而其在进行高浓度染料光催化性能研究时可能会受到循环降解能力的限制,制约着在光催化方面的实际应用。
4光催化前后ag@pmo12的结构
本论文中通过三次mb染料循环降解后多酸样品的红外光谱表征结果来评价光催化剂反应前后组成结构的变化情况。第一次循环后,催化剂通过离心与反应液分离,随后催化剂在60℃下干燥4h,从而用于红外光谱测定。光催化前后红外光谱分析结果如图38和图39所示。
由图38和图39可以看出,经过三个实验周期后,多酸ag@pmo12的红外光谱图吸收峰位置和光催化前样品位置基本一致,表明光催化后多酸具有keggin结构骨架。由此可见在光催化降解亚甲基蓝溶液过程中,ag@pmo12是作为催化剂参与脱色反应的。
综上所述,本节选择具有典型keggin结构的杂多酸ag@pmo12为研究对象,基于keggin型杂多酸良好的催化性质和氧化还原性质,通过光催化降解实验,探索对亚甲基蓝染料的完全去除。实验结果表明,在催化剂用量2g/l,ph为3,mb浓度5~200mg/l条件下,mb的降解转化率几乎达到100%。进一步说明多酸包覆材料ag@pmo12对染料的光催化活性明显高于多酸pmo12体系,具有脱色时间更短,降解效率更高,适用的染料浓度范围更广泛的特点。
pmo12和ag@pmo12光催化降解mb的机理研究
1h2o2光催化mb的作用机理
过氧化氢(h2o2)又名双氧水,是一种良好的绿色氧化剂,其来源广泛、无腐蚀性和易处理,因此引起了学者们的很大关注。过氧化氢分子中氧的价态是-1,可以转化为-2价,表现氧化性,从而广泛用于处理各种有机污染物。同时,h2o2的氧化电位是1.80v,理论上是一种非常有效的氧化剂,然而其单一使用氧化去除能力较弱。但可以利用紫外光uv和过氧化氢h2o2联合作用手段,使o=o键裂解产生具有强氧化能力的·oh,进而增强对有机物的降解。在太阳光/pmo12/h2o2体系光催化降解mb过程中,通过添加羟基自由基捕获剂(叔丁醇)来进一步判断作用机理,脱色率对时间t作图得到的降解曲线结果见图40。
如图40所示,在模拟太阳光照射条件下,由反应体系中添加1mm叔丁醇的光解实验发现,反应100min后mb的脱色率是94.94%,染料降解受到抑制。这是由于叔丁醇比较稳定,不易被氧化,是常见的羟基自由基猝灭剂。在水溶液中其与·oh快速发生反应,随之中断整个自由基链反应,从而影响光催化效率。因此可以判断·oh在此催化体系中起到一定作用。然而相比于太阳光/pmo12/h2o2体系光催化反应,染料浓度降低幅度不大,表明羟基自由基不是当前体系光催化降解过程中的主要氧化物种。
2多酸光催化mb的作用机理
一般来说,多金属氧酸盐光催化降解有机污染物主要通过多酸自由基或者羟基自由基来控制,它们对有机污染物的降解反应起到决定性作用,对应的机理是多酸自由基机理和羟基自由基机理。在pmo12和ag@pmo12体系光催化降解亚甲基蓝染料过程中,通过对羟基自由基的捕获来判断多酸的作用机理,结果示于图41和图42。
由图41和图42可知,在模拟太阳光照射下,向反应中添加1mm羟基捕获剂(叔丁醇),光催化降解mb效率基本没有受到抑制。由此推测在当前降解体系中羟基自由基不是起到主要作用,因为如果体系中·oh是有效的氧化剂,添加叔丁醇后mb去除率会迅速降低。进一步说明多酸pmo12和ag@pmo12光催化降解mb中,多酸自由基是发挥作用的主要活性物质。
上述实验结果表明,在多酸pmo12和ag@pmo12光催化降解mb过程中,当一个具有hυ大小能量的光子射入,多酸pom具有较高响应活性,产生多酸自由基,同时该过程伴随着光生电子和光生空穴的产生。进而多酸自由基降解目标污染物亚甲基蓝,达到催化的目的。
结论
本章采用水热合成法成功制备了keggin型饱和磷钼酸盐pmo12及其包覆材料ag@pmo12。通过傅里叶红外光谱、x射线粉末衍射、紫外-可见吸收光谱和扫描电子显微镜等测试手段证实了所制备的两种多酸均具有典型的keggin结构骨架。而且xrd图和sem图说明制备的包覆材料含有立方银纳米粒子。与此同时,以亚甲基蓝为目标污染物,研究了pmo12和ag@pmo12材料的催化降解能力。实验结果表明:
(1)利用pmo12/h2o2体系降解亚甲基蓝染料,在催化剂用量2g/l,h2o2用量0.2ml,溶液ph为3,mb浓度5mg/l的条件下,反应60min后脱色率最佳,达到98.44%。
(2)采用单独pmo12进行催化降解反应,在催化剂浓度2g/l,溶液ph3,染料浓度5~20mg/l时,反应50min后mb去除率最大,达到99.2%左右。
(3)在ag@pmo12光催化降解亚甲基蓝染料过程中,在催化剂用量2g/l,ph3,mb浓度5~200mg/l条件下,mb溶液被完全降解,脱色率几乎达到100%。
以上合成的两种多金属氧酸盐,在光催化反应中均表现出较高催化活性。其中,以ag@pmo12的光催化活性尤为出色。本项目研究成果为日后合成新的多酸结构化合物和探讨其催化性质提供了新的思路。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!